提取方法对产朊假丝酵母β-葡聚糖性质的影响
2018-06-19刘蓝天
马 霞,刘蓝天,沈 丽,邵 丽,*
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.莱博药妆技术(上海)股份有限公司,上海 200233)
酵母β-葡聚糖(yeast β-glucan,YG)是一种最具生物活性的葡聚糖,与一般糖类不同的是,酵母β-葡聚糖不是线性分子的结构,而是一种独特的三重超微螺旋结构,所以其免疫功能和生物活性最强[1]。β-葡萄糖的生物活性又取决于其结构、分子质量、纯度和构象等[2]。有报道称免疫反应与β-葡聚糖及其分子结构大小、分支结构修饰、构象和溶解度之间有相关性[3]。产朊假丝酵母(Candida utilis)作为美国食品药品管理局认证的可食用酵母,其细胞壁中也含有β-葡聚糖[4],且产朊假丝酵母可以利用工业废水生产可食用蛋白和β-葡聚糖[5],有很好的研究价值。
酵母β-葡聚糖的制备过程中,对产朊假丝酵母进行破壁是尤其重要的步骤,葡聚糖的提取纯度和得率得益于好的破壁效果。朱益波等[6]采用复合酶解生物法处理啤酒酵母的提取物可减少蛋白质的含量,显著提高产物的纯度,同时使提取物的得率提高到13.7%。Williams等[7]采用高压微射流均质法制备的酵母β-葡聚糖,既保持了β-葡聚糖的生理活性,又能产业化应用,且得到的分子质量不同于其他方法制备的β-葡聚糖。李红梅等[8]采用自溶超声波法提取酵母β-葡聚糖得率是未采用自溶处理的2 倍。β-葡聚糖是大分子的多糖,采用不同的破壁方法,可能会引起多糖链不同程度的水解[9-13],带来多糖纯度、理化性质(分子质量分布)和生物活性的差异。
研究表明不同分子质量的β-葡聚糖具有不同的生理活性[14]。戴宏杰等[15]研究发现,碱提多糖具有良好的自由基清除能力和保湿性能。Liepins等[16]的研究表明不同纯度和不同含水量的β-葡聚糖之间的生理活性差别较大,含水量少者有较高的免疫活性。目前有关高压微射流均质法、超声波法以及复合酶解法等破壁方法提取酵母β-葡聚糖的相关报道很多,也是主流的提取方法,但关于不同提取方法获得的酵母β-葡聚糖的理化性质和生理功能之间是否存在差异的相关研究不多。本研究拟采用高压微射流均质法、超声波法以及复合酶解法提取产朊假丝酵母的细胞壁多糖,并对其多糖的纯度、分子质量分布以及清除自由基能力和保湿性能进行比较研究。
1 材料与方法
1.1 材料与试剂
产朊假丝酵母(CICC 1769) 中国工业微生物菌种保藏管理中心;中性蛋白酶、甘露聚糖酶、岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖及果糖标准品 美国Sigma-Aldrich公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazylradical,DPPH)、2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT) 上海Adamas-beta公司;DMEM(Dulbecco’s modified Eagle medium)培养基(胎牛血清) 美国Gibco公司;二甲基亚砜 北京索来宝科技有限公司;0.5%胰蛋白酶-乙二胺四乙酸 美国Life Technologies公司;逆转录试剂盒 日本TAKARA公司;RNA fast200总RNA极速抽提试剂盒 上海飞捷生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Panda Plus高压均质机 上海杭杰生物科技有限公司;超声波细胞破碎仪 宁波新芝生物科技股份有限公司;离子色谱仪 沃特世科技(上海)有限公司;八角度激光光散射仪 美国Wyatt公司;傅里叶变换红外光谱仪 德国Bruker公司;紫外-可见分光光度计上海元析仪器有限公司;CO2细胞培养箱 美国Thermo公司;荧光倒置相差显微镜 日本Olympus有限公司;荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司。
1.3 方法
1.3.1 酵母β-葡聚糖的提取
以土豆淀粉废弃液作为培养基培养产朊假丝酵母,收集菌体,用去离子水多次洗涤,用5%(质量分数,下同)的NaCl溶液配制10%的菌悬液,在65 ℃下诱导细胞壁自溶20 h,经离心(4 500×g,10 min)、洗涤后,将沉淀溶解在20 mmol/L pH 7.5磷酸盐缓冲液(phosphate buあered saline,PBS)中配制成20%待提取液,于90 ℃、130 r/min下高温振荡提取6 h,多次洗涤后得细胞壁沉淀(cell wall precipitation,CWP)[17-20]。
1.3.1.1 高压微射流均质法提取
将CWP配成10%的悬浮液200 mL,使用高压微射流均质处理CWP的悬浮液,处理压力为120 MPa,循环6 次,沉淀用蒸馏水洗涤3 次。所得沉淀再次用高压微射流第2次处理,压力为150 MPa,循环3 次,沉淀洗涤3 次,再用高压微射流按第2次处理条件进行高压微射流第3次处理,10 000 r/min离心10 min得到的沉淀,洗涤3 次后用无水乙醇去脂脱水,Sevag法除蛋白质后进行冷冻干燥,得到酵母β-葡聚糖样品H-YG。
1.3.1.2 超声波法提取
将CWP制备成5%的菌悬液,超声破壁处理,超声时间60 min,超声功率800 W,持续1 s、间隔1 s,探头直径为25 mm。得到的超声波破碎液进行干燥浓缩,索氏抽提去除脂质,Sevag法除去蛋白质后冷冻干燥,得到酵母β-葡聚糖样品U-YG。
1.3.1.3 复合酶解法提取
将CWP用无水乙醇脱水后进行真空干燥和脱脂处理,干燥后的CWP用去离子水配成料液比为1∶20的溶液,分别加入2%的中性蛋白酶和甘露聚糖酶[21],pH值调为7.0,在50 ℃中酶解60 min。冷却至室温后,抽滤除去酶颗粒,滤液进行高温灭酶处理,10 000 r/min离心10 min,取沉淀洗涤,溶解后,放入MWCO 14000的透析袋中用去离子水透析24 h,每隔6 h换水一次,再经冷冻干燥得到酵母β-葡聚糖样品E-YG。
1.3.2 酵母β-葡聚糖的理化性质测定
1.3.2.1 酵母β-葡聚糖含量和得率的测定
以葡萄糖为标准,采用苯酚-硫酸法测定样品中的酵母β-葡聚糖含量[22],得到标准曲线的回归方程:Y=6.010 3X+0.066 5(R2=0.998 9)。酵母β-葡聚糖得率r按式(1)计算[23]。

式中:mg为酵母β-葡聚糖的质量/g;mj为酵母菌菌体干质量/g。
1.3.2.2 蛋白质、脂质及水分质量分数的测定
采用GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》、GB/T 5009.6—2003《食品中脂肪的测定》和GB 5009.3—2010《食品安全国家标准 食品中水分的测定》的方法测定蛋白质、脂质含量及水分质量分数。
1.3.3 紫外光谱分析
用去离子水将多糖配成0.2 mg/mL的溶液,充分溶解后用紫外-可见分光光度计在190~400 nm波长处对样品进行全扫描。
1.3.4 单糖组成的测定
采用三氟乙酸(trifluoroacetic acid,TFA)水解多糖样品,参照文献[19-20]的单糖组成分析方法并修改,用离子色谱进行单糖组成的测定。色谱条件:流动相A:去离子水;流动相B:0.25 mol/L NaOH;流动相C:1 mol/L NaAc;采用梯度洗脱,洗脱程序为:0~30 min流动相A、B、C分别为99.2%、0.8%和0%;30.1~40.0 min流动相A、B、C分别为79.2%、0.8%和20.0%;40.1~60.0 min流动相A、B、C分别为20.0%、80.0%和0%;60.1 min流动相A、B、C分别为99.2%、0.8%和0%。流速为0.45 mL/min;上样量为25 mL;时间120 min。色谱柱为CarboPac PA20阴离子交换分析柱(150 mm×3 mm),LC30柱温箱温度为30 ℃,检测器为ED50A电化学检测器。
1.3.5 分子质量的测定
参照文献[24-26]的方法并修改,采用高效体积排阻色谱与多角度激光光散射联用仪对分子质量进行测定。色谱柱为TSK PWXL 4000和TSK PWXL 6000串联,检测器为示差折光检测器和DAWN8+型激光检测器。洗脱程序为等度洗脱,流速0.5 mL/min,柱温35 ℃,流动相为0.15 mol/L的NaNO3和0.05 mol/L的NaH2PO4溶液。用Astra数据分析软件采集并分析光散射的数据,计算分子质量。
1.3.6 红外光谱分析
采用KBr压片法,对多糖样品在4 000~500 cm−1范围内进行红外光谱扫描。
1.3.7 DPPH自由基清除能力的测定
参照文献[27]的方法,以VC和BHT作为阳性对照组,在517 nm波长处测定吸光度A,按照公式(2)计算DPPH自由基的清除率。
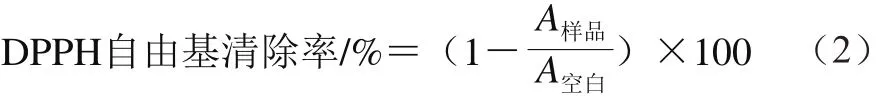
1.3.8 酵母β-葡聚糖体外保湿性能测定
参照文献[23]的方法并修改,测定0.1%的酵母β-葡聚糖样品在0~24 h的体外保湿率,同时以去离子水、甘油、聚乙二醇(polyethylene glycol-400,PEG-400)作为对照。
1.3.9 酵母β-葡聚糖对内源性保湿因子生成的影响
1.3.9.1 HaCaT细胞的培养
将处于对数生长期的HaCaT细胞以3×105~4×105个/孔分至6 孔板内,补足DMEM培养基至1.5 mL。待细胞贴壁过夜后,加入低钙培养基,同时加入10 μg/mL和20 μg/mL的H-YG、U-YG及E-YG。置于37 ℃、5% CO2饱和湿度条件下培养72 h。
1.3.9.2 细胞总RNA的提取
细胞总RNA的提取按照试剂盒说明书的提取步骤进行。
1.3.9.3 RNA的逆转录
反应程序:37 ℃,15 min;85 ℃,15 s;4 ℃,60 min。根据逆转录试剂盒说明书进行操作,配制20 μL逆转录反应体系。
1.3.9.4 实时荧光定量PCR
以逆转录的cDNA为模板,选用β-肌动蛋白(β-actin)作为内参基因,以合成的序列对为特异性引物,按照试剂盒说明书进行实时荧光定量PCR扩增。PCR程序为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,进行40 个循环。溶解曲线的设置条件:72 ℃,5 min;95 ℃,15 s;60 ℃,15 s;95 ℃,15 s。以2−△△Ct法计算分析数据。
2 结果与分析
2.1 不同提取方法制备酵母β-葡聚糖的比较
2.1.1 样品理化性质分析
对3 种提取方法制备的酵母β-葡聚糖的得率和多糖、蛋白质、脂质含量以及水分质量分数的测定结果及样品的色泽和组织形态观察比较如表1所示。
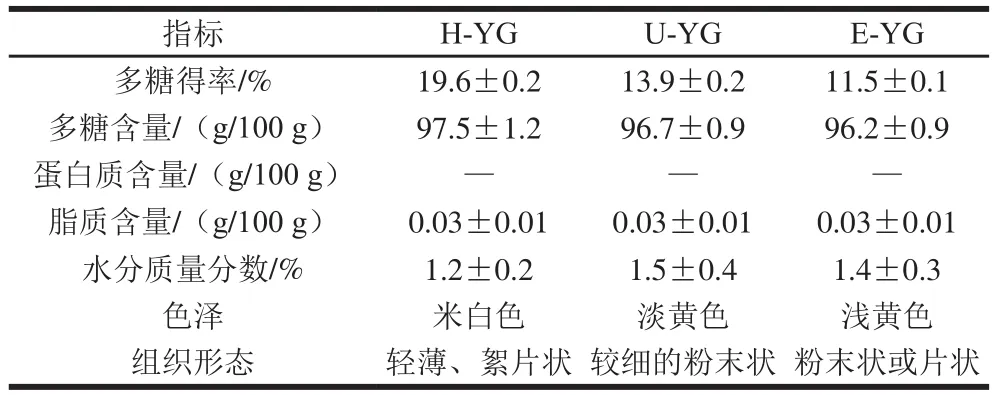
表1 3 种提取方法的样品理化性质测定结果Table 1 Physicochemical properties of H-YG, U-YG and E-YG
从表1可以看出,H-YG、U-YG和E-YG样品中多糖含量分别为97.5、96.7、96.2 g/100 g,都明显高于酶碱法提取的多糖含量(86.81 g/100 g)[28]:其中用高压微射流均质法提取得到的H-YG样品中多糖的得率最高,为19.6%,高于水提β-葡聚糖法的多糖得率(17.3%)[29-30];凯氏定氮法测定样品中蛋白质含量的结果显示样品中不含蛋白质,样品纯度明显高于文献[27]报道的结果;索氏抽提测得脂肪含量为0.03 g/100 g,说明制备的样品较纯,制备过程不仅绿色可行还能得到纯度较高的酵母β-葡聚糖;冷冻干燥后的样品还含有微量的水分;从色泽和组织形态上观察样品,发现H-YG呈较浅的米白色絮片状固体,U-YG为淡黄色的较细的粉末,E-YG为浅黄色的粉末或片状固体。所以,不同提取方法制备得到的酵母β-葡聚糖样品颜色和外观上存在一定的区别。综上所述,用这3 种方法制备产朊假丝酵母菌β-葡聚糖得率和纯度都相对较高,有较好的研究价值。
2.1.2 紫外光谱分析

图1 H-YG、U-YG和E-YG样品的紫外全扫描光谱图Fig. 1 UV scanning spectra of H-YG, U-YG and E-YG
在波长190~400 nm范围内对H-YG、U-YG和E-YG样品进行紫外扫描,从图1中可以看出,H-YG、U-YG和E-YG在280 nm和260 nm处均没有吸收峰,说明H-YG、U-YG和E-YG中不含有蛋白质和核酸等杂质。所以,酵母β-葡聚糖H-YG、U-YG和E-YG可广泛应用于纯度要求较高的产品中。
2.1.3 单糖组成分析
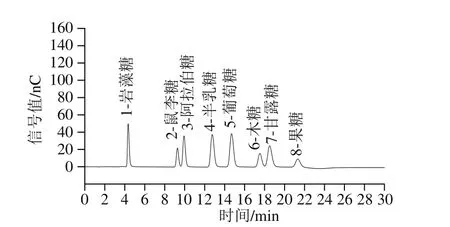
图2 混合标准品的单糖组成色谱图Fig. 2 High performance anion exchange chromatograms of mixed monosaccharide standards

图3 E-YG样品的单糖组成色谱图Fig. 3 High performance anion exchange chromatogram of monosaccharides in E-YG
H-YG、U-YG和E-YG样品经TFA水解后,采用高效离子色谱测定单糖组成。以E-YG样品的单糖离子色谱图为例(图3),对照图2混合标准品单糖的图谱,单糖组成离子色谱图样品的出峰时间与其一致,均为14.9 min,对应葡萄糖,说明这3 种提取纯化方法得到的H-YG、U-YG和E-YG样品中不含其他单糖组分,都是由葡萄糖聚合形成的葡聚糖。
2.1.4 红外光谱分析

图4 3 种不同制备方法得到的多糖的红外光谱图Fig. 4 Infrared spectra of H-YG, U-YG and E-YG
从图4中可以看出,3 种方法提取的酵母β-葡聚糖的图谱大致相同,都含有典型的糖类特征吸收峰,在3 336、3 324、3 329 cm−1处有强的—OH吸收峰;在2 925、2 927、2 925 cm−1处有—CH、—CH2的吸收峰;在1 634、1 649、1 649 cm−1处为多糖的水合振动峰。H-YG、U-YG、E-YG分别在1 035、1 039、1 075 cm−1处有吡喃糖的特征吸收峰。在890 cm−1附近的峰为β型的糖苷键特征峰。H-YG、U-YG和E-YG图谱在890 cm−1附近都有吸收,说明H-YG、U-YG和E-YG葡聚糖样品糖环构型都是β-D-吡喃葡萄糖环。3 种样品在810 cm−1附近均无吸收峰,证明样品中没有甘露糖的存在。
2.1.5 酵母β-葡聚糖的分子质量

表2 3 种提取方法得到的样品分子质量Table 2 Molecular masses of H-YG, U-YG and E-YG
采用高效体积排阻色谱与多角度激光光散射联用仪对3 种方法提取的酵母β-葡聚糖进行分子质量分布分析,结果如表2所示。H-YG、U-YG和E-YG的mw分别为1.611×106、4.763×106、2.661×105g/mol,平均分子半径分别为67.5、33.3、43.7 nm,复合酶解法提取的β-葡聚糖mw较小,说明复合酶解法可能在提取的过程中降解了部分葡聚糖的连接键。mw/mn是多糖的多分散系数(d),d值越接近1,说明样品中分子质量分布的越集中。高压微射流均质法和超声波法提取的样品H-YG和U-YG的mw较为相近,但从多糖的分散系数来看,高压微射流均质法制备的酵母β-葡聚糖样品H-YG的分子质量分布窄,而U-YG的分子质量分布较宽,H-YG优于U-YG。同时,可以看到对3 种方法提取的酵母β-葡聚糖的分子半径也是不同的,说明多糖的分子构象也是存在差异的,进而可能会引起功能之间的差异。超声波法和复合酶解法提取的样品U-YG和E-YG的平均分子半径相差不大。研究表明,大分子质量的β-葡聚糖能够显著降低血脂、血糖浓度,保护心血管[30]。综上分析,H-YG、U-YG和E-YG样品有应用于降血糖、降血脂等保健食品中的潜力。
2.2 酵母β-葡聚糖清除DPPH自由基的能力
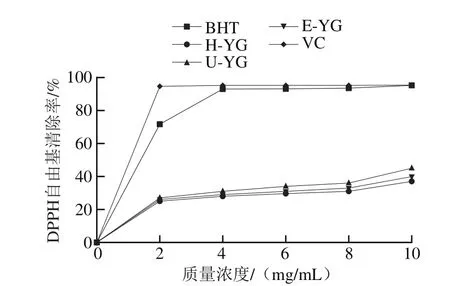
图5 3 种方法提取样品对DPPH自由基的清除能力Fig. 5 DPPH radical scavenging capacity of H-YG, U-YG and E-YG
以BHT和VC作为阳性对照物,比较H-YG、U-YG和E-YG清除DPPH自由基的能力。由图5可以看出,H-YG、U-YG和E-YG样品都具有DPPH自由基清除能力,随着样品质量浓度的增加清除率也逐渐增大。结果表明,产朊假丝酵母的β-葡聚糖都具有DPPH自由基清除能力,有一定的抗氧化活性,不同方法提取得到的样品之间的抗氧化活性没有明显区别,U-YG样品的DPPH自由基清除能力相对较强,为45.2%,在此结果的基础上,可以通过酵母β-葡聚糖的增溶提高其自由基清除能力,进一步提高酵母β-葡聚糖在抗氧化活性方面的应用潜力,从而将其广泛应用于抗氧化产品的开发。
2.3 酵母β-葡聚糖的保湿能力
2.3.1 酵母β-葡聚糖体外保湿能力
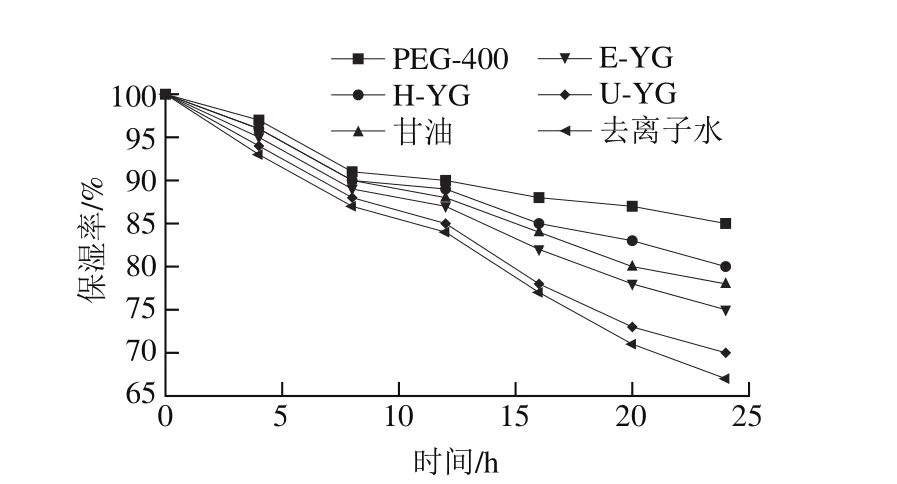
图6 酵母β-葡聚糖的保湿率Fig. 6 Moisture retention capacity of H-YG, U-YG and E-YG
0.1%的酵母β-葡聚糖样品H-YG、U-YG、E-YG、去离子水、甘油以及PEG-400在0~24 h范围内的保湿效果如图6所示。H-YG、U-YG、E-YG、甘油及PEG-400都可以明显缓解水分的散失,在去离子水中加入这些样品都可以起到保湿的效果,且都高于彭永健等[23]研究中最佳质量分数5%多糖的保湿率(60%)。PEG-400的保湿效果最强,H-YG和常用的保湿剂甘油在0~8 h的保湿效果相当,但H-YG在8~24 h的保湿效果明显优于甘油。从24 h的实验结果可知,保湿效果依次为:PEG-400>H-YG>甘油>E-YG>U-YG>去离子水。综上分析,H-YG有较强的保湿锁水能力,具有作为需要保持一定湿度的生鲜食品的优良保湿剂的潜力。
2.3.2 酵母β-葡聚糖促进内源性天然保湿因子的生成
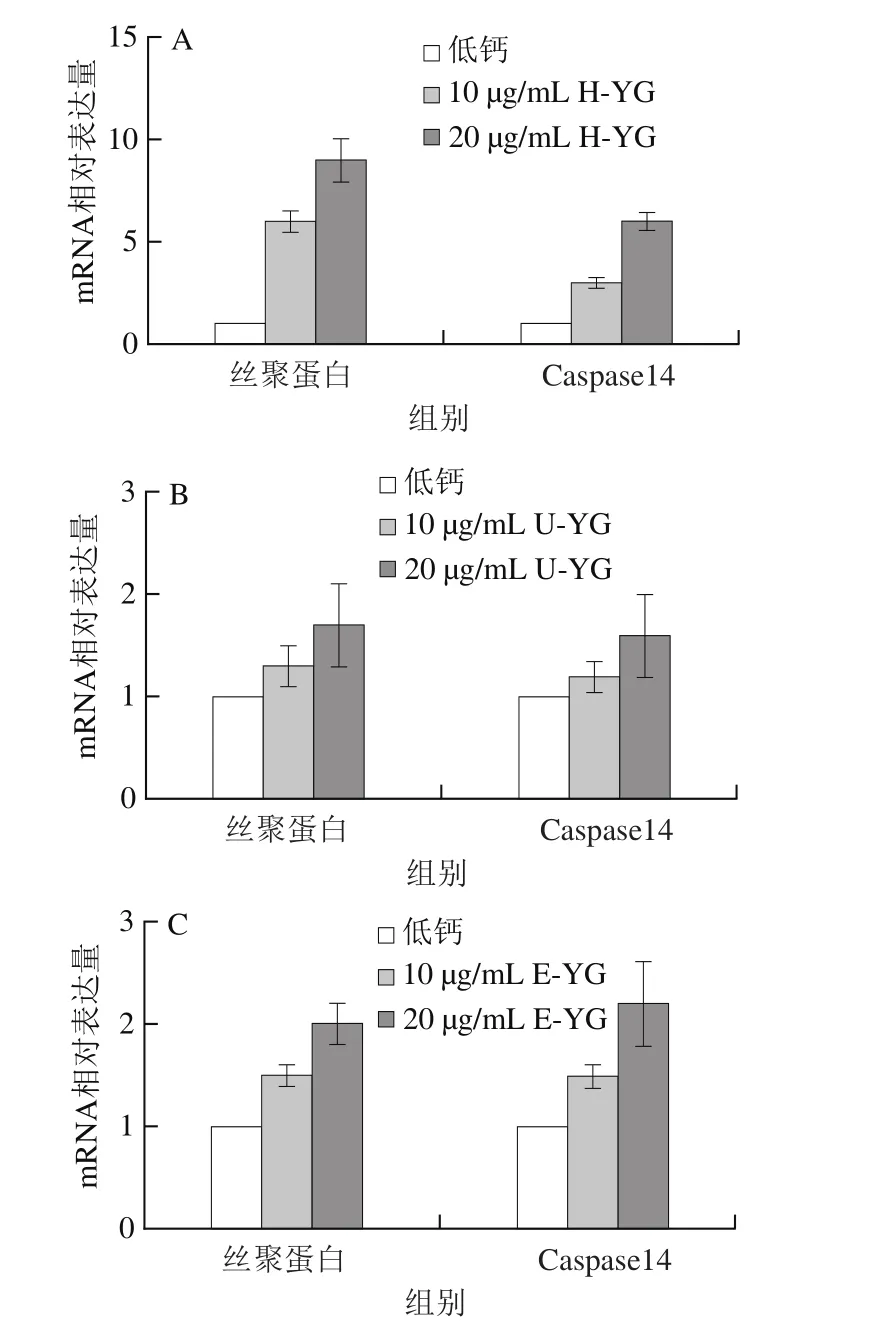
图7 H-YG(A)、U-YG(B)和E-YG(C)样品对HaCaT细胞分化丝聚蛋白和caspase14表达的影响Fig. 7 Effects of H-YG (A), U-YG (B) and E-YG (C) on the expression of filaggrin and caspase14 in HaCaT cell differentiation marker
选用人皮肤细胞HaCaT来研究β-葡聚糖的内源保湿性能,丝聚蛋白和半胱氨酸天冬氨酸特异性蛋白酶-14(caspase14)在维持表皮细胞的稳态平衡及形成天然保湿因子中起重要作用,可保持角质层的含水量,达到皮肤保湿作用。天然保湿因子的产生又与丝聚蛋白和caspase14的表达有正相关的密切关系。由图7可知,在低钙条件下,用样品H-YG、U-YG和E-YG(10、20 μg/mL)处理细胞72 h,通过实时荧光定量PCR检测发现,10 μg/mL和20 μg/mL的H-YG、U-YG及E-YG样品能够提高人角质形成细胞株HaCaT细胞分化丝聚蛋白和caspase14的表达水平。其中,H-YG样品在10 μg/mL质量浓度即可显著促进HaCaT细胞分化丝聚蛋白和caspase14的表达。从图7可以看出,样品H-YG、U-YG和E-YG都具有促进内源性天然保湿因子生成的功能,H-YG样品的促进天然保湿因子表达生成作用最为明显,综上分析,对HaCaT细胞分化丝聚蛋白和caspase14的促进表达效果依次为:H-YG>E-YG>U-YG,高压微射流均质法提取的酵母β-葡聚糖H-YG可从源头上对细胞起到较好的保湿效果,在生鲜食品等领域中具有非常好的应用前景。
3 结 论
本实验比较了高压微射流均质法、超声波法及复合酶解生物法提取产朊假丝酵母β-葡聚糖所得H-YG、U-YG和E-YG的理化性质、功能特性(抗氧化和保湿性能)等的差异。3 种方法都属于比较天然绿色的提取方法,单从提取纯度上讲,3 种方法都适合酵母β-葡聚糖的提取。通过比较分析,发现这3 种方法提取的β-葡聚糖在提取率、分子质量分布、多糖的分散系数以及平均分子半径上都存在差异,进而表现为H-YG、U-YG和E-YG清除DPPH自由基能力和保湿性能的不同。β-葡聚糖作为长链的多糖分子,采用不同的破壁方法可能会引起多糖链的不同程度的水解,带来多糖理化性质和生物活性的差异。本实验为酵母β-葡聚糖的应用及后续进一步了解其结构和功能的关系、研究多糖的初级结构和高级结构(链构象)提供了一定的理论依据。
[1] OLIVEIRA K S M, DI BASTIANI M, CORDEIRO L M C, et al.(1→6)- and (1→3)(1→6)- β-glucans from Lasiodiplodia theobromae MMBJ: structural characterization and pro-inflammatory activity[J].Carbohydrate Polymers, 2015, 133: 539-546. DOI:10.1016/j.carbpol.2015.07.060.
[2] BSZCZYK K, WILCZAK J, HARASYM J, et al. Impact of low and high molecular weight oat beta-glucan on oxidative stress and antioxidant defense in spleen of rats with LPS induced enteritis[J]. Food Hydrocolloids, 2015, 51: 272-280. DOI:10.1016/j.foodhyd.2015.05.025.
[3] NYMAN A A, AACHMANN F L, RISE F, et al. Structural characterization of a branched (1→6)-α-mannan and β-glucans isolated from the fruiting bodies of Cantharellus cibarius[J]. Carbohydrate Polymers, 2016, 146: 197-207. DOI:10.1016/j.carbpol.2016.03.052.
[4] BENITO-ROMAN O, ALONSO E, COCERO M J, et al. β-Glucan recovery from Ganoderma lucidum by means of pressurized hot water and supercritical CO2[J]. Food and Bioproducts Processing, 2016, 98:21-28. DOI:10.1016/j.fbp.2015.12.007.
[5] BZDUCHA-WRBEL A, BAEJAK S, MOLENDA M, et al. Erratum to: biosynthesis of β-(1,3)/(1,6)-glucans of cell wall of the yeast Candida utilis, ATCC 9950 strains in the culture media supplemented with deproteinated potato juice water and glycerol[J]. European Food Research and Technology, 2015, 240(6): 1281-1282. DOI:10.1007/s00217-014-2406-6.
[6] 朱益波, 翟丽君, 朱明, 等. 啤酒废酵母中β-D-葡聚糖非降解提取工艺[J]. 食品科学, 2011, 32(20): 121-125.
[7] WILLIAMS R, DIAS D A, JAVASINGHE N, et al. Beta-glucandepleted, glycopeptide-rich extracts from brewer’s and baker’s yeast(Saccharomyces cerevisiae) lower interferon-gamma production by stimulated human blood cells in vitro[J]. Food Chemistry, 2016, 197:761-768. DOI:10.1016/j.foodchem.2015.11.015.
[8] 李红梅, 王伟洁, 侯堃, 等. 自溶超声波耦合法提取啤酒废酵母中β-1,3-D-葡聚糖[J]. 精细化工, 2014, 31(1): 45-49. DOI:10.13550/j.jxhg.2014.01.008.
[9] KIM K S, YUN H S. Production of soluble β-glucan from the cell wall of Saccharomyces cerevisiae[J]. Enzyme & Microbial Technology,2006, 39(3): 496-500. DOI:10.1016/j.enzmictec.2005.12.020.
[10] RIEDER A, KNUTSEN S H, BALLANCE S. In vitro, digestion of beta-glucan rich cereal products results in extracts with physicochemical and rheological behavior like pure β-glucan solutions-a basis for increased understanding of in vivo eあects[J]. Food Hydrocolloids, 2017, 67: 74-84. DOI:10.1016/j.foodhyd.2016.12.033.[11] YIN H F, FAN G J, GU Z X. Optimization of culture parameters of selenium-enriched yeast (Saccharomyces cerevisiae) by response surface methodology (RSM)[J]. LWT-Food Science and Technology,2010, 43(4): 666-669. DOI:10.1016/j.lwt.2009.11.010.
[12] 刘松, 董晓芳, 佟建明. 多糖提取和抗氧化活性评价方法的研究现状和进展[J]. 动物营养学报, 2016, 28(11): 3391-3399. DOI:10.3969/j.issn.1006-267x.2016.11.004.
[13] ZHU F, DU B, XU B. A critical review on production and industrial applications of β-glucans[J]. Food Hydrocolloids, 2016, 52: 275-288.DOI:10.1016/j.foodhyd.2015.07.003.
[14] ROCA C, CHAGAS B, FARINHA I, et al. Production of yeast chitin-glucan complex from biodiesel industry byproduct[J].Process Biochemistry, 2012, 47(11): 1670-1675. DOI:10.1016/j.procbio.2012.04.004.
[15] 戴宏杰, 孙玉林, 杨梅语, 等. 拟目乌贼生殖腺碱提多糖的抗氧化及吸湿保湿特性[J]. 食品科学, 2016, 37(2): 31-38. DOI:10.7506/spkx1002-6630-201602006.
[16] LIEPINS J, KOVACOVA E, SHVIRKSTS K, et al. Drying enhances immunoactivity of spent brewer’s yeast cell wall β-D-glucans[J].Journal of Biotechnology, 2015, 206: 12-16. DOI:10.1016/j.jbiotec.2015.03.024.
[17] FREIMUND S, SAUTER M, KAPPELI O, et al. A new non-degrading isolation process for 1,3-β-D-glucan of high purity from baker’s yeast Saccharomyces cerevisiae[J]. Carbohydrate Polymers, 2003, 54(2):159-171. DOI:10.1016/s0144-8617(03)00162-0.
[18] KOYAMA Y, ZHAO R, IKE M, et al. Candida utilis, assimilates oligomeric sugars in rice straw hydrolysate via, the Calcium-Capturing-by-Carbonation (CaCCO) process for glutathione- and cellbiomass production[J]. Bioresource Technology, 2014, 172: 413-417.DOI:10.1016/j.biortech.2014.08.097.
[19] MOKHTARI S, JAFARI S M, KHOMEIRI M. The cell wall compound of Saccharomyces cerevisiae, as a novel wall material for encapsulation of probiotics[J]. Food Research International, 2017, 96:19-26. DOI:10.1016/j.foodres.2017.03.014.
[20] 刘红芝, 王强, 周素梅, 等. 酵母β-葡聚糖的功能活性及其分离提取研究进展[J]. 食品科学, 2006, 27(11): 552-556. DOI:10.3321/j.issn:1002-6630.2006.11.138.
[21] 赵月菊, 薛燕芬, 马延和. β-甘露聚糖酶的结构生物学研究现状和展望[J]. 微生物学报, 2009, 49(9): 1131-1137. DOI:10.13343/j.cnki.wsxb.2009.09.001.
[22] 宋博, 赵峡, 李国强. 1 种南海软珊瑚多糖的提取、分离及活性评价[J]. 中国海洋药物, 2016, 35(5): 1-6. DOI:10.13400/j.cnki.cjmd.2016.05.001.
[23] 彭永健, 张安强, 马新, 等. 玉竹多糖超声提取工艺优化及其保湿性研究[J]. 食品科学, 2012, 33(14): 96-99.
[24] 唐川, 吴迪, 杨焱, 等. 猴头菌细胞壁多糖的提取和其结构特征[J].食品与生物技术学报, 2016, 35(8): 871-877. DOI:10.3969/j.issn.1673-1689.2016.08.013.
[25] SHAO L, WU Z, ZHANG H, et al. Partial characterization and immunostimulatory activity of exopolysaccharides from Lactobacillus rhamnosus KF5[J]. Carbohydrate Polymers, 2014, 107(1): 51-56.DOI:10.1016/j.carbpol.2014.02.037.
[26] WANG Y J, MAINA N H, EKHOLM P, et al. Retardation of oxidation by residual phytate in purified cereal β-glucans[J]. Food Hydrocolloids,2017, 66: 161-167. DOI:10.1016/j.foodhyd.2016.11.019.
[27] 杨学山, 祝霞, 李颍, 等. 葡萄酒泥酵母制备水溶性β-D-葡聚糖工艺优化及其纯化后抗氧化性分析[J]. 食品科学, 2016, 37(14): 24-31.DOI:10.7506/spkx1002-6630-201614005.
[28] 宫艳艳, 徐学明. 不同提取方法对酵母葡聚糖性质的影响[J]. 食品工业科技, 2008(9): 162-165. DOI:10.13386/j.issn1002-0306.2008.09.035.
[29] 潘妍, 吴昊, 罗晶杰, 等. β-葡聚糖提取分离工艺及其分子量测定研究[J]. 食品科学, 2009, 30(20): 49-52.
[30] LIU X Y, WANG Q, CUI S W, et al. A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J].Food Hydrocolloids, 2008, 22(2): 239-247. DOI:10.1016/j.foodhyd.2006.11.008.
