紫外线等离子体复合诱变解淀粉芽孢杆菌提高NAG 产量
2018-06-19黎恒张琳陈红爽张孟阳黄娟张岚王德培
黎恒,张琳,陈红爽,张孟阳,黄娟,张岚,王德培
(工业发酵微生物教育部重点实验室,省部共建食品营养与安全国家重点实验室,天津科技大学生物工程学院,天津300457)
N-乙酰-D-氨基葡萄糖(N-acetyl-D-glucosamine,NAG)是氨基葡萄糖(glucosamine,GlcN)的乙酰化衍生物,是生物细胞内许多重要多糖的基本组成单位,其在治疗关节炎、抑制肿瘤和抗氧化等方面有明显效果,被广泛应用于医疗、化妆品以及食品行业[1-3],市场需求巨大。目前生产NAG的方法主要是甲壳素酸水解法[4]和化学合成法[5],但因环境污染巨大以及存在过敏风险等因素,安全环保且生产周期短的微生物发酵法开始被关注和研究。而采用微生物发酵法生产NAG,关键在于菌株,目前国内外研究方向主要是一些霉菌、大肠杆菌及芽孢杆菌,其发酵产量均不太理想[6-8],因此通过分子改造或诱变选育来筛选高产菌株具有非常重要的意义。
等离子体诱变是近年来发展迅速的一种物理诱变手段,由自由基、带电粒子、中性粒子、光子等多种离子组成的等离子束作用于目标菌株,具有高突变率和突变株遗传稳定性良好的特点,被广泛地应用于菌种诱变[9]。与分子手段相比,等离子体诱变育种具有操作简便、安全无毒、低成本的优点[10]。多功能等离子体诱变 系 统 (multifunction plasma mutagenesis system,MPMS)作为一种新一代微生物诱变平台,以等离子体诱变为主,可与紫外、化学诱变等多种手段结合,又再次提高了突变率和突变类型[11]。本试验首次采用等离子体-紫外复合诱变,对解淀粉芽孢杆菌BI2进行诱变,通过对复合诱变条件的探究,以期来提高BI2产NAG的能力。
1 材料与方法
1.1 材料
1.1.1 菌株
解淀粉芽孢杆菌BI2(Bacillus amyloliquefaciens BI2)由天津科技大学生化过程与技术研究室自秸秆饲料中分离得到,中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏号:CGMCC No.3413。
1.1.2 试剂
无水葡萄糖、氯化钠、(NH4)2SO4、K2HPO4·3H2O、KH2PO4(分析纯):博欧特(天津)化工贸易有限公司;酵母粉、蛋白胨、琼脂、甘油(分析纯):北京奥博星生物科技有限公司;谷氨酸钠(纯度≥99%):天津市红玫瑰食品有限公司;NAG标品(纯度≥99%):美国Sigma公司。
1.1.3 培养基
细菌基础培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10g/L,琼脂 1.5%;pH7.0~7.2;灭菌121℃,15min。
种子培养基:葡萄糖40 g/L,蛋白胨20 g/L,酵母粉20 g/L,氯化钠 5 g/L;pH 7.0~7.2;灭菌 115 ℃,20 min。
发酵培养基:葡萄糖50 g/L,蛋白胨10 g/L,酵母粉10 g/L,氯化钠 5 g/L,(NH4)2SO45 g/L,谷氨酸钠 20 g/L,K2HPO4·3H2O 10 g/L,KH2PO45 g/L;pH7.5;灭菌 115 ℃,20 min。
葡萄糖筛选培养基:葡萄糖300g/L,蛋白胨0.5g/L,酵母粉 0.5 g/L,氯化钠 5 g/L,琼脂 1.5%;pH 7.0~7.2;灭菌115℃,20 min。
1.2 仪器与设备
Mandela型多功能等离子体诱变系统(MPMS):北京艾德豪克仪器生物有限公司;Agilent 1200高效液相色谱仪:美国安捷伦科技有限公司;TU-1810紫外可见光分光光度计:北京普析通用仪器有限责任公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;三层立式多功能摇床:上海旻泉仪器有限公司等。
1.3 方法
1.3.1 培养方法
种子培养:从斜面/平板挑取一环单菌落菌体接种到含有50 mL种子培养基的250 mL三角瓶中,于摇床中250 r/min,34℃培养16 h。
发酵培养:将活化好的种子液,以4%(体积分数)的接种量接种到含有50 mL发酵培养基的250 mL三角瓶中,于摇床中200 r/min,37℃发酵48 h。
诱变前菌体培养:取活化好的种子液,以4%(体积分数)的接种量接种到含有50 mL种子培养基的250 mL三角瓶中,于摇床中250 r/min,34℃培养10 h,使菌体处于对数生长的中期,镜检无芽孢。
1.3.2 菌株的诱变
菌悬液的制备:取1 mL诱变前菌体培养液12 000 r/min离心2 min,收集菌体,然后用无菌生理盐水洗涤3次,最后将菌体重悬于无菌生理盐水中,稀释100倍,使细胞的终浓度为1×107个/mL。
等离子体诱变:取上述菌悬液10 μL均匀的涂布于诱变杯中,晾干后将其置于多功能等离子体诱变系统(multifunction plasma mutagenesis system,MPMS)中进行等离子体诱变,以99%的氮气作为工作气体,输入功率120 W,间距10 mm,气流量10 L/min,分别诱变时长 5、7、10、15、20、30、50 s来考察致死率及正突变率。
紫外诱变:取上述菌悬液10 μL均匀的涂布于诱变杯中,晾干后将其置于多功能等离子体诱变系统(MPMS)中进行紫外诱变,紫外线灯管功率为20 W(提前预热 20 min),处理距离 25 mm,处理时间 5、7、10、15、20、30、50 s来考察致死率及正突变率。
等离子体-紫外复合诱变:取上述菌悬液10 μL均匀的涂布于诱变杯中,晾干后将其置于多功能等离子体诱变系统(MPMS),先等离子体诱变处理一定时间,紧接着进行紫外诱变。考察致死率及正突变率。
1.3.3 筛选方法
诱变初筛:在诱变处理后的诱变杯中加入1 mL生理盐水将菌种洗下制成菌悬液。稀释10倍后,取100 μL均匀涂到高糖筛选培养基表面,37℃静置培养24 h,挑选菌落直径≥3 mm的菌株。
诱变复筛:将保藏的初筛菌种接于液体种子培养基中,于摇床中250 r/min,34℃培养16 h,活化2次后以4%(体积比)的接种量接于发酵培养基中,于摇床中200 r/min,37℃培养48 h,采用高效液相色谱法分析乙酰氨糖产量,将高产菌株保存于20%(体积比)甘油管中-20℃保藏。
1.3.4 分析方法
致死率的计算:对诱变处理过的样品在适当的稀释度下涂板LB平板,通过菌落形成单位(colonyforming units,CFU)来计算其致死率,并获得致死率曲线。
致死率/%=(对照板菌落数-诱变板菌落数)/对照板菌落数×100
正突变率的计算:挑取葡萄糖筛选平板上菌落直径≥3 mm的菌株,进行摇瓶复筛,以NAG产量较出发菌(BI2)提高20%的菌株统计为正突变株。
正突变率/%=正突变菌落数/葡萄糖筛选平板总菌数×100
NAG检测方法:发酵液经离心、稀释后由Agilent 1200高效液相色谱法(high performance liquid chromatography,HPLC)检测[12],色谱柱 HPX-87H(Bio-Rad),流动相5 mmol/L H2SO4,检测器示差折光检测器,柱温 60 ℃,流速 0.6 mL/min,进样量 10 μL。
2 结果与分析
2.1 初筛方法的建立
本试验所用菌株BI2在葡萄糖耐受试验中表现出高耐受性,在300 g/L葡萄糖浓度的平板培养下,依旧保持了30%的存活率,比较适合高糖高渗的工业化生产。且在高糖平板上其菌落直径发生了较大改变,对菌落直径大小进行统计,如表1所示。

表1 葡萄糖筛选平板菌落大小分布Table 1 The distribution of colony size on glucose screening plate
由表1可知,菌落直径大小呈正态分布,菌落直径≥3 mm的占10%,菌落直径≤1.5 mm的菌落占20%,1.5 mm~3 mm的菌落占70%。对不同直径菌落各取30个进行摇瓶发酵验证NAG产量,并与出发菌株对照,如表2所示。

表2 葡萄糖筛选平板菌落大小与NAG产量Table 2 NAG yeild with different colony sizes of strains on glucose screening plate
由表2可知,发现在高糖平板上菌落直径大小与NAG产量呈正相关性,既菌落直径越大其NAG产量越高,其在300 g/L葡萄糖高渗平板上长势越好,因为NAG与芽孢菌细胞壁合成有关,NAG产量越高,芽孢菌细胞壁越完整[13]。因此,本试验选择了葡萄糖筛选培养基并挑选菌落直径≥3 mm的菌株,来作为初筛条件快速筛选NAG产量提高菌株。
2.2 等离子体诱变对菌株致死率及正突变率的影响
MPMS产生的等离子体中含有氮正离子(N+)、原子态氧(O)、OH-自由基等活性成分,可使微生物的细胞壁、细胞膜的结构及通透性改变,并对DNA和蛋白质等生物大分子造成损伤,导致大量细胞死亡。少量存活细胞通过修复机制,产生大量随机突变[14]。因此,选择合适的MPMS诱变时间能够实现微生物的快速诱变育种。
本试验先对出发菌株BI2进行等离子体单独诱变。测定其致死率曲线见图1。

图1 等离子体诱变对菌株致死率和正突变率的影响Fig.1 The effect of MPMS treatment on lethality rate and positive mutagenesis rate
由图1可知,多功能等离子体诱变系统对BI2的致死力较强,MPMS处理20 s时致死率达到91%,处理50 s时致死率达到98%。有研究表明,当微生物菌种的致死率为80%~95%时[15],正突变率最高,但突变本身具有随机性,其致死率与正突变率之间的关系并不是十分清楚,主要取决于诱变方法和菌株本身的特性。因此选取致死率在79%~96%之间的5个点测定其正突变率,如图1显示,结果表明等离子体处理15 s时正突变率最高,为15%,此时致死率为88%。
2.3 紫外诱变对菌株致死率及正突变率的影响
出发菌株经紫外诱变处理不同时间的致死率和正突变率如图2所示。
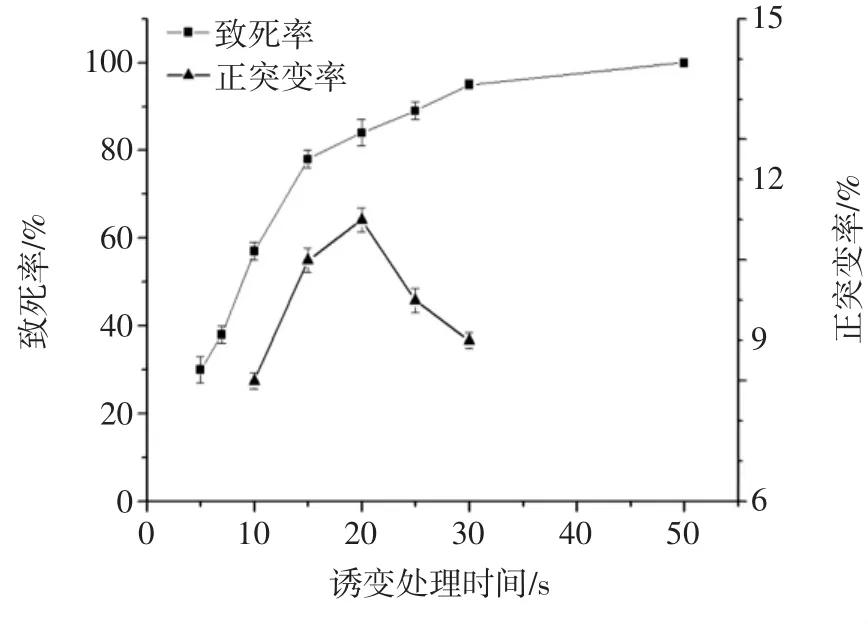
图2 紫外诱变对菌株的致死率和正突变率影响Fig.2 The effect of Ultraviolet treatment on lethality rate and positive mutagenesis rate
由图2可以看出,出发菌株对紫外处理也比较敏感,随着处理时间的延长,致死率逐渐增加。当处理10 s时,致死率为57%,当处理30 s时,致死率为95%,处理50 s时致死率为100%。有文献表明,紫外处理致死率在70%~80%之间时正突变率较高[16]。因此选取致死率在60%~95%之间的5个点进行正突变率测定。结果显示,当紫外线处理20 s时,正突变率最高为10%,此时致死率为84%。
2.4 等离子体-紫外复合诱变对菌株致死率和正突变率的影响
复合诱变包括两种或多种诱变剂的先后使用、同时使用、同一诱变剂的重复使用。普遍认为复合诱变具有协同效应。单一诱变因子长期使用容易使菌株产生耐受性,两种或两种以上诱变剂合理搭配进行复合诱变较单一诱变效果更好[17]。本试验采用先等离子体后紫外处理的复合诱变顺序,主要考虑两种方法的处理时间对菌株诱变效果的影响。依次选取两种方法正突变率最高的3个水平设计了全面实验,探究复合诱变对菌株的致死率及正突变率影响。结果如表3所示。
由表3分析可知,在复合诱变中,随着复合诱变时间的增加,致死率也随之增加,但正突变率却不一定随之增加,说明两种诱变因子存在协同和交互作用。而当致死率过高时,正突变率显著下降。其中等离子体处理15 s,然后紫外处理15 s时正突变率最高为28%,此时致死率为92%。可以看到复合诱变较单因子诱变的正突变率提高明显,较等离子体单独处理提高1.86倍,较紫外单独处理提高2.8倍。

表3 等离子体-紫外复合诱变对菌株的致死率和正突变率影响Table 3 The effect of MPMS-Ultraviolet treatment on lethality rate and positive mutagenesis rate
2.5 等离子体-紫外复合诱变的筛选结果
取等离子体处理15 s和紫外处理15 s的复合诱变后的菌悬液,按照1.3.3的方法进行高浓度葡萄糖平板初筛,统计菌落直径≥3 mm的占全部菌落的比例达到35%比出发10%有较大提高。由于在葡萄糖筛选平板上菌落大小与产NAG能力有正相关性,说明经复合诱变作用后,突变株的正突变率明显提高,挑取40株按照1.3.3的方法进行复筛,NAG产量见图3所示。
由图3可知,直径≥3 mm的菌株中,80%的菌株发生了正突变,证明了初筛方法的有效性。从中筛选出一株NAG产量最高菌BH-7,NAG产量达到1.02 g/L,较出发菌提高3.4倍。经过两次复合诱变及筛选,分别筛选出 BH-14、BH-2-1、BH-3-2,NAG 产量依次为1.11、1.4、1.23 g/L,较出发菌分别提高 3.7、4.7、4.1 倍。
2.6 突变菌的遗传稳定性研究
为考察突变株的遗传稳定性,将经过筛选到的四株产量提高菌(BH-7、BH-14、BH-2-1、BH-3-2)在 LB平板培养基中传代培养10代,并将各代菌体分别经种子活化后接种于发酵培养基中,37℃培养48 h,通过高效液相色谱法测定NAG产量,如图4所示。
由图4可知,菌株BH-7、BH-14、BH-2-1在传代后NAG产量下降明显,遗传不稳定。菌株BH-3-2在第3、4代产量略有下降,很快产量回复且遗传比较稳定。

图3 复合诱变突变株NAG产量Fig.3 NAG production of the mutants on MPMS-Ultraviolet treatment

图4 突变株的遗传稳定性实验Fig.4 Genetic stability experiment of the mutant strains
3 结论
本文研究了等离子体、紫外以及等离子体-紫外复合诱变对芽孢菌致死率及正突变率的影响,对结果进行分析表明,等离子体诱变15 s时正突变率最高为15%,紫外诱变20 s时正突变率最高为10%,而在等离子体15 s和紫外15 s的复合诱变条件下,正突变率达到最高为28%,较单因子诱变效果提高明显,可以作为诱变育种的首选方法。在该复合诱变条件下,通过初筛复筛,筛选出一株产量提高菌株BH-3-2。与出发菌株BI2相比,NAG产量从0.3 g/L提高到1.23 g/L,提高了4.1倍,传代10次发现遗传稳定性良好。
参考文献:
[1]Towheed T E,Maxwell L,Anastassiades T P,et al.Glucosamine therapy for treating osteoarthritis[J].Cochrane Database of Systematic Reviews,2005,2(2):29-46
[2]Friedman S J,Skehan P.Membrane-active drugs potentiate the killing of tumor cells by D-glucosamine[J].Proceedings of the National Academy of Sciences of the United States of America,1980,77(2):1172-1176
[3]Chen J K,Shen C R,Liu C L.N-Acetylglucosamine:Production and Applications[J].Marine Drugs,2010,8(9):2493
[4]Bohlmann J A,Schisler D O,Hwang K O,et al.N-acetyl-D-glucosamine and process for producing N-acetyl-D-glucosamine:WO,US6693188[P].2004
[5]赵黎明,夏文水.N-乙酰-D-葡糖胺的特性及其在食品中的应用[J].食品科技,2001(6):31-34
[6]Hsieh J W,Wu H S,Wei Y H,et al.Determination and Kinetics of Producing Glucosamine Using Fungi[J].Biotechnology Progress,2007,23(5):1009-1016
[7]Deng M D,Severson D K,Grund A D,et al.Metabolic engineering of Escherichia coli for industrial production of glucosamine and N-acetylglucosamine.[J].Metabolic Engineering,2005,7(3):201-214
[8]Liu Y,Zhu Y,Ma W,et al.Spatial modulation of key pathway enzymes by DNA-guided scaffold system and respiration chain engineering for improved N-acetylglucosamine production by Bacillus subtilis[J].Metabolic Engineering,2014,24(1):61-69
[9]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2676-2684
[10]朱传合,贺亚男,路福平,等.N~+离子注入阿维拉霉素产生菌诱变效应的研究[J].核技术,2006,29(8):609-613
[11]石秀峰,纪曾春,常传友,等.利用多功能等离子体诱变系统快速诱变选育γ-氨基丁酸高产菌株[J].中国酿造,2016,35(4):127-130
[12]池亚斌,顾洋,刘龙,等.常压室温等离子体诱变高通量筛选N-乙酰氨基葡萄糖高产突变株[J].工业微生物,2016,46(3):13-19
[13]周德庆.微生物学教程[M].天津:高等教育出版社,2011
[14]Morfill G E,Kong M G,Zimmermann J L.Focus on Plasma Medicine[J].New Journal of Physics,2009,11(11):115-117
[15]Yu Z L,Qiu L J,Huo Y P.Progress in studies of biological effect and crop breeding induced by ion implantation[J].Journal of Anhui A-gricultural University,1991,24(4):55-57
[16]何国庆,贾英民,丁立孝.食品微生物学[M].北京:中国农业大学出版社,2010
[17]蒋汶,张庆庆,汤文晶,等.紫外-等离子体复合诱变红曲霉产胞外多糖[J].食品与发酵工业,2016,42(1):64-69
