钦州湾7种经济贝类中麻痹性贝类毒素分析与安全评价
2018-06-19戴梓茹郭伟张晨晓王培黄镁李晨曦
戴梓茹,郭伟,张晨晓,王培,黄镁,李晨曦
(1.广西北部湾海洋生物多样性养护重点实验室,广西钦州535011;2.钦州学院食品工程学院,广西钦州535011;3.钦州市食品药品检验所,广西钦州535011)
近年来,沿海城市工业废水和生活污水大量排放到海水中,以及近岸海域的海水养殖产业本身的污染问题,导致海水污染和海水富营养化日趋严重。近年来由于有害赤潮迅速增殖泛滥,赤潮灾害屡屡发生,自90年代以后,每年达到40次~50次[1]。2013年,全国发生赤潮46次,其中南海发生6次[2]。我国近岸海域普遍发生的赤潮严重破坏了海洋生态环境,给海洋渔业资源和水产养殖行业造成了极大的经济损失。其中部分有害赤潮能够产生藻毒素,双壳贝类是我国近海重要的养殖动物,海洋微藻是贝类的主要食物来源,能够产生藻毒素的有毒藻种亦可为贝类滤食,导致贝类染毒,甚至危及消费者健康和生命安全[3]。
最初根据藻毒素传递的中间媒介生物和致毒症状,可将主要藻毒素分为神经性贝类毒素(neurotoxic shellfish toxins,NSTs)、麻痹性贝类毒素(paralytic shellfish toxins,PSTs)、记忆缺失性贝类毒素(amnesic shellfish toxins,ASTs)、腹泻性贝类毒素(diarrhetic shellfish toxins,DSTs) 和西加鱼毒素 (ciguatera fish toxins,CFTs)等[4]。当人们误食染毒的贝类后就会造成中毒,甚至死亡,且无特效解救药物。1976年,日本报道了首例腹泻型贝毒中毒事件,1981年西班牙有5 000人中麻痹性贝毒,1993年菲律宾有300人中麻痹性贝毒[5]。近年来,我国沿海部分海区的贝类普遍受到贝类毒素的污染。2011年,在福建宁德和浙江宁波两地发生了因食用被腹泻性贝毒沾染的紫贻贝引起的中毒事件,中毒人数多达200人[6]。2017年6月,由于受到赤潮影响,福建漳州36人因食用受麻痹性贝毒污染的贝类出现不同程度的中毒症状。广西北海也发生过因食用染毒贝类而引起的多人中毒或死亡事件[7]。
麻痹性贝类毒素(Paralytic Shellfish toxins,PSTs)是一类以石房蛤毒素(saxitoxin,STX)为骨架的四氢嘌呤类衍生物,主要来源于海洋的甲藻类、细菌等,具有分布最广、危害最大的特点[8-11]。目前已知结构的麻痹性贝类毒素约有57种[12],包括氨基甲酸酯类毒素(carbamate toxins);脱氨甲酰基类毒素(decarbamoly toxins);N-磺酰氨甲酰基类毒素(N-sulfo-carbamoyl toxins);脱氧脱氨甲酰基类毒素(deoxydecarbamoyl toxins);N-羟基衍生物等。其致毒机理与河豚毒素(tetro dotoxin,TTX)相似,是一种神经肌肉麻痹剂,麻痹性贝类毒素致毒作用机制是作用于肌肉、神经细胞钠离子通道,阻断电压门控钠离子内流,无法形成正常动作电位造成神经系统传输障碍,从而对神经系统产生麻痹作用。人们误食了含有此类毒素的贝类而产生的嘴唇麻木感、头疼、恶心、呕吐,随之出现四肢麻木、呼吸困难等症状,有时出现短暂失明,过量摄入者则会身体瘫痪,因窒息而亡[13]。欧盟规定它的食品安全标准为每 100 g贝类鲜肉 80 μg石房蛤毒素(或等价)(80 μg/100 g STXeq)[14-15]。
目前,我国对贝类麻痹性贝类毒素的研究报道多集中在北黄海、渤海和东海海域,对广西海域,特别是钦州湾海域贝类中麻痹性贝类毒素的研究报道较少。本文通过小鼠生物法和液相色谱-荧光检测法,分析了从广西钦州湾近岸海域采集的具有代表性的经济贝类中麻痹性贝类毒素组成成分和含量,同时根据我国渔政渔港监督管理局制订的贝类安全食用标准评价其食用安全性,以期为钦州湾海域贝类食品的安全性评价提供基础数据,也为该海域贝类中毒素问题监管提供依据。
1 材料与方法
1.1 贝类采集
2015年9月于钦州湾采集7种经济贝类(表1)。样本采集后迅速送到北部湾海洋生物多样性养护重点实验室分析实验室,洗净贝壳,切断闭壳肌开壳,淋洗贝类内部去除泥沙等杂质,取出贝肉后沥干水分,保存在-20℃低温冰箱中,备用。

表1 采于广西钦州湾的7种贝类Table 1 Basic information of shellfish samples
1.2 分析方法
1.2.1 小鼠生物法
按照GB 5009.213-2016《食品安全国家标准贝类中麻痹性贝类毒素的测定》[16]检测样品中麻痹性贝类毒素的含量。
原理:根据小鼠注射贝类提取液后的死亡时间,查出鼠单位,并按小鼠体重,校正鼠单位,计算确定每100 g贝肉内麻痹性贝类毒素(paralytic shellfish poison,PSP)微克数。其中,鼠单位:对体重为20 g的ICR雄性小鼠腹腔注射1 mL麻痹性贝类毒素提取液,使其在15 min内死亡所需的最小毒素量。
1.2.2 液相色谱-荧光检测法
按照GB 5009.213-2016的方法检测7种经济贝类样品中的麻痹性贝类毒素含量(液相色谱-荧光检测法)。贝类组织中毒素提取方法和检测方法参照[17-18]。
毒素提取流程:将冷冻的贝类组织在室温下进行解冻后,进行组织的粗匀浆、细匀浆。取约5 g细匀浆均匀贝组织,置于50 mL聚丙烯离心管中,加入5 mL 0.1 mol/L HCl溶液,使用旋转震荡器进行震荡混合,使贝组织和稀盐酸溶液充分混匀,后用pH试纸(0~14)检测混合液的pH值,使其保持在2.0~4.0之间,若不在此范围内,用5 mol/L HCl或0.1 mol/L NaOH调节。将调好pH值的样品置于水浴锅中煮沸约5分钟后,取出待降至室温后,再次使用5 mol/L HCl或0.1 mol/L NaOH调pH值在2.0~4.0之间。将离心管置于高速离心机中,8 000 r/min离心10 min后,取上清液1 000 μL加入到1.5 mL离心管中,加入50 μL 30%三氯乙酸,充分震荡混匀后,再加入70 μL 1.0 mol/L NaOH溶液,调整pH值到2.0~4.0之间,再次充分震荡混匀后,置于离心机中12 000 r/min离心10 min,取上清液经孔径0.22 μm水性针式滤膜过滤。
毒素检测方法:GTX-STX类毒素的分析采用反相色谱柱(Aglient,Zorbax Bonus RP,3.5 μm,150 mm×4.6 mm)进行毒素分离,使用两相洗脱液洗脱。流动相A为5.5 mmol/L磷酸缓冲液,含8.0 mmol/L庚基磺酸钠,pH 7.10;流动相B为16.5 mmol/L磷酸缓冲液,含8.0 mmol/L庚基磺酸钠和11.5%乙腈,pH 7.10;C类毒素采用反相色谱柱(Phenomenex,Synergi Hydro-RP,4 μm,150×4.6 mm)进行分离,使用两相洗脱液洗脱。洗脱液A为1%氨水溶液,含3 mmol/L磷酸四丁基氨,pH 5.8;洗脱液B为1%氨水溶液,含3 mmol/L磷酸四丁基氨和4%乙腈,pH 5.8。柱后衍生系统采用氧化剂(5 mmol/L 高碘酸,100 mmol/L H3PO4,pH 7.8)和酸化剂(0.75 mol/L HNO3溶液),柱后衍生反应温度设为85℃,氧化剂和酸化剂流速均为0.4 mL/min。毒素衍生产物检测的激发波长和发射波长分别为330 nm和390 nm。
2 结果与分析
2.1 小鼠生物法
对试验小鼠进行腹腔注射1 mL的麻痹性贝类毒素的提取液或空白对照液,结果表明实验组中所有小鼠在观察15 min内均不死亡,可以确定钦州湾7种经济贝类样品的鼠单位小于400 MU/100 g。检测结果见表2。
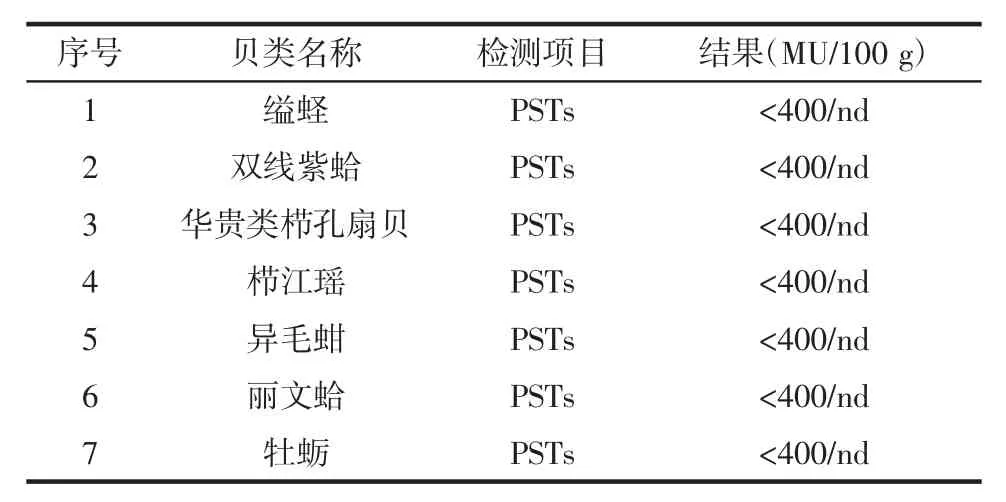
表2 采用小鼠生物法分析7种贝类中麻痹性贝类毒素Table 2 PSTs in 7 species of economic shellfish by biological method
采集于钦州湾的7种经济贝类中麻痹性贝类毒素含量均小于400 MU/100 g,根据我国渔政渔港监督管理局制定的贝类安全食用标准(80 μg/100 g STXeq或400 MU/100 g)和联合国卫生组织规定可食贝类的麻痹性贝类毒素限量80 μg/100 g STXeq[19]的相关规定表明,用小鼠生物法检测出的7种经济性贝类中麻痹性贝类毒素的含量没有超过安全食用的标准,可以放心食用。
2.2 高效液相色谱-荧光检测法
采用高效液相色谱-荧光法检测7种经济贝类的麻痹性贝类毒素含量见表3。
如表3所示,采用液相色谱-荧光检测法检测了7种贝类中 12种麻痹性贝类毒素(C1、C2、GTX1、GTX2、GTX3、GTX4、GTX5、dcGTX2、dcGTX3、dcSTX、NEO、STX)。其中 7 种贝类中检出了 GTX1、GTX4、NEO、STX这4种毒素,含量分别是0.02 nmol/g~0.27 nmol/g、0.02 nmol/g~0.27 nmol/g、0.12 nmol/g、0.05 nmol/g,其余6种毒素没有检出。GTX4的检出率最高,为86%,其次是GTX1,43%。NEO、STX的检出率均为14%(检出率计算方法为:每种毒素类型检出毒素的个数/7种经济贝类数量)。
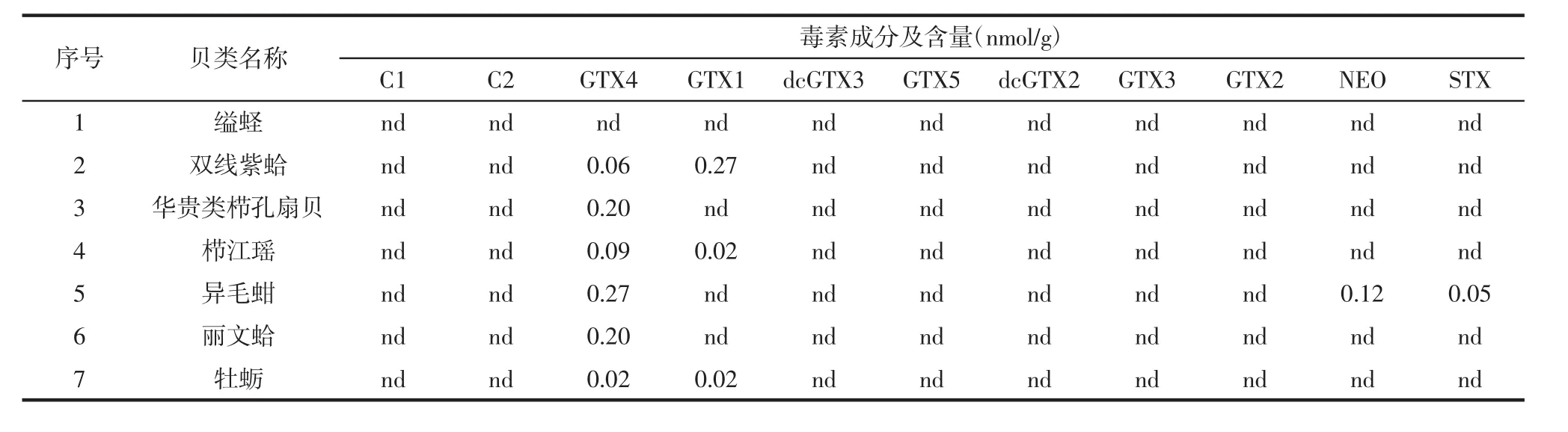
表3 采用高效液相色谱-荧光法检测7种经济贝类的麻痹性贝类毒素含量Table 3 Content of paralytic shellfish poison(PSP)in 7 species of economic shellfish by HPLC-FD
检出的4种贝类毒素单位由nmol/g转换为μg/100 g,如表4所示。
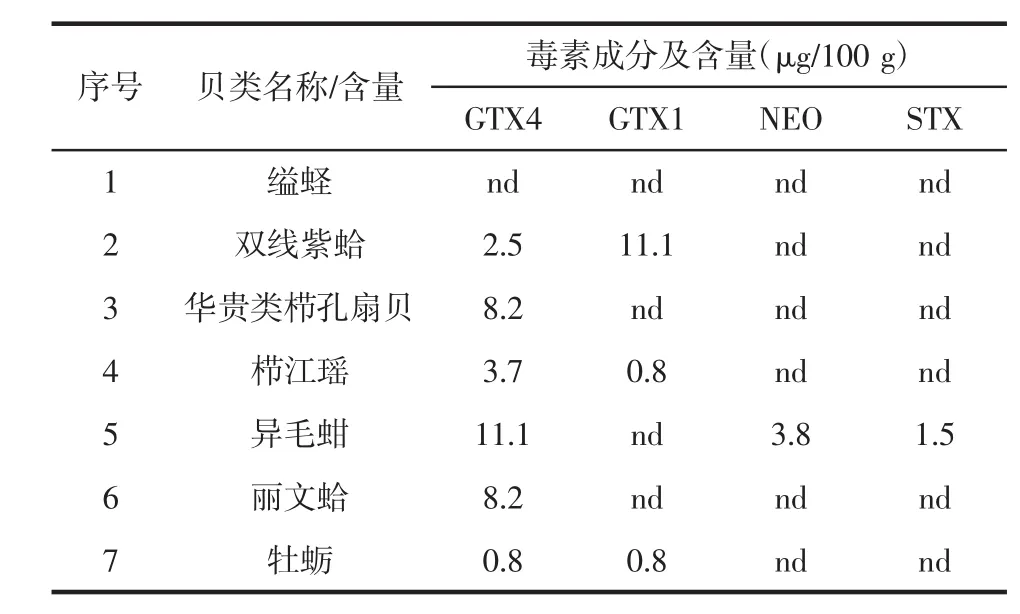
表4 7种经济贝类的麻痹性贝类毒素含量Table 4 Content of PSTs in 7 species of economic shellfish
经过单位转化后的毒素含量分别为0.8μg/100 g~11.1 μg/100 g、0.8μg/100 g~11.1 μg/100 g、3.8 μg/100 g、1.5 μg/100 g。就NEO和STX毒素而言,7种经济贝类中就只有异毛蚶检测出STX、NEO,这说明异毛蚶摄食的藻类和有机碎屑具有一定的污染。就GTX1毒素而言,双线紫蛤是7种贝类中检出毒素含量最高的,其次是栉江瑶和牡蛎,含量均为0.8 μg/100 g;就GTX4毒素而言,异毛蚶是检测7种贝类样品中毒素含量最高的,含量为 11.1 μg/100 g。
根据GB 5009.213-2016中4种毒素的毒性因子,计算出各贝类的总毒素,如表5。就总毒性而言,异毛蚶的总毒性是7种经济贝类中最高的,含量为13.1 μg/100 g,其次是双线紫蛤(12.8 μg/100 g),缢蛏总毒素为0,累积在体内的麻痹性贝类毒素的含量较低,食用安全性系数高。
根据联合国卫生组织规定,可食贝类的麻痹性贝类毒素限量 80 μg/100 g STXeq(80 μg/100 g),如表 5所示。

表5 7种经济贝类的麻痹性贝类毒素总毒性含量Table 5 Content of total toxicity PSTs in 7 species of economic shellfish
对比本次检测结果可以看出异毛蚶的总毒素含量均为13.1 μg/100 g,是所检样本中毒素含量最高的,但其含量仍远远小于可食用的贝类麻痹性贝类毒素安全限量80 μg/100 g,因此判定从钦州湾采集的这7种经济贝类所含有的PSTs含量在我国安全食用的限量范围内,这说明钦州湾近岸海域的贝类等生物在一定程度上受有毒藻种威胁,应加强重点经济型贝类中藻毒素的监测。
3 讨论
钦州湾位于广西壮族自治区北部湾最北部,分为内湾、湾颈和外湾3部分。环钦州湾沿海水体较浅,滩涂面积广阔,是重要的贝类养殖区,特别是以牡蛎等贝类养殖为龙头的海洋产业现已形成了连片养殖格局[20]。近年来,随着广西北部湾经济区的加速建设,沿岸生态环境受人类活动影响日益加剧,大量的营养物质被附近有多条江河携带直接汇入该海域,导致该海域富营养化问题不断加剧[21],存在有害赤潮发生的潜在可能,这给钦州湾海域贝类养殖业及海产品的食品安全造成了较大风险。麻痹性贝毒毒素来源于有毒甲藻已是共识[22],钦州湾海域存在塔玛亚历山大藻(Alexandrium tamarense)和链状裸甲藻(Gymnodinium catenatum)等产麻痹性贝毒毒素的有毒藻类[23],这给该海域的贝类带来了沾染麻痹性贝类毒素的风险。
采用生物法和化学分析法分别对钦州湾具有代表性贝类进行麻痹性贝类毒素的检测,结果表明化学分析法能够准确定性、定量的贝组织中毒素组成和含量,而小鼠生物法由于较高的检出限,不能准确反映贝类沾染藻毒素状况。应用高效液相色谱方法,对在钦州湾沿岸海域采集多种经济型贝类样品进行了分析,蚶类异毛蚶、蛤类双线紫蛤是该海域最容易累积麻痹性贝类毒素的贝类,毒素含量最高,而华贵类栉孔扇贝、栉江瑶、丽文蛤和牡蛎含量相对较低,缢蛏没有检测到毒素。研究发现蚶类比其它种类的贝类更容易累积型毒素,在以往调查中,毛蚶中也常常检出麻痹性贝毒毒素[17],毛蚶作为一种底栖型贝类,其体内的毒素是源于水体中的营养细胞还是沉积物中的甲藻孢囊,特别令人关注。前人研究结果表明,有毒甲藻孢囊广泛分布于南海海域[24],在广西沿岸海域(防城港和北海港)存在塔玛亚历山大藻、微小亚历山大藻和链状裸甲藻的孢囊[25],这有可能成为毛蚶等底栖贝类中麻痹性贝毒毒素的来源。研究发现,钦州湾采集的贝类中麻痹性贝类毒素成分以高毒性的氨基甲酸酯类毒素GTX4、GTX1、NEO和STX为主。而分布于中国近海海域的塔玛亚历山大藻复合种的毒素成分C1、C2、GTX2、GTX3、GTX5、NEO 和 STX,其中 C1、C2 是最主要的毒素类型[22,26],这说明麻痹性贝类毒素在贝类组织中可能发生了转化[17,26]。
通过采用小鼠生物法和液相色谱-荧光检测法检测分析钦州湾7种经济贝类中的麻痹性贝类毒素,研究结果表明:1)小鼠生物法不能很好的反映贝类沾染藻毒素的情况,高效液相色谱-荧光法能够很好定性、定量贝类中麻痹性贝类毒素的成分和含量;2)7种贝类中异毛蚶中有最大毒素含量/毒性值,分别为0.27 nmol/g或13μg/100g STXeq,说明蚶类较其他所调查的贝类更容易累积麻痹性贝类毒素;3)钦州湾贝类中麻痹性贝类毒素组成以高毒性的GTX1、GTX4、NEO和STX为主。尽管本研究所检测的7种贝类中毒素含量远低于我国渔政渔港监督管理局制定的贝类安全食用标准和联合国卫生组织规定的80 μg/100 g STXeq,但毒素检出率高达86%,因此需加强该海域贝类中藻毒素检测,这对保证海洋食品的安全具有重要的意义。
参考文献:
[1]马荣桧,高彦,万进,等.贝类毒素及检测技术的研究现状[J].食品研究与开发,2013,34(22):104-108
[2]国家海洋局.2013年中国海洋环境状况公报 (三)[Z/OL].http://www.mlr.gov.cn/zwgk/tjxx/201403/t20140326-1309165.htm,2014-03-26
[3]蒋幼民,张连生,赵文彬.麻痹性贝类毒素中毒的流行病学特征[J].现代预防医学,2004(5):711-712
[4]Hallegraeff G M,McCausland M A,Brown R K.Early warning of toxic dinoflagellate blooms of Gymnodinium catenatum in southern Tasmanian waters[J].Journal of Plankton Research,1995,1(6):1163-1176
[5]陈建华,于仁成,孔凡洲,等.北黄海海域虾夷扇贝体内脂溶性藻毒素分析[J].海洋与湖沼,2014,45(4):855-863
[6]钱蓓蕾,徐捷,王媛,等.上海市售贝类产品中麻痹性贝类毒素污染状况调查及其评价[J].食品安全质量检测学报,2012,3(2):89-92
[7]中华人民共和国农业部.2012年全国渔业经济统计公报[Z/OL].http://stock.stcn.com/common/finalpage/edNews/2013/20130516/422025786668.shtml,2013-05-16
[8]Kerr DS,Briggs DM,Saba HI.A neurophysiological method of rapid detection and analysis of marine algal toxins[J].Toxicon,1999,37:1803-1825
[9]Anderson DM,Kulis DM,Qi Yz,et al.Paralytic Shellfish Poisoning in southen China[J].Toxicon,1996,34(5):579-590
[10]江天久,陈菊芳,邹迎麟,等.中国东海和南海有害赤潮高发区麻痹性贝毒素研究[J].应用生态学报,2003,14(7):115-1160
[11]Zhou M,Li J,Luckas B,et al.A Recent Shellfish ToxinInvestigation In China[J].Marine pollution Bulletin,1999,39(1):331-334
[12]周名江,李钧,于仁诚.赤潮藻毒素研究进展[J].中国海洋药物,1999,71(3):48-54
[13]Benton BJ,Keller SA,Spriggs DL,et al.Recovey from the lethal effects of saxitoxin:atherapeutie window for 4-aminopyridine(4-AP)[J].Toxicon,1998,36(4):571-588
[14]Taleb H,Vale P,Jaime E,et al.Study of paralytic shellfish poisoning toxin profile in shellfish from the Mediterranean shore of Morocco[J].Toxicon,2001,39(12):1855-1861
[15]Vale P.Evaluation of marine biotoxin’s accumulation by Acanthocardia tuberculatum from Algarve,Portugal[J].Toxicon,2002,40(5):511-517
[16]中国标准化工作委员会.GB 5009.213-2016食品安全标准贝类中麻痹性贝类毒素的测定[S].北京:中国标准出版社,2016
[17]Etheridge SM,Lewis RJ.Paralytic shellfish poisoning:seafood safety and human health perspectives[J].Toxicon,2010,56(2):108-122
[18]Yang Liu,Ren-Cheng Yu,Fan-Zhou Kong,et al.,2017.Paralytic shellfish toxins in phytoplankton and shellfish samples collected from the Bohai Sea,China[J].Marine Pollution Bulletin,2017,115:324-331
[19]柳阳.我国近海藻毒素污染状况研究与毒素标准物质制备[D].青岛:中国科学院海洋研究所,2017
[20]王迪,陈丕茂,逯晶晶,等.钦州湾浮游植物周年生态特征[J].应用生态学报,2013,24(6):1686-1692
[21]韦蔓新,赖廷和,何本茂.钦州湾丰、枯水期营养状况变化趋势及其影响因素[J].热带海洋学报,2003(3):16-21
[22]Anderson D,Kulis D,Sullivan J.Dynamics and physiology of saxitoxin production by the dinoflagellates Alexandrium spp[J].Marine Biology,1990,104:511-524
[23]姜发军,陈波,何碧娟,等.广西钦州湾浮游植物群落结构特征[J].广西科学,2012,19(3):268-275
[24]王朝晖,MATSUOKA Kazumi,齐雨藻.有毒亚历山大藻(Alexandrium spp.)和链状裸甲藻(Gymnodinium catenatum)孢囊在中国沿海的分布[J].海洋与湖沼,2003,34(4):422-430
[25]陆欣鑫.华南沿海典型海域甲藻孢囊地理分布及环境指示作用研究[D].广州:暨南大学,2017
[26]陈建华.我国典型贝类增养殖海域藻毒素组成、分布状况及贝类染毒特征分析[D].青岛:中国科学院研究生院,2013
