金针菇多糖制备过程中体外抗氧化活性研究
2018-06-19张剑弓志青贾凤娟崔文甲王月明王文亮
张剑,弓志青,贾凤娟,崔文甲,王月明,王文亮
(山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业部新食品资源加工重点实验室,山东济南250100)
金针菇(Flammulina velutipes)别名冬菇、朴菇、构菌、青杠菌、毛柄金钱菌等,在真菌学领域中属于担子菌亚门,层菌纲,伞菌目,口蘑科,金钱菌属[1]。金针菇因其形美,味鲜,且富含多糖、蛋白质、钙、铁、磷、多种维生素等物质,已成为世界上知名的欣赏菌和食药两用菌[2]。
金针菇多糖作为金针菇的主要活性物质之一,具有抗氧化[3]、抗衰老[4]、抗病毒[5]、抗肿瘤[6]、提高机体免疫力[7]等多种生理性功效。目前有关金针菇粗多糖或单一多糖组分的生物活性的研究较多[8-10],而提取分离纯化过程中进行多糖活性追踪的研究较少,邹宇晓等研究了纯化过程中金针菇多糖体外抗肿瘤活性的变化,结果表明,抗肿瘤活性最高的是未经纯化处理的金针菇粗多糖,说明分离纯化工艺对多糖抗肿瘤活性有影响[11]。对不同纯度的多糖样品进行活性研究,这直接影响到多糖功能食品开发的关键工艺,对相关产品的质量控制极为重要。而金针菇多糖制备过程中其抗氧化活性的变化研究还少有报道。
本文以金针菇水提液、醇沉多糖以及脱蛋白多糖为研究对象,以总抗氧化能力、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力及抑制羟基自由基能力为检测指标,研究3种纯度的粗多糖体外抗氧化活性,旨在探讨金针菇多糖在制备过程中体外抗氧化活性的变化。
1 材料与方法
1.1 仪器与试剂
电热恒温水浴锅(DK-8D):上海精宏实验设备有限公司;电子天平(AR423CN):奥豪斯(上海)仪器有限公司;高速离心机(LXJ-IIB):上海安亭科学仪器厂;紫外可见分光光度计(UV6000):上海元析仪器有限公司;小型粉碎机(ZN-20L):北京兴时利和科技发展有限公司。
金针菇:济南大润发超市,产地济南;DPPH:北京中生瑞泰科技有限公司;考马斯亮蓝:Biosharp公司;牛血清蛋白:Biofroxx;总抗氧化能力测定试剂盒(货号:A015)、抑制羟自由基能力测定试剂盒(货号:A018):南京建成生物工程研究所;其它均为国产分析纯。
1.2 样品制备
将金针菇进行整理去杂后60℃干燥至恒重,粉碎,过80目筛。运用热水浸提的工艺料液比1∶30(g/mL)、温度90℃、时间4 h、提取2次,获取金针菇多糖水提液,冷冻干燥得金针菇多糖水提物,命名为FVP1;通过乙醇沉淀和冷冻干燥得金针菇粗多糖,命名为FVP2;经Sevage法去蛋白和冷冻干燥得到金针菇脱蛋白多糖,命名为FVP3。将FVP1、FVP2、FVP3置于干燥器中备用。
1.3 多糖含量测定
采用苯酚硫酸法联合3,5-二硝基水杨酸法(DNS)测定金针菇多糖纯化过程中的含量,其中苯酚硫酸法测定总糖含量,DNS法检测还原糖的含量,二者之差即为多糖含量,即多糖含量=总糖含量-还原糖含量[12]。两种方法均以葡萄糖为标准物质制作标准曲线,以葡萄糖浓度(mg/mL)为横坐标,吸光值A为纵坐标,所得的回归方程分别为y=15.614x+0.003 29,R2=0.999 76;y=1.671 6x-0.049,R2=0.999 9。将待测样品FVP1、FVP2、FVP3配置成合适的浓度按标准曲线的操作进行检测,根据吸光值计算待测样品中多糖含量。
1.4 抗氧化试验
1.4.1 总抗氧化能力检测
将 FVP1、FVP2、FVP3配置成2.0 mg/mL的试样,运用南京建成生物工程研究所试剂盒(货号:A015)测定,详细步骤按试剂盒说明书进行操作。其原理是:具有抗氧化性的物质可以将Fe3+还原成Fe2+,生成的Fe2+可与菲啉类物质生成稳定的络合物,通过比色测定便可得知其抗氧化能力高低。定义:在37℃下,每毫升样品每分钟使反应体系的吸光值每增加0.01时,即为一个总抗氧化能力单位(U)。计算公式:

式中:反应液总量为3.7 mL;取样量为0.1 mL。
1.4.2 DPPH自由基清除能力
采用弓志青等的方法[13],其原理:DPPH自由基上有单电子,溶于醇溶液中呈现紫色,在515 nm~520 nm范围内有强吸收。自由基清除剂可以与DPPH自由基的单电子配对,导致其吸收逐渐消失,颜色也由深紫色变成黄色。褪色程度与所接受的电子数量成定量关系,因此可用分光光度计来进行定量分析[14],具体操作:将 FVP1、FVP2、FVP3 分别配置成 0.5、1.0、1.5、2.0 mg/mL的试样,加样顺序见表1,室温避光反应30 min,于517 nm下测定吸光值,并按以下公式计算清除率I。


表1 清除DPPH自由基试验样品添加量Table 1 Sample addition for DPPH scavenging test
1.4.3 抑制羟基自由基能力
将 FVP1、FVP2、FVP3 分别配置成 0.5、1.0、1.5、2.0 mg/mL的试样,运用南京建成生物工程研究所试剂盒(货号:A018)测定,详细步骤按试剂盒说明书进行操作。其原理:依据Fenton反应,H2O2的量与Fenton反应产生的·OH量成正比,当给予电子受体后,加入griess试剂进行显色,便形成红色物质,颜色深浅与·OH的多少成正比关系。定义在37℃下1 min反应,使反应体系中H2O2浓度降低1 mmol/L所需的样品量为1个抑制羟自由基能力单位(U)。
计算公式:

式中:标准品浓度为8.824mmol/L;取样量为0.2mL。
2 结果与分析
2.1 多糖含量测定
FVP1、FVP2、FVP3中的多糖含量及得率见表2。
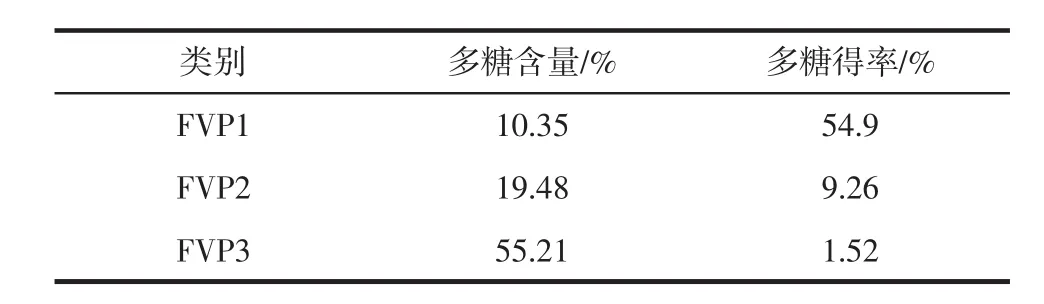
表2 多糖含量及得率Table 2 Content and yield of polysaccharide
随着纯化的进行,多糖含量逐渐提高,即FVP3>FVP2>FVP1,其中FVP3的多糖含量达55.21%;而多糖的得率却逐渐降低,即FVP1>FVP2>FVP3,其中FVP3的多糖得率仅有1.52%。
2.2 抗氧化试验
2.2.1 总抗氧化能力
不同纯度的金针菇粗多糖总抗氧化能力由总抗氧化能力检测试剂盒测定见表3和图1。
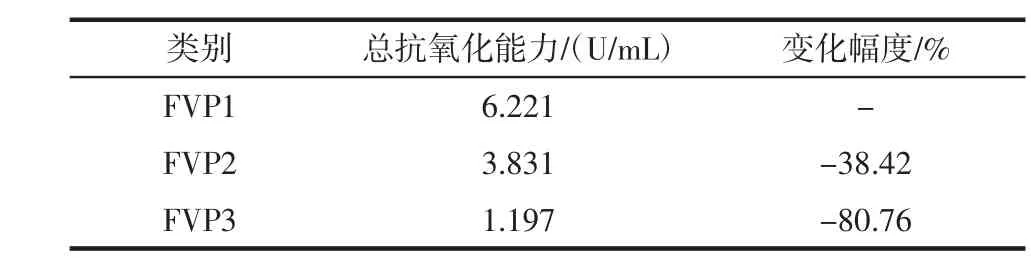
表3 纯化工艺对金针菇多糖总抗氧化能力的影响Table 3 Effect of purification process on total antioxidant capacity of Flammulina velutipes polysaccharide

图1 FVP1、FVP2、FVP3的总抗氧化能力Fig.1 Total antioxidant capacity of FVP1,FVP2,FVP3
由表3和图1可知,2.0 mg/mL的 FVP1、FVP2、FVP3的总抗氧化能力逐渐下降,总抗氧化能力依次为6.221、3.831、1.197 U/mL,这说明纯化工艺有降低金针菇粗多糖的总抗氧化能力的趋势。
2.2.2 DPPH自由基清除能力
不同纯度的金针菇粗多糖的DPPH自由基清除能力见表4和图2。

表4 纯化工艺对金针菇多糖DPPH自由基清除能力的影响Table 4 Effect of purification process on DPPH radical scavenging activity of Flammulina velutipes polysaccharide

续表4 纯化工艺对金针菇多糖DPPH自由基清除能力的影响Continue table 4 Effect of purification process on DPPH radical scavenging activity of Flammulina velutipes polysaccharide
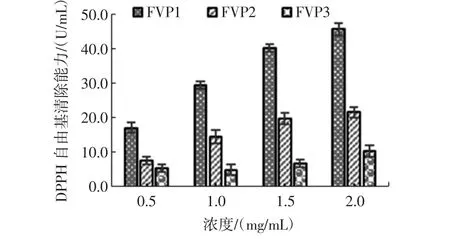
图2 FVP1、FVP2、FVP3的DPPH自由基清除能力Fig.2 DPPH radical scavenging activity of FVP1,FVP2,FVP3
在0.5 mg/mL~2.0 mg/mL的浓度范围内,不同纯度的FVP1、FVP2、FVP3的DPPH自由基清除能力均具有浓度依赖性,随着浓度的增高,其能力也逐渐提高,其中FVP1在2.0 mg/mL的浓度下的清除能力最强,为45.69%;在相同的浓度下,DPPH自由基清除能力的大小依次为FVP1>FVP2>FVP3,而且随着浓度的增加,DPPH自由基清除能力的降幅逐渐增大,这说明,纯化工艺有减弱金针菇粗多糖DPPH自由基清除能力的趋势。
2.2.3 抑制羟基自由基能力
不同纯度的金针菇粗多糖抑制羟基自由基能力见表5和图3。
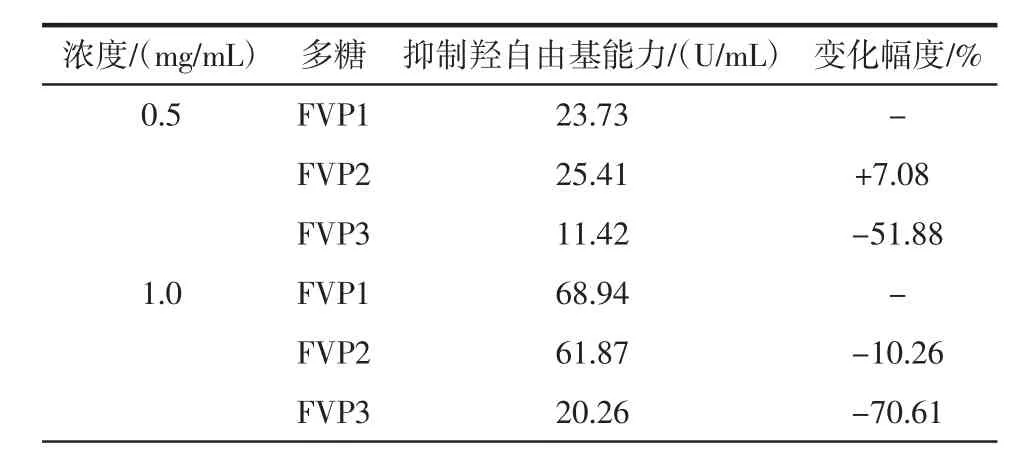
表5 纯化工艺对金针菇多糖抑制羟自由基能力的影响Table 5 Effect of purification process on hydroxyl radical restraining capacity of Flammulina velutipes polysaccharide
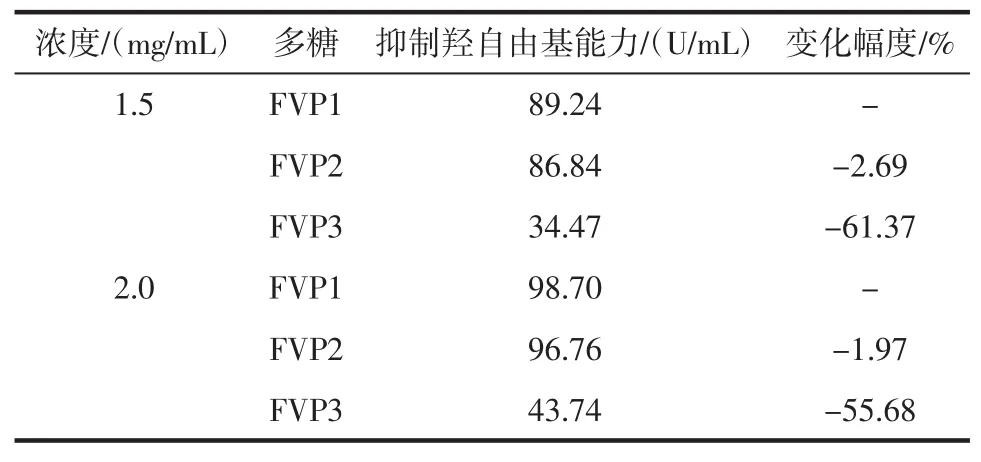
续表5 纯化工艺对金针菇多糖抑制羟自由基能力的影响Continue table 5 Effect of purification process on hydroxyl radical restraining capacity of Flammulina velutipes polysaccharide
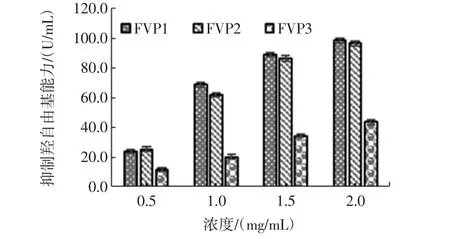
图3 FVP1、FVP2、FVP3的抑制羟基自由基能力Fig.3 Hydroxyl radical restraining capacity of FVP1,FVP2,FVP3
在0.5 mg/mL~2.0 mg/mL的浓度范围内,不同纯度的FVP1、FVP2、FVP3的抑制羟基自由基能力均具有浓度依赖性,随着浓度的增高,其能力也逐渐提高。其中FVP1在2.0 mg/mL的浓度下的清除能力最强,为98.70%;在相同的浓度下,FVP1与FVP2的抑制羟基自由基的能力相当,变化不是很大,而FVP3的抑制羟基自由基的能力却大幅度下降。这说明,纯化过程中的脱蛋白有减弱金针菇粗多糖抑制羟基自由基能力的趋势。
3 讨论
据报道,金针菇多糖具有抗氧化活性,其主要是通过提高超氧化物歧化酶的活性,进而有效清除自由基,起到抗氧化的作用[8]。叶敏等[15]检测了金针菇多糖清除羟自由基能力,结果显示多糖对羟自由基有一定的清除能力,并且具有浓度依赖性;李守勉等[16]采用结晶紫法测定了金针菇多糖清除自由基的能力,结果表明金针菇多糖对羟基自由基有良好的清除效果。本试验中不同浓度的金针菇多糖均表现出一定的抗氧化能力,尤其是抑制羟基自由基的能力较强。
多糖的活性与很多因素有关,比如相对分子质量、溶解度、结构等的改变均会影响多糖的活性。通常一定相对分子质量的具备三股螺旋结构的β-1,3葡聚糖活性较高[17]。目前金针菇多糖的制备主要通过提取、分离、纯化等,步骤繁多,中间还涉及有机溶剂的加入等,金针菇多糖的结构难免不会破坏[8],而多糖的生物活性很大程度上是由其结构决定的,这就有可能造成其活性下降。另外Seavge法去除蛋白质的过程中会导致多糖的流失,一方面,除去变性胶状蛋白时会有少量多糖溶于其中;另一方面,有些多糖与蛋白质结合形成糖蛋白或者蛋白聚糖,也会随着蛋白的变性沉淀下来,造成多糖的损失[18]。另外,有些金针菇多糖还可以与蛋白质结合的形式来发挥其生物活性[19],蛋白质的去除必然会影响其相应的生物活性。这可能是本研究中FVP3即脱蛋白多糖抗氧化活性最低的原因。
4 结论
本研究中FVP1、FVP2、FVP3粗多糖样品的得率(相对于金针菇原料)分别为54.9%、9.26%、1.52%,纯度逐渐升高,依次为10.35%、19.48%、55.21%;FVP1、FVP2、FVP3均有一定的体外抗氧化活性,其中抑制羟自由基能力最强,DPPH自由基清除能力次之,总抗氧化能力最弱。在本试验的浓度范围内,3种纯度粗多糖的抗氧化能力呈剂量效应,但抗氧化能力大小却随着纯度的升高而降低,这说明多糖的分离纯化工艺有降低其体外抗氧化能力的影响,尤其是脱蛋白工艺。无论是从生产成本上,还是抗氧化活性上,FVP1较为经济适用。
参考文献:
[1]毕志树,郑国扬,李泰辉.广东大型真菌志[M].广州:广东科教出版社,1994:389-394
[2]王文亮,徐同成,刘丽娜,等.金针菇的保健功能及其开发前景[J].中国食物与营养,2011,17(7):18-19
[3]Zhang Z F,Lv G Y,He W Q,et al.Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J].Carbohydrate Polymers,2013,98(2):1524-1531
[4]姜秀梅,徐小磊,殷一民,等.金针菇多糖对衰老小鼠大脑抗氧化能力的影响[J].中国老年学杂志,2016,36(23):5797-5799
[5]刘冬,姚文兵,张健,等.富锗金针菇多糖对小鼠肝脏的保护作用[J].中国药科大学学报,2006,37(6):565-568
[6]Yang W J,Pei F,Shi Y,et al.Purification,characterization and antiproliferation activity of polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2012,88(2):474-480
[7]许晓燕,余梦瑶,魏巍,等.金针菇子实体多糖分离纯化及结构和免疫活性研究[J].菌物学报,2014,33(2):375-384
[8]王卫国,张仟伟,李瑞静,等.金针菇多糖的生理功能及其应用研究进展[J].河南工业大学学报(自然科学版),2016,37(1):120-128
[9]蔡和晖,廖森泰,叶运寿,等.金针菇的化学成分、生物活性及加工研究进展[J].食品研究与开发,2008,29(11):171-175
[10]张圣杰,王文亮,石贤权,等.金针菇多糖生物活性及功能性食品开发[J].中国食物与营养,2013,19(10):62-64
[11]邹宇晓,廖森泰,何轩辉,等.纯化工艺对金针菇多糖体外抗肿瘤活性的影响[J].中国食品学报,2013,13(6):9-14
[12]张剑,弓志青,王文亮,等.一种金针菇水提液多糖含量的检测方法[J].农产品加工,2017(8):31-34
[13]弓志青,刘春泉,李大婧.不同品种板栗贮藏过程中总酚与抗氧化活性研究[J].中国食品学报,2011,11(1):45-50
[14]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014(9):317-322
[15]叶敏.金针菇多糖的提取及清除羟自由基活性研究[J].毕节学院学报,2011,29(4):90-94
[16]李守勉,任清,李明,等.金针菇多糖的提取及其美容功效评价[J].食用菌,2009,31(5):72-73
[17]方积年,丁侃.多糖的研究开发中值得注意的一些问题[J].食品与药品,2007,9(12):1-4
[18]张善玉.天然产物多糖脱蛋白方法的研究[J].中国药房,2009,20(33):2633-2635
[19]贺伟强,巢新东,陈凌.金针菇多糖生物活性及提取工艺的研究进展(综述)[J].食药用菌,2014,22(2):80-83
