黑豆皮中花青素成分鉴定及细胞内抗氧化活性研究
2018-06-19李玉英白金晶王转花
李玉英,白金晶,李 新,王转花
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
黑豆(black soybean)是一种食药两用、具有较高营养价值的豆科植物,因其种皮中含有花色素类物质而呈现黑色。花青素(anthocyanins)是赋予植物颜色的最天然的水溶性色素,属于类黄酮化合物,以C6-C3-C6为基本骨架[1-2]。自然界中的花青素多以糖基的形式存在,保护花青素免受氧化降解,更有益于人体的吸收利用。据文献[3-4]报道,矢车菊素-3-O-葡萄糖苷是黑豆皮的重要活性成分,且因地域不同,黑豆皮中矢车菊素-3-O-葡萄糖苷含量存在明显差异。
花青素具有抗炎、抗肿瘤、防衰老、降糖、降脂、预防心血管疾病及抗氧化等多重功效[5-8]。ALHOSIN等[9]采用台盼蓝染色法检测得出,蓝莓提取物(Antho 50)对慢性淋巴白血病细胞具有抑制作用,且进一步通过annexin V-FITC/PI方法检测细胞发生凋亡。周丹蓉等[10]通过体外检测李果皮提取物清除羟自由基、超氧阴离子自由基与DPPH的能力,说明其抗氧化能力与含量呈正相关。HUANG等[11]将蓝莓花青素作用于内皮细胞后检测到活性氧水平降低和黄嘌呤氧化酶与超氧化物歧化酶升高,说明其具有一定的抗氧化性。但是关于黑豆皮花青素(BSCA)在细胞内的抗氧化性能及其对癌细胞的增殖抑制作用的研究报道相对较少。
本研究通过HPLC鉴定黑豆皮中所含花青素的成分,采用细胞内抗氧化活性(CAA)检测法及抗增殖活性的检测,从体外总抗氧化能力与体内氧化系统综合评价了其对细胞的抗氧化性能,旨在为从豆科植物开发一种具有抗癌作用的抗氧化保健产品奠定基础。
1 材料和方法
1.1 材料与试剂
黄仁圆形黑豆种子(产自山西运城);矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)标准品、飞燕草素葡萄糖苷(delphinidin-3-glucoside,D3G)标准品、矮牵牛素葡萄糖苷(Petunidin 3-glucoside,Pt3G)标准品、飞燕草素标准品、矮牵牛素标准品、矢车菊素标准品、DMEM培养基(上海立菲生物技术有限公司);D101大孔吸附树脂、胰蛋白酶(trypsin)、二甲基亚砜(dimethyl sulfoxide,DMSO)(北京索莱宝科技有限公司);Venusil XBP C18(L)液相色谱柱(博纳艾杰尔科技有限公司);DPPH,2,2′-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-Azobis(2-methylpropionamidine)dihydrochloride granu lar,ABAP),2′,7′- 二氯荧光黄双乙酸盐(2′,7′-Dichlorofluorescin diacetate,DCFH-DA)(美国 Sigma公司);谷胱甘肽(GSH)检测试剂盒、总超氧化物歧化酶(T-SOD)测试盒、过氧化氢酶(CAT)测试盒(南京建成生物科技有限公司);总谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、脂质氧化(MDA)检测试剂盒、BCA试剂盒(碧云天生物技术研究所);甲醇、甲酸、乙腈为色谱级试剂;水杨酸、FeSO4、无水乙醇、H2O2、抗坏血酸(Vc)均为国产分析纯。
人肝癌Hep G2细胞、人结肠癌HCT116细胞、人乳腺癌MCF-7细胞,由山西大学化学生物学与分子工程教育部重点实验室保存。
1.2 仪器与设备
高速粉碎机(浙江屹立工贸有限公司);旋转蒸发仪(上海亚荣生化仪器厂);微波催化合成/萃取仪(北京祥鹄科技公司);真空冷冻干燥器(上海汇分电子科技有限公司);恒温水浴锅(太仓华利达仪器厂);高效液相色谱仪(安捷伦有限公司);CO2细胞培养箱(美国Thermo公司);酶联免疫检测仪(美国BIO-RAD公司);多功能酶标仪(美国博腾仪器有限公司);Lambda 35型紫外-可见分光光度计(美国Perkin Elmer公司)。
1.3 方法
1.3.1 黑豆皮花青素(BSCA)的分离纯化与制备称取一定量的黑豆皮粉末,分别采用水浴与微波辅助提取法进行提取,通过单因素试验优化提取条件,并大量提取黑豆皮花青素,经D101大孔树脂加以纯化,高效液相色谱法分析鉴定黑豆皮中提取物的成分及含量。
HPLC的提取条件是依据文献[12-13]并改进,梯度洗脱程序,流动相A为0.3%的甲酸(色谱级),流动相B为100%的乙腈(色谱级);进样量为10μL;检测波长为513 nm;柱温为25℃;流速为0.8 mL/min;洗脱梯度为:90%的流动相A,10%的流动相B,0~5 min;85%的流动相 A,15%的流动相 B,5~45 min;75%的流动相 A,25%的流动相 B,45~60 min。
1.3.2 BSCA清除DPPH能力的测定 用电子天平称取0.5mgDPPH与一定量的BSCA,用无水乙醇将其分别配成5%的DPPH溶液与0.025,0.050,0.075,0.100,0,125,0.150,0.175,0.200 mg/mL的 BSCA。将BSCA溶液与DPPH溶液各取2 mL,充分混匀。避光条件下静置30 min后,在519 nm处检测其OD值。同样的操作,用乙醇代替DPPH溶液设置为对照,用乙醇代替样品设置为空白对照,Vc为阳性对照。按公式(1)计算DPPH清除率。

1.3.3 BSCA清除羟自由基能力的测定 10 mL试管中依次加入6 mmol/L的FeSO4溶液2.0 mL,不同质量浓度(0.2,0.4,0.6,0.8,1.0 m g/mL)BSCA 检测溶液2.0 mL与6 mmol/LH2O2溶液2.0 mL,摇匀后静置10 min。再加入6 mmol/L水杨酸溶液2.0 mL,充分摇匀后静置30 min,于510 nm处检测其OD值。同样步骤,用蒸馏水代替水杨酸设置为对照,用蒸馏水代替样品设置为空白对照,以Vc为阳性对照。按公式(2)计算BSCA对羟自由基的清除率。

1.3.4 BSCA对肿瘤细胞增殖的抑制作用 取对数生长期人肝癌Hep G2细胞、人结肠癌HCT116细胞与人乳腺癌MCF-7细胞,分别配制成5×103个单细胞悬液接种于96孔板中,每孔加入100 μL细胞悬液,放置于37℃,5%CO2培养箱中培养。待细胞贴壁后,药物组加入不同质量浓度(0,25,50,100,150,200,250 μg/mL)的 BSCA,每组设 5 个复孔。对照组只加入相应的培养基。培养24,48 h后每孔再加20 μL 5.0 mg/mL的 MTT培养4 h,弃培养液,加入150 μL的DMSO,室温下低速振荡至紫色结晶物完全溶解,在490 nm处测定吸光度值,按公式(3)计算细胞抑制率。
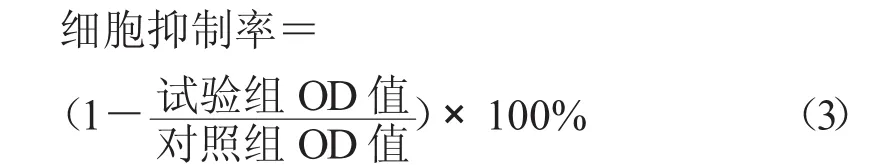
1.3.5 细胞抗氧化活性(cellular antioxidant activity,CAA)试验[14]取对数生长期Hep G2细胞,配制成4×103个单细胞悬液。接种于黑色的96孔板中,每孔加入100 μL细胞悬液,置于37℃,5%的CO2培养箱中培养至贴壁后,弃培养液,用PBS清洗一次。然后加入用无血清DMEM培养基稀释的100 μL的DCFH-DA与BSCA溶液,DCFH-DA的终浓度为 25 μmol/L,BSCA 的最终质量浓度为 0,2.5,5,10,25,50,100,150,200 μg/mL,每个浓度设置 5 个复孔。37℃继续培养60 min后移除培养液,PBS清洗 2~3 遍 。 每 孔 加 入 100 μL,600 μmol/L 的ABAP。对照组只加DCFH-DA探针与ABAP进行处理,空白组只用DCFH-DA处理,清洗后补加等体积的无血清培养基。采用多功能酶标仪测定荧光值。测定的条件:温度37℃,发射波长538 nm,激发波长485 nm,每5 min测定一次,跟踪测定1 h。采用Origin 8.5软件计算时间-荧光强度曲线下的积分面积,并且按照公式(4)计算细胞内抗氧化活性(CAA)值。

式中,∫SA为加入不同浓度花青素提取物后的荧光值与时间形成曲线的积分面积;∫CA为对照组的荧光值与时间形成曲线的积分面积。
1.3.6 体内抗氧化酶系统活力以及MDA指标的检测 取对数生长期的Hep G2细胞配制成3×104个单细胞悬液。接种于6孔培养板中,待贴壁后,用不同质量浓度(0,50,100,150 μg/mL)的 BSCA 处理细胞,对照组只加入完全培养基。作用24 h后,弃培养液,PBS清洗并收集细胞,常温下1 100 r/min离心5 min,弃上清,每管加100 μL的细胞裂解液,在冰上孵育30 min,4℃,12 000 r/min离心10 min,取其上清,用BCA试剂盒测其蛋白浓度。按照各试剂盒说明书取上清液用于测定SOD,CAT,GSH-Px,GSH,MDA指标的变化情况。
1.4 数据处理与统计分析
所有数据以平均数±标准差表示,通过Origin软件与Excel表格进行数据处理及统计分析。所有试验重复至少3次,应用SPSS13.0软件进行方差分析。
2 结果与分析
2.1 BSCA成分的分析
通过单因素试验,确定最佳提取条件及方法:提取剂为60%的乙醇,pH值为2,料液比为1∶30,微波功率500 W、微波时间90 s的微波辅助提取法。经HPLC分析BSCA的成分及含量,并与标准品进行比对得出,BSCA所含成分分别是:(1)D3G(占 6.7%),(2)C3G(占 64%),(3)Pt3G(占 3.4%),(4)矢车菊素(占20.5%)(图1)。其中,所含主要的花青素成分为C3G,含量为10.02 mg/g。

2.2 总抗氧化活性检测
DPPH与羟自由基清除法检测了BSCA体外抗氧化性能。由图2-A可知,BSCA与Vc清除DPPH的能力随其质量浓度的升高呈现一定的剂量相关性。BSCA清除DPPH的能力在一定程度上要强于Vc的作用。当BSCA的质量浓度在0.075 mg/mL时,清除率为58.5%。而Vc的质量浓度在0.1 mg/mL时,清除率才达到55.9%。从图2-B可以看出,BSCA与Vc对羟自由基的清除作用也同样随着质量浓度的升高而明显增强。当BSCA质量浓度达到0.6 mg/mL时,对羟自由基的清除率达到64.3%,而Vc对羟自由基的清除率为53.35%。可见,BSCA强于Vc对羟自由基的清除作用。

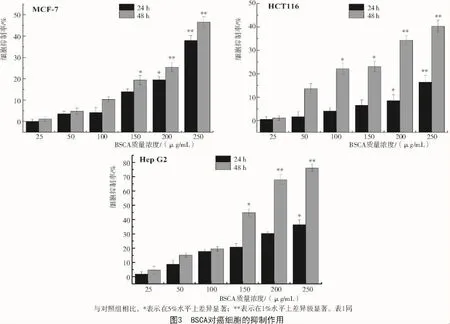
2.3 BSCA的抗增殖活性检测
采用MTT法检测不同质量浓度的BSCA分别作用于肝癌Hep G2、结肠癌HCT116、乳腺癌MCF-7细胞后的细胞增殖情况如图3所示,BSCA作用细胞一定时间后,其对细胞的抑制作用呈现一种时间-剂量依赖性的降低趋势。作用48 h后,150 μg/mL的 BSCA对 MCF-7,HCT116和 Hep G2的抑制率分别为19.4%±2.16%,23.06%±2.2%和44.76%±2.96%,与对照组相比有显著性差异(P<0.05);200 μg/mL 的 BSCA 对 MCF-7,HCT116 和Hep G2的抑制率分别为25.4%±2.1%,34.3%±1.9%和67.9%±2.3%。可见,肝癌Hep G2细胞株对BSCA的作用最为敏感,因此,后续细胞相关试验均选用Hep G2细胞。
2.4 细胞抗氧化活性(CAA)检测
细胞抗氧化活性方法用于在细胞水平定量分析食品提取物质或日常食用食品的抗氧化能力。自身不带荧光的探针DCFH-DA可自由通过细胞膜,但在被细胞膜上的酯酶水解后的DCFH不能自由过膜。在自由基诱导剂ABAP处理下,DCFH会在进入细胞后刺激细胞膜产生更多的活性氧,此时进入细胞内的DCFH在自由基或活性氧的作用下氧化生成带荧光的DCF。即可通过检测DCF的荧光值而检测出自由基的水平。在抗氧化剂的作用下,即可将自由基清除而阻断DCFH转变成DCF,最终使荧光强度降低。因此,与对照组相比,细胞内荧光强度的减弱,反映出样品的抗氧化能力。
从图4-A可以看出,细胞的荧光强度随着BSCA质量浓度的增大而降低,说明BSCA具有抑制细胞内产生DCF的能力,即花青素质量浓度越大,荧光值越低,抗氧化能力越强。并且与空白组相比,试验组荧光强度具有显著差异(P<0.05)。
从图4-B可以看出,细胞的荧光强度随着BSCA质量浓度呈现一定的剂量依赖效应关系。按照公式(1)计算得出BSCA抑制自由基氧化DCFH的剂量效应曲线,发现当BSCA的质量浓度达到100 μg/mL时,CAA值达到了 50(即 EC50值)。

2.5 体内抗氧化酶系统及MDA指标的检测
人体自身体内存在维持机体抗氧化与非抗氧化平衡的系统,可清除体内的自由基。其中,超氧化物歧化酶(SOD)与过氧化氢酶(CAT)共同构成了体内的抗氧化防御系统。谷胱甘肽(GSH)与谷胱甘肽过氧化物酶(GSH-Px)构成反应体系,消除体内脂类过氧化物以及自由基的毒害作用。本研究对SOD,CAT,GSH,GSH-Px的抗氧化酶加以分析,结果表明,随着BSCA质量浓度的增加,几种酶均有一定程度的升高(表1)。说明BSCA可以增强机体的抗氧化性能。而丙二醛(MDA)在遇到氧化应激的情况下,会发生脂质氧化,对机体造成一定的损伤。将BSCA作用于细胞24 h后,细胞内MDA的含量随着BSCA质量浓度的增加呈现出降低趋势。说明BSCA还有助于避免脂质的过氧化,增强机体自身的抗氧化系统。
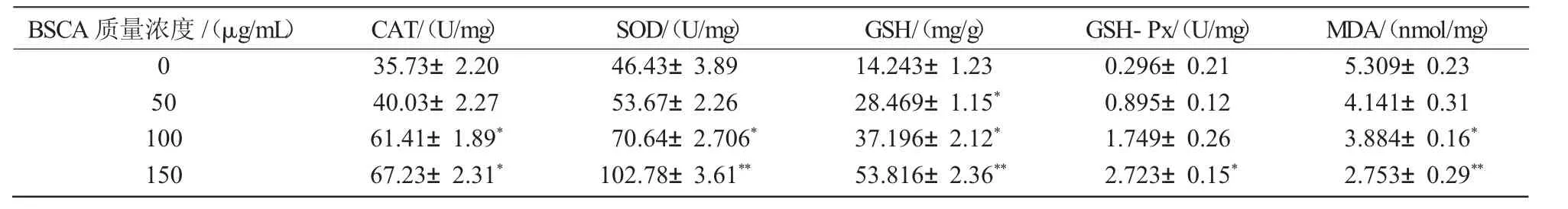
表1 BSCA 对 CAT,SOD,GSH,GSH-Px,MDA 含量的影响
3 讨论
本研究采用高效液相色谱技术分析鉴定了山西特产黑豆皮中花青素(BSCA)的组分,分别为矢车菊素-3-O-葡萄糖苷、飞燕草素葡萄糖苷、矮牵牛素葡萄糖苷和矢车菊素,其中,主要成分为矢车菊素-3-O-葡萄糖苷(C3G),其含量达10.02 mg/g。刘占云等[4]利用高效液相色谱法分析了湖北黄仁的、东北青仁与黄仁的、山东滨州青圆的及安徽青扁的4个不同地区的5种黑豆皮中矢车菊素-3-O-葡萄糖苷(C3G)的含量,测定结果为5.263~12.829 mg/g,可见本试验所用的山西黑豆中含有的C3G成分较高。JANG等[15]采用高效液相色谱法检测了韩国黑豆中所含花青素的组分是矢车菊素-3-O-葡萄糖苷、飞燕草素葡萄糖苷和矮牵牛素葡萄糖苷3种成分;LEE等[16]研究表明,黑豆皮中的花青素是矢车菊素-3-O-葡萄糖苷、飞燕草素葡萄糖苷、矮牵牛素葡萄糖苷、天竺葵素葡萄糖苷及矢车菊素5种成分。这些都与本研究山西黑豆皮中所含花青素成分有一定的区别。
据文献[6,9,17]报道,花青素具有一定的抗肿瘤活性。为了进一步研究BSCA的抗癌活性,本研究采用MTT法检测了BSCA对3种癌细胞增殖的抑制作用,结果表明,BSCA对3种癌细胞均有不同程度的抑制作用,且对肝癌Hep G2细胞的作用最为显著。
体外抗氧化检测方法已有大量文献报道[18-20]。而CAA法是基于传统的化学抗氧化活性检测方法(ORAC,TOSC,FRAP,TEAC,TRAP) 以外的一个有重大改进的方法[19]。此方法不仅相对简单、省时、耗材较少,最主要是以很简便的方式模拟生物体内环境,CAA检测涉及到了细胞吸收、代谢以及具有重要调控作用的生物活性成分的分布等方面。因此,CAA法研究结果更加贴切的体现抗氧化物质在体内所发挥的抗氧化性能。本研究CAA法结果显示,BSCA具有明显的细胞内抗氧化活性。同时,检测了BSCA对体内固有的抗氧化酶的影响,发现BSCA均有助于酶活性的增强,使来源于黑豆花青素的抗氧化活性具有更明显的应用价值。
综上所述,黑豆皮花青素可以作为天然无毒副作用的抗氧化剂加以开发成保健食品。
[1] GODA Y,SHIMIZU T,KATO Y,et al.Two acylated anthocyanins from purple sweet potato [J].Photochemistry,1997,44(1):183-186.
[2]高喆,特布沁,王佳,等.西伯利亚白刺不同成熟阶段果实花青素成分的分析[J].华北农学报,2014,29(4):130-134.
[3] GUO H H,LING W H,WANG Q.Cyanidin 3-glucoside protects 3T3-L 1 adipocytes against H2O2-or TNF-α-induced insulin resistance by inhibiting c-Jun NH2-terminal kinase activation[J].Biochemical Pharmacology,2008,75:1393-1401.
[4]刘占云,刘晓秋,白淑芳,等.HPLC法测定不同产地黑豆皮中矢车菊素 -3-O-葡萄糖苷的含量[J].食品科学,2011,32(18):256-259.
[5]SONGY,HUANGLL,YUJ F.Effects of blueberry anthocyanins on retinal oxidative stress and inflammation in diabetes through Nrf2/HO-1 signaling[J].Journal of Neuroimmunology,2016,301:1-6.
[6]LEE J S,KIMY R,PARK J M,et al.Cyanidin-3-glucoside isolated from mulberry fruits protects pancreatic β-cells against oxidative stress-induced apoptosis[J].International Journal of Molecular Medicine,2015,35:405-412.
[7]WANG Y,ZHAO L,LU F,et al.Retinoprotective effects of bilberry anthocyanins via antioxidant,anti-inflammatory,and anti-apoptotic mechanisms in a visible light-induced retinal degeneration model in pigmented rabbits[J].Molecules,2015,20:22395-22410.
[8]赵巧玲,陈晓梅,赵晋忠,等.黑豆种皮花色苷含量及抗氧化活性的测定[J].山西农业科学,2017,45(8):1240-1243,1267.
[9] ALHOSIN M,LEÓN-GONZÁLEZ A J,DANDACHE I,et al.Bilberry extract(Antho 50)selectively induces redox-sensitive caspase 3-related apoptosis in chronic lymphocytic leukemia cells by targeting the Bcl-2/Bad pathway[J].Scientific Reports,2015,5:1-10.
[10]周丹蓉,方智振,廖汝玉,等.李果皮花色素苷、类黄酮和类胡萝卜素含量及抗氧化性研究 [J].营养学报,2013,35(6):571-576.
[11] HUANG W,ZHU Y,LI C,et al.Effect of blueberry anthocyanins malvidin and glycosides on the antioxidant properties in endothelial cells[J].Oxidative Medicine and Cellcular Longevity,2016,1155:1-10.
[12]殷丽琴,彭云强,钟成,等.高效液相色谱法测定8个彩色马铃薯品种中花青素种类和含量 [J].食品科学,2015,36(18):143-147.
[13]YAOLJ,ZHANGN,WANGCB,et al.Highly selective separation and purification of anthocyanins from bilberry based on a macroporous polymeric adsorbent[J].Journal of Agricultural and Food Chemistry,2015,63:3543-3550.
[14]WOLFE K L,LIU R H.Cellular antioxidant activity(CAA)assay for assessingantioxidants,foods,and dietary supplements[J].Journal of Agricultural and Food Chemistry,2007,55:8896-8907.
[15]JANGH,HA US,KIMSJ,et al.Anthocyanin extracted fromblack soybean reduces prostate weight and promotes apoptosis in the prostatic hyperplasia-induced rat model[J].Journal of Agricultural and Food Chemistry,2010,58:12686-12691.
[16]LEE J H,KANG N S,SHIN S O,et al.Characterisation of anthocyanins in the black soybean(Glycine max L.)by HPLC-DADESI/MSanalysis[J].Food Chemistry,2009,112(1):226-231.
[17] LI D T,WANG P P,LUO Y H,et al.Health benefits of anthocyanins and molecular mechanisms:Update from recent decade[J].Critical Reviews in Food Science and Nutrition,2017,57(8):1729-1741.
[18]张乐,王赵改,陈丽娟,等.板栗壳原花青素的稳定性及抗氧化活性[J].天津农业科学,2016,22(2):9-14.
[19]朱晓红,沈佳鑫,马瑞,等.蓝莓叶水提物的体外抗氧化活性[J].山西农业科学,2012,40(8):833-836.
[20]刘会超,贾文庆,尤扬,等.连翘花色苷的提取及其稳定性研究[J].河南农业科学,2010(6):121-123.
