甘蓝型油菜BnMYB1基因克隆及其对非生物胁迫的响应
2018-06-19王景雪
樊 溢,刘 明,王景雪
(山西大学生命科学学院,山西 太原 030006)
MYB蛋白是植物最大的转录因子家族之一[1]。目前MYB转录因子已经从许多植物中克隆和鉴定出来,其中在拟南芥中已经发现有超过196个MYB基因,玉米有超过157个MYB基因[2-3]。MYB蛋白含有1~3个串联的、不完全重复的MYB结构域(R1,R2和R3)。每个结构域由51~52个氨基酸序列组成。根据MYB结构域数目的不同,将MYB转录因子分为3类,分别为:R1-MYB,R2R3-MYB和R1R2R3-MYB[4]。其中,R2R3-MYB类转录因子是目前研究最为广泛的一类MYB转录因子,其含有R2和R3等2个保守结构域,每个结构域含有3个保守的色氨酸残基起着疏水核心的作用,主要参与调控植物发育、代谢和对生物与非生物胁迫的反应等多种生理过程[5-7]。以往的研究表明,MYB蛋白在植物对逆境胁迫的响应上有着重要作用[8]。
甘蓝型油菜(Brassica napus L.)是我国乃至全世界重要的油料作物。菜籽油不仅是优质的食用油,也是重要的工业原料和生物能源,大力发展油菜产业有助于保障我国的粮油安全,促进农民增收,还能为我国能源安全战略作出重要贡献。然而,由于全世界范围内土地干旱和土壤盐渍化的趋势愈加严重,油菜生产也面临着日益严重的干旱威胁。干旱、土壤盐渍化会引起油菜形态、生理生化及分子水平等一系列的变化,导致产量下降[9-10];贺亚军等[11]通过对甘蓝型油菜耐盐相关性状进行全基因组关联分析,发现MYB转录因子与油菜的耐盐性相关。
本研究以甘蓝型油菜晋油4号为试验材料,并从其叶片组织中克隆到了编码BnMYB1转录因子的基因,检测其在不同组织部位的表达量,并测定其在应对不同非生物胁迫下的表达情况,为进一步研究BnMYB1基因的功能和利用BnMYB1基因选育油菜新品种奠定了基础。
1 材料和方法
1.1 试验材料
本试验以甘蓝型油菜晋油4号为试验材料。晋油4号种子由山西省农业科学院棉花研究所油菜育种研究室提供。
1.2 试验方法
1.2.1 油菜基因组DNA提取及PCR扩增Bn-MYB1基因 本研究利用NCBI已发表的BoMYB1基因(GenBank登录号:GU219985.1),根据其序列使用Primer 5.0软件设计ORF保守区上下游引物BoMYB1-F:5′-CGGGATCCATGGAGGATTCGT-3′和 BoMYB1-R:5′-AACTGCAGCTAATCAAGTTCTA CAG-3′,利用CTAB法提取晋油4号叶片组织基因组,运用聚合酶链式反应(PCR)进行体外扩增。PCR反应条件:94℃预变性5 min;94℃变性30 s,57℃退火 30 s,72℃延伸 60 s,72℃终延伸 10 min,共30个循环;4℃下保存。
1.2.2 BnMYB1基因扩增产物的克隆与测序PCR产物进行1.0%琼脂糖凝胶电泳,将产物条带从胶上切下,按照SanPre柱式DNA胶回收试剂盒(上海生工生物工程公司)的步骤进行回收。将回收的PCR产物克隆到pMD19-T(TakaRa)载体上。将10 μL重组质粒加到100 μL大肠杆菌DH5α感受态细胞中轻摇匀,冰上放置30 min后42℃水浴热激90 s,加入1 mL不含抗生素的LB液体培养基于37℃,180 r/min复苏2 h,然后将菌液涂布到含有氨苄青霉素的固体LB培养基上37℃过夜倒置培养,次日挑选单菌落进行阳性克隆鉴定。按照SanPre柱式质粒DNA小量抽提试剂盒(上海生工生物工程公司)步骤进行质粒抽提,进行PCR鉴定,确定为阳性后,将抽提的质粒使用M13通用引物送至上海生工生物工程公司进行测序。克隆得到的基因命名为 BnMYB1(KP296768)。
1.2.3 BnMYB1转录因子基因序列生物信息学分析 将测序结果进行一系列生物信息学分析,使用NCBI上的ORF finder程序推导目的基因的氨基酸序列;通过 ProtParam(http://web.expasy.org/protparam/)分析相对分子量、等电点及疏水性等理化性质;采用SignalP4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测和蛋白亚细胞定位;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpr ed_sopma.pl)进行二级结构预测;利用ProtFun(https://www.cbs.dtu.dk/services/ProtFun/)进行蛋白功能预测;利用 Motif Scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan#GRAPHIC)进行蛋白功能结构域的分析;利用clustal 1.81软件进行多序列比对,结合MEGA7软件构建系统发育树。
1.2.4 BnMYB1转录因子在油菜幼苗不同组织部位中的表达分析 在人工气候室内种植油菜,生长28 d后,分别取幼苗的根、茎、叶组织,使用Trizol(TaKaRa)提取总 RNA,使用 PrimeScript RT gDNA Eraser试剂盒(TaKaRa)将提取的总RNA反转录成cDNA,使用 SYBR Premix Ex TaqTM(TaKaRa)试剂进行qRT-PCR试验,将油菜Actin基因的相对扩增作为内部对照。利用Primer 5.0软件分别设计Bn-MYB1和Actin基因的上下游引物。BnMYB1:F5′-AGGATTCGTCCAAAGGGTT-3′;R5′-AGCTGGGCT TAATAGGTGTAGG-3′。Actin:F5′-CCCTGGAATT GCTGACCGTA-3′;R5′-TGGAAAGTGCTGAGGGAT GC-3′。qRT-PCR 反应条件为:95℃,15min;94℃,10 s,57 ℃,15 s,72 ℃,20 s,共 40 个循环。
1.2.5 油菜幼苗非生物胁迫种类及处理方法 在油菜幼苗期,本研究选取了盐胁迫、干旱胁迫、低温胁迫和水杨酸处理等4种非生物胁迫,分别对油菜幼苗进行不同处理,不同处理时间下采叶片提取总RNA,反转录成cDNA。用1.2.4的所列引物,进行qRT-PCR扩增,检测BnMYB1基因在各种胁迫下的表达量。
1.2.5.1 盐胁迫试验 油菜种子在室内23℃条件下发芽,待油菜生长28 d后进行盐胁迫。具体方法:对油菜幼苗停止正常浇水,使用200 mmol/L NaCl溶液,对幼苗进行高盐处理,用等量蒸馏水处理作为对照。在 0.5,1,4,8,16,24,48,72 h 后分别取叶片进行后续试验。
1.2.5.2 干旱胁迫试验 油菜种子在室内23℃条件下发芽,待油菜生长28 d后进行干旱胁迫。具体方法:对幼苗停止正常浇水,代之浇含有200 g/L PEG-6000的水溶液,进行模拟干旱试验,用等量蒸馏水处理作为对照。在 0.5,1,4,8,16,24,48,72 h后分别取叶片进行后续试验。
1.2.5.3 冷胁迫试验 油菜种子在室内23℃条件下发芽,待油菜生长28 d后进行冷胁迫处理。具体方法为:将幼苗置于4℃恒温培养箱中进行冷胁迫处理,在 0.5,1,4,8,16,24,48,72 h 后分别取叶片进行后续试验。
1.2.5.4 水杨酸处理 油菜种子在室内23℃条件下发芽,待油菜生长28 d后进行水杨酸处理。具体方法:对油菜幼苗停止正常浇水,叶面喷施5 mmol/L水杨酸,以喷施等量蒸馏水作为对照,喷施后0.5,1,4,8,16,24,48,72 h 分别采取叶片进行后续试验。
2 结果与分析
2.1 甘蓝型油菜BnMYB1基因克隆与分析
用设计的基因全长引物进行PCR扩增,PCR产物经过1%琼脂糖凝胶电泳检测,扩增出大小约1 300 bp的目的条带(图1),与预测结果大小一致。把回收的目的条带构建入pMD19-T载体,经过转化、鉴定后,提取质粒送上海生工生物工程公司进行测序。

2.2 甘蓝型油菜BnMYB1基因序列分析
序列测定结果分析表明,BnMYB1基因全长为1 393 bp,经NCBI中ORF finder推导出目的基因的氨基酸编码序列为1个753 bp的开放阅读框,编码250个氨基酸。经过比对分析,BnMYB1属于典型的R2R3-MYB亚家族,其N端含有R2,R3等2个保守的MYB结构域,R2和R3分别由51,50个氨基酸组成,R2结构域含有3个色氨酸(W),色氨酸之间有18~19个氨基酸间隔(图2),R3含有2个色氨酸,第1个色氨酸被亮氨酸(L)所取代。ProtParam预测结果表明,BnMYB1蛋白分子量为21.4 ku,等电点为9.13,平均亲水性系数(GRAVY)为-0.426,亲水氨基酸数占总氨基酸数的83.2%,故可推测BnMYB1蛋白为小分子亲水性蛋白;根据SignalP4.1 Server信号肽预测结果表明,BnMYB1所编码的蛋白不存在信号肽,亚细胞定位预测显示该蛋白定位于细胞核中;BnMYB1蛋白二级结构预测显示,其蛋白质结构由62个α-螺旋(24.8%),31个延伸链(12.4%),150个无规则卷曲(60.16%)组成。生物学功能预测显示,BnMYB1蛋白具有合成辅酶因子、嘌呤、嘧啶和能量代谢、脂肪酸代谢等方面的功能(表1)。Motif Scan软件分析序列含有一个核定位序列(NLS),其作用与入核载体相互作用使BnMYB1蛋白被运进细胞核内发挥作用。


表1 BnMYB1编码蛋白功能预测
2.3 BnMYB1转录因子进化树构建
将来自不同物种的、与非生物逆境胁迫响应相关的MYB转录因子序列(包括:AtMYB30(822525),AtMYB96 (836367),AtMYB60(837403),OsMYB4(LOC4336407),TaMYB33(LOC100859950),GmMY-B92(DQ822903.1),ZmMYBZ2(DQ902861),PeMYB2(HM747940.1),ShMYB18 (ACT98139.1),CmMYB2(JF795918))与克隆得到的BnMYB1基因利用clustal 1.81软件进行多序列比对后,结合MEGA7软件构建系统发育树。结果表明,BnMYB1和其他作物逆境相关的R2R3-MYB蛋白表现出不同程度的相似性(图 3)。在拟南芥中,AtMYB60[12]和 At-MYB96[13]参与干旱胁迫,能调控气孔运动并影响根的生长;小麦中TaMYB33的过表达可以促进渗透压调节物质脯氨酸的合成,从而提高小麦的耐盐和耐旱性[14]。TaMYB32同样受盐胁迫诱导表达,在拟南芥中超表达TaMYB32,TaMYB33基因,均可使植株的耐盐能力有所增强[15]。BnMYB1与大豆Gm-MYB92处于同一分支,且转GmMYB92基因的拟南芥中,植株表现出更好的耐盐耐冻性[16]。因此,推测BnMYB1同样具有参与响应高盐、干旱胁迫的功能。
2.4 BnMYB1转录因子在油菜幼苗不同组织中的表达特征分析
晋油4号幼苗期分别取其根、茎、叶组织,提取其总RNA进行反转录,利用设计的qRT-PCR引物,对BnMYB1在甘蓝型油菜幼苗根、茎、叶中的相对表达量进行分析。从图4可以看出,BnMYB1在油菜根、茎、叶中均有表达,其中在叶片中表达最高,是根中表达量的15倍以上,而在根中的表达量最低。因此,推测BnMYB1对水分胁迫的响应主要是减少叶片对水分的蒸腾。


2.5 甘蓝型油菜BnMYB1对非生物胁迫的响应分析
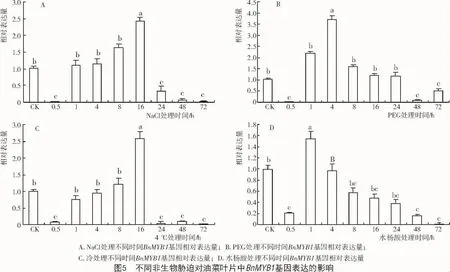
取生长28 d的甘蓝型油菜幼苗,分别进行胁 迫处理,对照组用等量蒸馏水进行处理,分别提取不同处理的叶片总RNA,用qRT-PCR法分析其相对表达量。结果表明,在4种胁迫处理下,BnMYB1基因的表达量由于受外界瞬时刺激,在0.5 h时均处于较低状态。在高盐胁迫处理16 h内其表达量呈上升趋势,在处理16 h时BnMYB1基因表达明显上调,表达量最大,是对照的2.4倍,24 h后基因的表达低于对照,说明高盐胁迫诱导了BnMYB1转录因子基因的大量表达(图5-A)。
在PEG-6000模拟干旱胁迫下,BnMYB1基因在4 h内表达量迅速升高,4 h的表达量最高,为对照的3.7倍,之后随处理时间的增加,相对表达量逐渐减小,处理16~24 h其表达量接近对照且无显著差异(图5-B)。说明BnMYB1基因受干旱胁迫诱导,参与了油菜对水分胁迫的应答。
在4℃冷胁迫处理1~8 h内,BnMYB1基因表达量有升高趋势,在处理16 h时表达量水平最高,为对照的2.5倍;24 h后BnMYB1基因表达量均低于对照(图5-C)。水杨酸处理后,BnMYB1基因的表达量在1 h时略有升高,为对照的1.2倍,之后随处理时间增加,BnMYB1基因的表达量逐渐降低(图5-D)。
3 结论与讨论
已有研究表明,MYB作为植物体内最大的一类转录因子,参与植物次生代谢、器官的形成,调节激素和环境因子的应答、细胞分化、细胞周期[17],尤其是R2R3类MYB转录因子在植物响应非生物胁迫方面发挥了关键的作用。油菜中关于MYB研究主要集中于花药发育和花粉形成等方面[18],而关于MYB基因在油菜抗逆方面的研究较少。本研究从甘蓝型油菜晋油4号中克隆得到BnMYB1基因,该基因编码的蛋白质属于典型的R2R3-MYB类转录因子。已有研究证明,R2R3结构域在植物抵御非生物逆境胁迫方面有重要作用。
利用qRT-PCR技术分析发现,BnMYB1在油菜根、茎、叶中均有表达,在叶中表达量较高。在高盐、干旱、冷胁迫处理下,BnMYB1在叶中的表达量均有增高,表明油菜在应对非生物胁迫过程中BnMYB1发挥重要的作用。水杨酸作为植物内普遍存在的内源信号分子,主要参与植物对病原的防御反应。有研究表明,烟草的Myb1基因在受到外界水杨酸刺激后表达量增高,抗病蛋白随之增高,表明烟草Myb1在植物的抗病反应中起重要的调控作用[19]。本研究在对油菜外施水杨酸后,BnMYB1表达量升高,推测其可能也参与抗病蛋白基因的激活和植物抗病防卫反应。
植物对环境胁迫如干旱的抗性是受多基因调控的数量性状。因此,单一基因的改变往往对这些性状影响有限,而MYB转录因子可以通过调控其下游的一系列基因而共同作用,从而调节植物对环境胁迫的响应[20]。基于前人研究发现,植物在逆境影响下,R2R3-MYB类转录因子的表达量会发生明显变化,这一变化预示着这类转录因子将调控下游抗逆性基因的表达[21],SHAN等[22]从菊花中克隆得到R2R3-MYB类转录因子CmMYB2基因,可以调控逆境相关基因的表达,在植株应对干旱和高盐胁迫过程中起到关键作用;肖冬长等[23]从毛竹中克隆得到R2R3-MYB类转录因子PeMYB2基因,其在拟南芥中的过表达可使植株对盐胁迫有更高的耐性。本研究获得的BnMYB1基因参与了逆境胁迫的响应,其作为转录因子如何调控下游基因表达需要进一步研究。
[1] RIECHM ANN J L,HEARD J,MARTIN G,et al.More than 80 R2R3-MYBregulatory genes in the genome of Arabidopsis thaliana[J].Plant J,1998,14:273-284.
[2]LIANG Y K,DUBOS C,DODD I C,et al.AtMYB61,an R2R3-MYB transcription factor controlling stomatal aperture in Arabidopsis thaliana[J].Current Biology,2005(15):1201-1206.
[3]DU H,FENG B R,YANG S S,et al.The R2R3-MYB transcription factor gene familyin maize[J].PloSONE,2012,7(6):e37463.
[4]乔孟,于延冲,向凤宁.拟南芥R2R3-MYB类转录因子在环境胁迫中的作用[J].生命科学,2009,27(1):145-150.
[5]刘蕾,杜海,唐晓凤,等.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-1271.
[6] KANEI-ISHII C,SARAI A,SAWAZAKI T,et al.The tryptophan cluster:a hypothetical structure of the DNA-binding domain of the myb protooncogene product[J].The Journal of Biologigal Chemistry,1990,265(32):19990-19995.
[7]WILKINS O,NAHAL H,FOONG J,et al.Expansion and diversification of the Populus R2R3-MYB family of transcription factors[J].Plant Physiol,2009,149(2):981-993.
[8]DUVAL M,HSIEH T F,KIM S Y,et al.Molecular characterization of AtNAM;A member of the Arabidopsis NAC domain superfamily[J].Plant Molecular Biology,2002,50:237-248.
[9]汤章城.植物的抗逆性和节水栽培 [J].植物生理学通讯,1997(6):473-474.
[10]陈良.油菜相关抗逆基因的鉴定和功能研究[D].武汉:华中师范大学,2011.
[11]贺亚军,吴道明,游婧璨,等.油菜耐盐相关性状的全基因组关联分析及其候选基因预测 [J].中国农业科学,2017,50(7):1189-1201.
[12]OH J E,KWONY,KIMJ H,et al.A dual role for MYB60 in stomatal regulation and root growth of Arabidopsis thaliana under drought stress[J].Plant Mol Biol,2011,77(1/2):91-103.
[13]郭弘光.MYB转录因子功能与调控研究进展 [J].安徽农业科学,2012,40(20):10381-10382.
[14] QIN Y,WANG M,TIAN Y,et al.Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor in creases salt and drought tolerance in Arabidopsis[J].Mol Biol Rep,2012,39(6):7183-7192.
[15]ZHANG L,ZHAO G,JIA J,et al.Molecular characterization of 60 isolated wheat MYB genes and analysis of their expression during abiotic stress[J].Exp Bot,2011,63:203-214.
[16]LIAO Y,ZOU H F,WANG H W,et al.Soybean GmMYB76,Gm-MYB92,and GmMYB177 genes confer stress tolerance in transgenic Arabidopsis plants[J].Cell Research,2008,18:1047-1060.
[17]李绍翠,姜新强,丁爱琴,等.月季RhMYB61基因的克隆及表达特征分析[J].华北农学报,2017,32(5):61-68.
[18]宋欣,赵淑清.拟南芥35S:MS606/myb26转基因植物的鉴定[J].山西农业科学,2017,45(5):680-683.
[19] YANG Y,KLESSING D F.Isolation and characterization of a tobacco mosaic virus-inducible myb oncogene homolog from tobacco[J].PNAS,1996,93(25):14972-14977.
[20]ZHANG Y Y,YANG C W,LI Y,et al.SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signalingin Arabidopsis[J].Plant Cell,2007,19(6):1912-1929.
[21]唐宁,陈信波.植物MYB转录因子与非生物胁迫响应研究[J].生物学杂志,2014,31(3):74-78.
[22]SHAN H,CHEN S,JIANG J,et al.Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance,increases hypersensitivity to ABA and delays floweringin Arabidopsis thaliana[J].Mol Biotechnol,2012,51(2):160-173.
[23]肖冬长,张智俊,徐英武,等.毛竹MYB转录因子PeMYB2的克隆与功能分析[J].遗传,2013,35(10):1217-1255.
