中华鳖fut2基因的克隆及其组织表达模式分析
2018-06-19宋如昕
邢 潇,宋如昕
(山西大学生命科学学院,山西 太原 030006)
动物肠道既要防止肠道菌群的入侵,同时也要避免对肠道微生物过度免疫反应,因此,肠道微生物的种类和数目要维持一个平衡状态[1]。但是有众多的理化与病理因素可能使肠道微生物异常,例如抗生素、饮食结构的改变以及各种胁迫均会导致肠道菌群结构发生改变[2-4]。肠道微生物可以影响宿主的代谢、营养吸收和免疫功能,菌群的失衡会给宿主的健康带来严重影响。研究表明,肠道菌群可以通过肠-脑轴对宿主的应激反应、焦虑、抑郁和认知功能造成重要影响[5-7]。因此,中华鳖肠道菌群的失衡会严重制约中华鳖的健康生产,从而对中华鳖养殖户造成巨大的经济损失。
岩藻糖基转移酶(fucosyltransferase,FUTs)能够催化岩藻糖的形成,主要表达在胃肠黏液腺中[8]。岩藻糖能够决定组织血型抗原的形成,是多种肠道微生物的黏附受体[9-10]。因此,FUT2的缺失或异常表达会影响组织血型抗原的表达,从而影响肠道细菌的组成,严重影响宿主的代谢和免疫等功能。
本研究利用PCR技术扩增中华鳖fut2基因的cDNA全长序列,通过生物信息学分析预测fut2相关理化性质,同时用Real-time PCR技术分析fut2基因在中华鳖不同组织中的表达差异,旨在为将来研究fut2基因打下基础,对于中华鳖人工养殖产业的发展以及资源的恢复具有一定的意义。
1 材料和方法
1.1 试验材料
中华鳖购自河北省玉田县中华鳖养殖场,买回后在实验室驯养14 d,每日进行一次换水喂食,水温用加热棒控制在(25±1)℃,取材方法同宋如昕等的方法[11]。
1.2 试验方法
1.2.1 总RNA的提取和cDNA的反转录 RNA的提取采用山西大学生命科学学院非生物胁迫的细胞分子生物学效应与适应生物学实验室总结的方法[12],用Trizol提取。采用紫外分光光度计测量RNA的浓度,将合格的RNA样品调成统一浓度,将其放入超低温冰箱中保存,随后用反转录试剂盒将RNA反转录成cDNA。
1.2.2 中华鳖fut2基因cDNA全长的获得 对中华鳖fut2基因序列进行预测,在保守区设计引物并合成。使用SMARTer RACE cDNA扩增试剂盒,以中华鳖的混合样品cDNA为模板进行RACE。RACE产物跑胶检测,对预测的fut2条带进行切胶回收,连接到载体上,然后转化,挑单克隆培养,菌液PCR筛选后测序,测序结果在BioEdit中进行拼接,根据拼接得到的序列设计fut2 cDNA全长验证引物,经验证后获得中华鳖fut2 cDNA全长序列。
1.2.3 生物信息学分析 在NCBI的Blastp中对中华鳖fut2进行同源性比对;使用Signal P 4.1 server预测信号肽;蛋白质二级结构采用SOPMA在线软件预测,相似性以及一致性利用NCBI数据库分析。用ORF Finder推测其ORF及所编码的氨基酸序列;在ProtParam tool中分期FUT2氨基酸序列的等电点和亲水性;跨膜结构的分析则用TMHMM软件;利用SMART数据库分析结构域;用中华鳖fut2的氨基酸序列与其他动物的蛋白序列进行比对。采用ClustalX软件和MEGA 6.0软件,构建中华鳖FUT2氨基酸序列的系统进化树。蛋白3D结构预测采用同源建模法,用SWISS-MODEL在线软件完成。
1.2.4 实时荧光定量PCR检测 根据获得的中华鳖fut2基因的全长,荧光定量引物fut2 Fwd,fut2 Rev(表1)在Primer 3.0在线软件中进行设计。以反转录各组织的cDNA为模板,ef1α为内参基因。反应体系为:去离子水 3.75 μL,正向引物 0.375 μL,反向引物 0.375 μL,SYBR 7.5 μL。使用荧光定量PCR 仪检测 Ct值,用 2-ΔΔCt法对结果进行分析,计算各个基因的相对表达量,通过Graphpad软件对数据进行处理并导出柱状图。
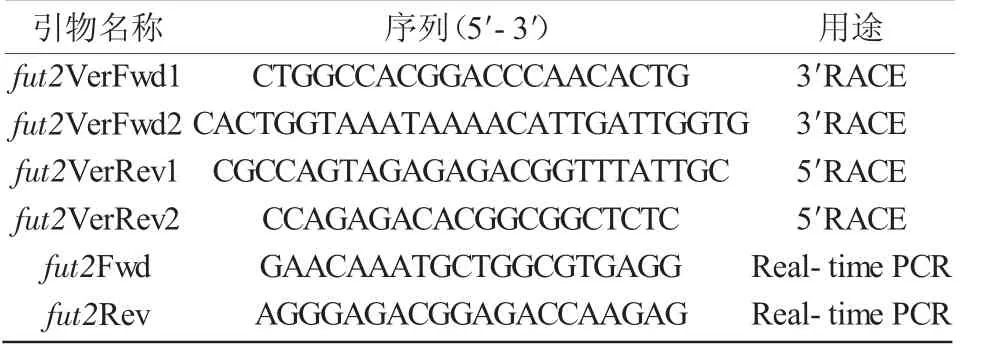
表1 引物序列
1.3 数据统计分析
数据处理和柱状图的绘制使用Graphpad软件,统计分析采用SPSS 17.0软件,差异显著水平检验采用单因素方差分析(one-way ANOVA),显著水平设为P<0.05(任何2组含有同一字母,表示该2组之间差异不显著,反之,则表示差异显著)。
2 结果与分析
2.1 生物信息学分析
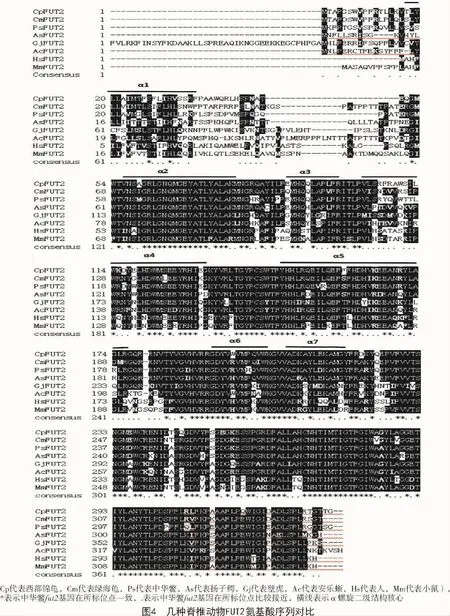
将测序结果拼接获得完整的中华鳖fut2基因,全长 1 918 bp,其中,5′非编码区(5′-UTR)380 bp,3′非编码区(3′-UTR)518 bp,开放阅读框长度为1 020 bp,编码339个氨基酸残基。分析显示,中华鳖FUT2包含FUT核心结构,属于O-FucT-like蛋白家族(图1)。
ProtParam tool分析表明,FUT2蛋白分子量为3.9 ku,理论等电点为8.99。带有负电的氨基酸残基为31个(Asp和Glu),带有正电的氨基酸残基为36个(Arg和 Lys),不稳定系数为 48.45,总平均亲水性为-0.273,脂溶指数为79.09。
采用Signal P 4.1 Server预测蛋白质序列中的信号肽的剪切位点,结果显示,中华鳖fut2基因编码的蛋白不含有信号肽。通过Target P 1.1 server进行导肽查找,结果显示,线粒体目标肽及分泌途径信号肽分别为 0.129(mTP)和 0.882(SP),预测可靠性为2,推测该序列不是定位于线粒体。使用TMHMM在线软件进行分析可知,fut2基因翻译的蛋白质结构中有1个跨膜结构,位于第13~32位氨基酸(图2)。利用SMART数据库对结构域检测分析显示,FUT2包含一个Glyco_transf_11结构域。


FUT2蛋白的二级结构主要由α螺旋和无规则卷曲组成,分别占46.90%和28.32%。同时在SWISS-MODEL网构建了中华鳖FUT2蛋白的3D模型,如图3所示。

2.2 中华鳖fut2基因的同源性分析
GenBank数据分析显示(表2),中华鳖FUT2与扬子鳄(Alligator sinensis)的相似性(87%)、一致性(81%)最高,与西部锦龟(Chrysemys picta bellii)的相似性为87%、一致性为79%,与安乐蜥(Anolis carolinensis)的相似性为86%、一致性为74%,与绿海龟(Chelonia mydas)的相似性为84%、一致性为76%,与壁虎(Gekko japonicus)的相似性为 79%、一致性为76%,与小鼠(Mus musculus)的相似性为79%、一致性为69%,与人(Homo sapiens)的相似性为76%、一致性为65%。将中华鳖的FUT2氨基酸序列与其他几种脊椎动物FUT2氨基酸序列对比得出,中华鳖FUT2氨基酸序列相对较保守(图4)。
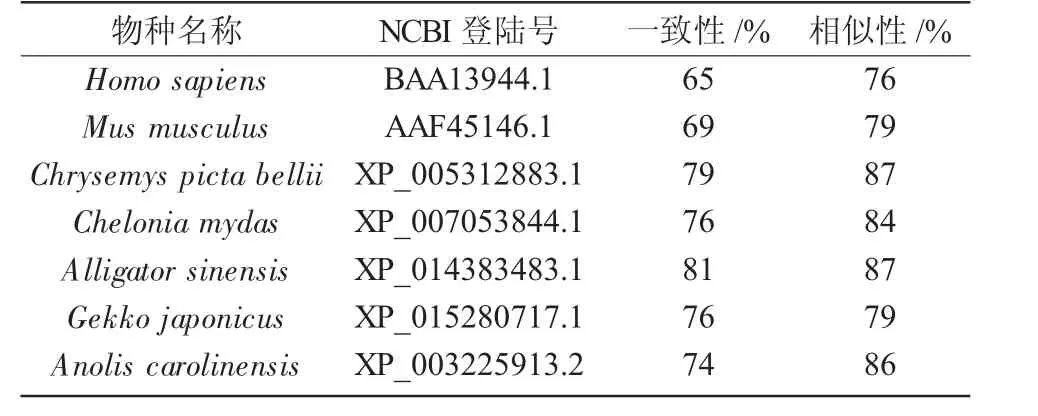
表2 中华鳖FUT2编码氨基酸与其他物种的相似性和一致性分析结果
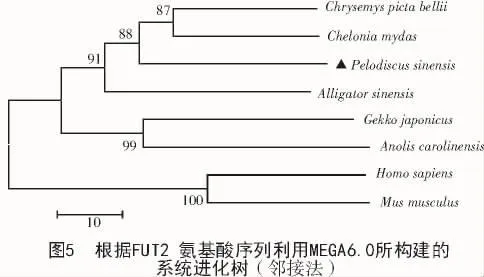
采用邻接法构建的系统进化树表明(图5),中华鳖FUT2单独聚为一支,再与西部锦龟和绿海龟聚为一支,然后与扬子鳄聚在一起,再与壁虎和安乐蜥聚在一起,它们同属于脊索动物门爬行纲,而与小鼠和人亲缘关系较远。说明中华鳖fut2基因的分子进化地位与其生物学分类大体一致。
2.3 中华鳖fut2基因的表达
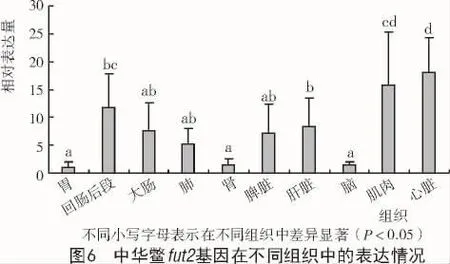
Real-time PCR结果显示,中华鳖fut2在所检测的各个组织中均有表达。其中,在心脏中表达量最高,在脑组织中表达量最低,在中华鳖脑组织中fut2的表达量显著低于回肠后段、肝脏、肌肉和心脏;在回肠后段、大肠、肺、脾脏和肝脏中表达量适中(图 6)。
3 讨论
岩藻糖基转移酶是一类己糖基转移酶,作为一种关键性酶类,在人类疾病发展中起着至关重要的作用。例如,FUT2可能会影响大肠杆菌在肠道的黏附过程[13],从而影响动物的健康。同时有研究表明,肠道上皮中岩藻糖的缺乏可以改变肠道上皮的通透性,会造成肠道菌群经肝门循环到达肝脏,造成肝脏细菌感染[14]。此外,有众多研究表明,FUT2与溃疡性结肠炎和急性肠胃炎关系密切[15-17]。
本研究利用RACE技术,首次获得了中华鳖fut2基因全长,通过对中华鳖fut2基因进行生物信息学分析发现,中华鳖FUT2蛋白属于脂溶性蛋白。对蛋白结构和信号肽进行分析后发现,中华鳖FUT2蛋白无信号肽,但存在一个跨膜结构,说明中华鳖FUT2蛋白不是分泌型蛋白,与钦伟云等[18]研究东串猪FUT2的氨基酸序列结果相似。多序列比对后发现,中华鳖fut2基因具有高保守性,系统进化分析显示,在进化过程中保守性较高,与其他物种的相似性在76%~87%,中华鳖与西部锦龟等爬行动物亲缘关系较近,与人和小鼠亲缘关系较远,表明中华鳖的fut2基因符合其进化顺序。
研究fut2基因在中华鳖组织中表达分布,有利于更好地了解fut2基因的功能。因此,本研究选择8只中华鳖分析fut2基因在其组织中的表达水平,结果发现,fut2基因在中华鳖所检测组织中都进行了表达,表明fut2基因具有广泛的组织表达特征,在中华鳖的生长过程中可能起着十分重要的作用。研究表明,fut2仅限制性表达在内胚层起源的胃肠上皮和唾液腺[19],这与fut2在中华鳖各组织中的表达模式相似。
综上所述,本研究报道了中华鳖fut2基因的分子特征,并对其组织特异性表达进行了相关研究,但由于肠道菌群结构的复杂性,具体fut2基因在中华鳖肠道微生物中的功能和调节机制等仍需进一步地深入研究。
[1] HOOPER LV,LITTMAN D R,MACPHERSON A J.Interactions between the microbiota and the immune system [J].Science,2012,336:1268-1273.
[2]SOMMER MO,DANTASG,CHURCH GM.Functional characterization of the antibiotic resistance reservoir in the human microflora[J].Science,2009,325:1128-1131.
[3] BUFIE C G,BUCCI V,STEIN R R,et al.Precision microbiome restoration of bile acid-mediated resistance to Clostridium difficile[J].Nature,2015,517:205-208.
[4]钟雷,吉红,夏耘,等.脱脂蚕蛹替代日粮中鱼粉对建鲤肠道菌群的影响[J].中国水产科学,2014,21(3):531-540.
[5]COLLINS S M,BERCIK P.The relationship between intestinal microbiota and the central nervous system in normal gastrointestinal function and disease[J].Gastroenterology,2009,136:2003-2014.
[6]COLLINSSM,SURETTE M,BERCIKP.The interplay between the intestinal microbiota and the brain[J].Nature Reviews Microbiology,2012,10:735-742.
[7]GAREAU M G,WINE E,RODRIGUES D M,et al.Bacterial infection causes stress-induced memory dysfunction in mice[J].Gut,2011,60:307-317.
[8]PAYNE D C,CURRIER R L,STAAT M A,et al.Epidemiologic association between FUT2 secretor status and severe Rotavirus Gastroenteritis in children in the United States[J].JAMA Pediatr,2015,169(11):1040-1045.
[9]WACKLINP,MAKIVUOKKOH.Secretor genotype(FUT2 gene)is strongly associated with the composition of Bifidobacteria in the human intestine[J].PloSOne,2011,6(5):e20113.
[10] CAMPI C,ESCOVICH L,MORENO A,et al.Expression of the gene encoding secretor type galactoside 2 alpha fueosyltransferase(FUT2)and ABH antigens in patients with oral lesions[J].Medicina Oral Patologia Oral Y Cirugia Bucal,2012,17(1):e63-e68.
[11]宋如昕,王兰,张左兵.中华鳖gp130基因全长cDNA克隆及生物信息学分析[J].生物技术通讯,2017,28(3):265-273.
[12] ZHANG Z B,NIU C J,STORSET A,et al.Comparison of Aeromonas salmonicida resistant and susceptible salmon families:a high immune response is beneficial for the survival against Aeromonas salmonicida challenge[J].Fish Shellfish Immunol,2011,31(1):1-9.
[13]SNOECK V,VERDONCK F,COX E,et al.Inhibition of adhesion of F18+Escherichia coli to piglet intestina1 villous enterocytes by monoclonal antibody against blood group H-2 antigen[J].Veterinary Microbiology,2004,100(3):241-246.
[14]CHAPMAN R,FEVERY J,KALLOO A,et al.Diagnosis and management of primary seleresing cholangitis[J].Hepatology,2010,51(2):660-678.
[15]MEGOVERN D P,JONES M R,TAYLOR K D.Fucosyltransferase 2(FUT2)non-secretor status is associated with Crohns disease[J].Human Molecular Genetics,2010,19(17):3468-3476.
[16] FRANKE A,MEGOVEM D P.Genome-wide meta-analysis increases to71 the number of confirmed Crohn's disease susceptibility loci[J].Nature Genetics,2010,42(12):1118-1125.
[17]CURRIER R L,PAYNE D C,STAAT M A,et al.Innate susceptibility to Norovirus infections influenced by FUT2 genotype in a U-nited States pediatric population[J].Clinical Infectious Diseases,2015,60(11):1631-1638.
[18]钦伟云,甘丽娜,赵呈祥.东串猪FUT2基因CDS扩增、序列分析及组织表达谱检测[J].中国畜牧兽医,2017,44(1):1-11.
[19]王慧,李剑平.H抗原缺陷型的研究进展 [J].中国输血杂志,2008,21(1):63-65.
