胎儿颅内出血的MRI诊断
2018-06-15周立霞寇晨光卜静英高铎李彩英耿左军
周立霞,寇晨光,卜静英,高铎,李彩英,耿左军
河北医科大学第二医院医学影像科,河北石家庄 050000;
胎儿颅内出血(fetal intracranial hemorrhage,FICH)指妊娠14周至分娩期间胎儿发生的颅内出血[1]。FICH可导致患儿出生后智力低下、癫痫、脑性瘫痪等,损伤程度与预后密切相关。及早准确地检出FICH并评估预后,对优生优育具有重要意义。胎儿MRI具有无放射性损伤、多序列、多切面成像、广阔的视野及良好的软组织对比分辨率等优点,已成为诊断胎儿疾病的重要方法[2]。本研究回顾性分析41例FICH的MRI表现,分析出血部位、范围及合并异常,并对FICH进行分级,为及时了解病情、评估预后及指导临床治疗提供借鉴。
1 资料与方法
1.1 研究对象 收集河北医科大学第二医院2014年9月-2016年12月行孕中晚期产前超声检查怀疑胎儿异常,并于3 d内进行胎儿颅脑MRI检查的FICH胎儿共41例,孕周20~40周,平均(27.4±2.7)周;孕妇年龄19~36岁,平均(26.2±2.5)岁;均为单胎妊娠,胎儿孕周均根据早孕期超声检测结果确定。
1.2 仪器与方法 采用GE Optima MR360 1.5T MR仪,8通道体部相控阵线圈。扫描序列为二维快速稳态进动序列(2D fast imaging employing steady-state acquisition,2D-FIESTA)、单次激发快速自旋回波序列(single shot fast spin echo,SSFSE)、快速反转恢复运动抑制序列(fast inversion recovery motion insensitive,T1WI-FIRM)、扩散加权成像(DWI),扫描参数见表1。MRI检查前所有孕妇签署知情同意书,孕妇取仰卧位,如不适可取左侧卧位,足先进,平静呼吸,以胎头为中心,采用以上扫描序列对胎儿脑部行标准横断面、冠状面及矢状面扫描,所有序列扫描时间不超过15 min。
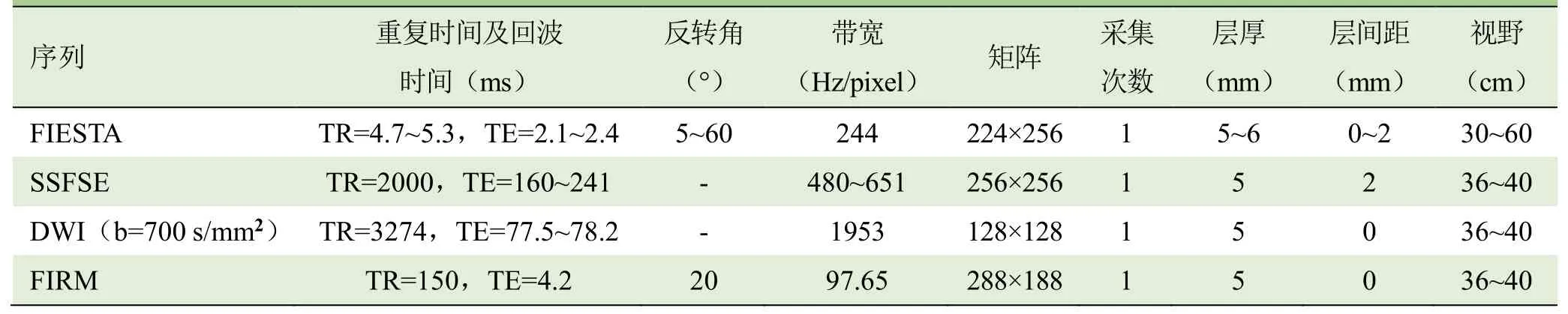
表1 胎儿颅内出血MRI扫描参数
1.3 图像分析 MRI图像由2名副主任以上医师采用盲法诊断,意见不一致时协商达成一致。颅内出血判断:超声提示颅内高回声区,于胎儿MRI检查呈短T1、短T2/长T2信号,DWI呈高信号。判断出血部位、范围、信号特征及伴随异常。
脑室周围出血(periventricular hemorrhage,PVH)/脑室内出血(intraventricular hemorrhage,IVH)参照Ghi等[3]的分级诊断标准,I级:出血限于室管膜区;II级:脑室内出血,但范围低于一侧侧脑室的50%,且不伴脑室扩张或侧脑室后角扩张<15 mm;III级:脑室内出血范围大于一侧侧脑室的50%或累及双侧脑室,脑室宽度≥15 mm;IV级:在I、II或III级出血的基础上伴脑室周围实质内大范围出血。
1.4 随访及MRI复查 对经MRI检查诊断为颅内出血的胎儿,均定期随访至引产或产后6~12个月,出生后随访内容包括患儿体重、身长、一般生长情况(体格生长及精神心理发育)等,新生儿期行新生儿行为神经测定(neonatal behavioral neurological assessment,NBNA)量表评分判断是否存在脑损伤。比较胎儿期首次发现脑出血的MRI图像及复查图像、产后MRI图像,总结FICH的MRI图像特征。
1.5 统计学方法 采用SPSS 13.0软件,对PVH/IVH分级与出生结局进行Spearman相关性检验,P<0.05表示差异有统计学意义。
2 结果
2.1 胎儿MRI检查结果
2.1.1 出血部位 多灶性脑出血23例,单灶脑出血18例。PVH/IVH 33例,出血好发部位为尾状核头与丘脑夹角处,其次为丘脑出血。包括单纯IVH 8例,生发基质出血(PVH)13例,生发基质出血破入脑室(PVH伴IVH)12例。PVH合并蛛网膜下腔出血1例,大脑半球皮层区脑实质出血3例,小脑出血2例,硬膜下出血2例。
2.1.2 MRI表现 41例FICH行MRI检查均可见颅内异常信号,其中31例为亚急性早期出血,呈短T1短T2信号,DWI为高信号;5例为亚急性晚期出血呈短T1长T2信号,局部形成软化灶;5例为慢性期血肿,呈长T1长T2信号,边界清楚,DWI呈低信号;蛛网膜下腔出血为脑表面处及部分脑沟裂内线样短T1短T2信号,脑实质形态及信号正常;硬膜下出血表现均为颅板下“新月形”短T1短T2信号,DWI呈高信号,邻近脑实质受压,中线结构移位(图1~4)。未见超急性期及急性期出血病灶。
2.1.3 伴随改变 脐带绕颈19例,其中绕颈1圈17例,绕颈2圈2例;17例胎儿伴不同程度侧脑室扩张,其中单侧8例,双侧9例;3例存在颅内血管畸形;2例伴胼胝体发育不良;2例伴小脑下蚓部发育不全;1例伴多种异常,存在动静脉畸形、侧脑室扩大、脑萎缩及胼胝体发育不良。
2.2 随访结果 41例FICH胎儿随访结果:25例选择引产,其中3例行尸检证实为血管畸形伴皮层区脑实质出血;12例未复查选择继续妊娠;4例于3~7周后复查MRI显示颅内出血灶明显缩小,其中2例完全液化,并继续妊娠。本研究中16例孕妇选择继续妊娠并出生后随访,其中1例II级PVH/IVH胎儿伴混合感染,染色体检查低风险,出生后左耳听力低下;1例II级PVH/IVH胎儿伴巨细胞病毒感染,出生1年后无法直立行走;1例IV级PVH/IVH出生后存在单侧肢体运动障碍;13例胎儿神经系统NBNA评分在正常范围。
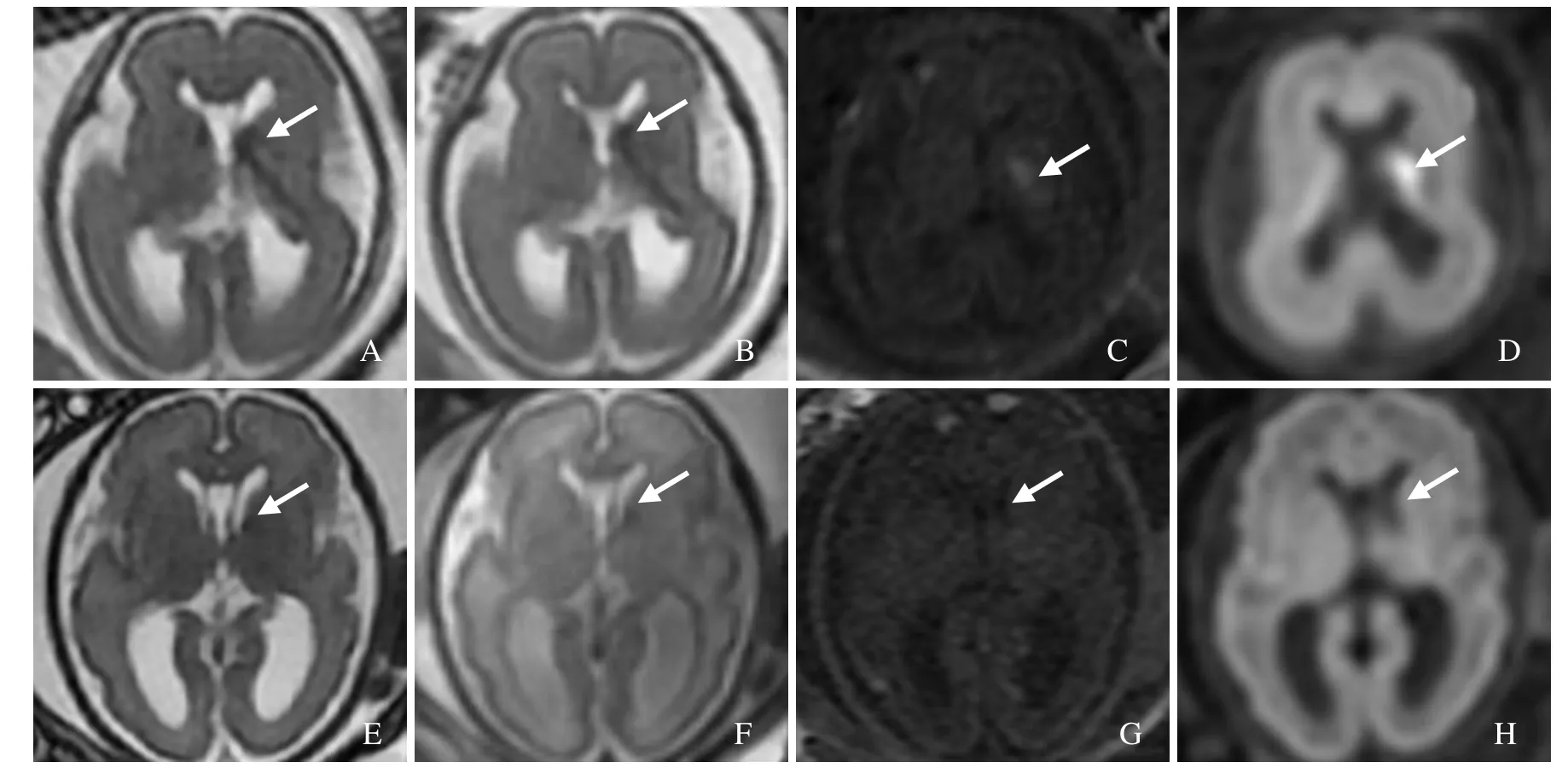
图1 孕22周胎儿,I级PVH/IVH亚急性出血早期。MRI示左侧脑室旁生发基质内出血,FIESTA序列呈略低信号(箭,A);SSFSE序列呈短T2信号(箭,B);T1WI呈高信号(箭,C);DWI呈高信号(箭,D)。孕29周复查MRI,左侧生发基质出血灶范围明显缩小(箭,E、F);T1WI信号减低(箭,G);DWI示出血区信号明显减低提示成为软化灶(箭,H)
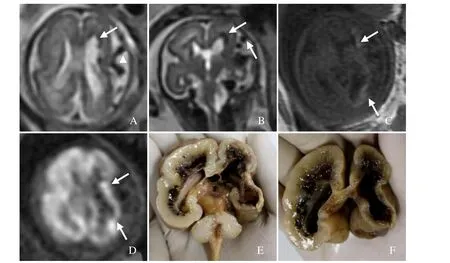
图2 孕25周胎儿,IV级PVH/IVH伴左侧大脑半球凸面血管畸形。MRI示横断面(A)及冠状面(B)两侧脑室旁多发斑点状及条带状T2WI低信号(箭),左侧大脑半球凸面见纡曲增粗的流空血管影呈T2低信号(箭头);T1WI示左侧半球内出血T1呈高信号(箭,C);DWI呈稍高信号(箭,D);尸检示两侧侧脑室旁脑实质内暗红色陈旧性出血灶,左侧大脑半球脑实质萎缩,胼胝体变薄(E、F)

图3 孕34周胎儿,IV级PVH/IVH。MRI示横断面(A)和冠状面(B)左侧侧脑室旁脑实质内出血破入脑室内,左侧丘脑软化灶形成(箭);其内出血DWI呈高信号(箭,C);出生15 d后复查MRI(D、E)及MRA(F)示左侧基底节区出血吸收好转,左丘脑软化灶较孕期增大(箭),侧脑室内仍见少量亚急性期积血;生后MRA示左侧大脑中动脉M1段管腔狭窄,管壁毛糙(箭,F)
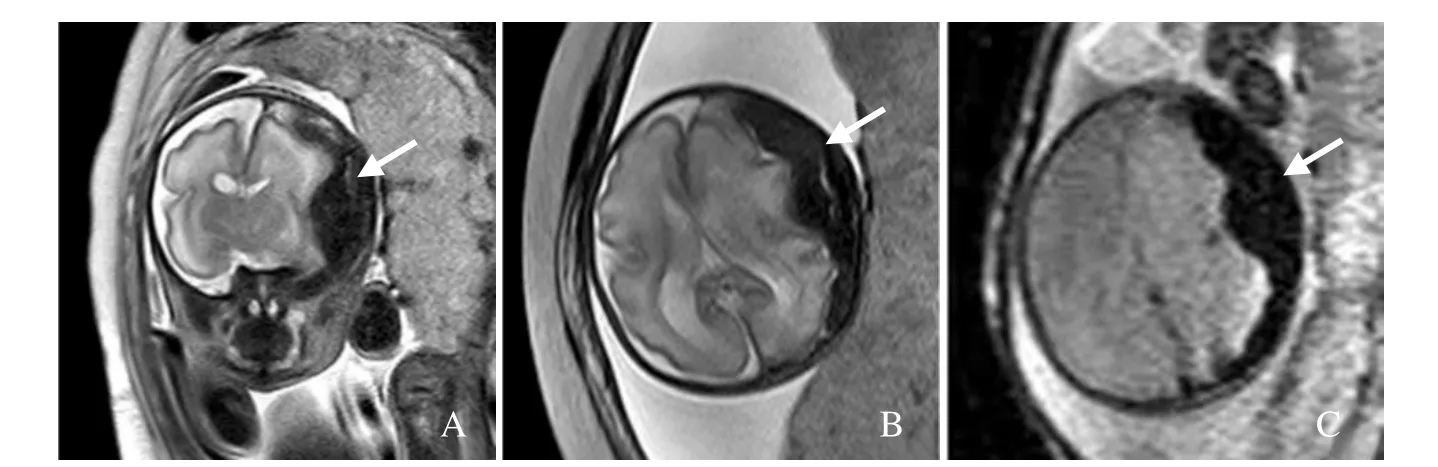
图4 孕28周胎儿,硬膜下出血。MRI示冠状面(A)、横断面(B)及DWI(b=0,C)序列左侧颅板下“新月形”T2WI低信号(箭),左侧大脑半球受压变形及中线结构移位
2.3 PVH/IVH分级与出生结局的相关性 出生胎儿随访结局与PVH/IVH分级诊断结果进行Spearman相关性检验,除出生后正常的胎儿,其余存在神经功能缺失者均认为出生预后差。PVH/IVH分级与胎儿出生结局呈正相关(r=0.689,P<0.05)。
3 讨论
3.1 FICH相关病因及机制 FICH的病因尚不明确,目前认为其发病因素主要有母体、胎儿、胎盘、脐带、羊水等异常[3]。本组41例胎儿中,19例伴有脐带绕颈,考虑由于脐带绕颈增大脐血流异常的几率,FICH可能与继发脑供血异常有关。
FICH以PVH/IVH居多。本研究中,PVH/IVH约占FICH的82.9%(34/41)。PVH/IVH的发病机制为生发基质血管密集,缺乏周细胞及纤维连接蛋白的支持,且构成血-脑屏障的星形胶质细胞终足不完整,因此比较脆弱,当脑血流量发生波动时容易出血[4-6]。Raets等[7]认为胎儿期的脑静脉壁菲薄也是主要原因之一。本研究中PVH最多见的出血部位为侧脑室前角旁尾状核与丘脑交界区,推测由于此处是胎儿期终前静脉与终静脉合流后汇入大脑内静脉的夹角部位,易受到血流冲击导致出血,胎儿期室管膜结构薄弱极易破入相邻的侧脑室。
胎儿期小脑出血多位于第四脑室顶的残余生发基质或小脑深部皮质靠近白质与新生的内颗粒层交界区,本研究结果与既往报道结果[8-9]一致。本研究中3例存在大脑半球实质内近皮层区出血,推测部分与血管畸形有关。蛛网膜下腔出血最常见的原因是先天性颅内动脉瘤,当脑实质及脑室出血穿破脑组织流入蛛网膜下腔,则为继发性蛛网膜下腔出血[10]。硬膜下出血多由于静脉或静脉窦破裂出血所致,脑静脉窦血栓、血管畸形破裂也可引起硬膜下出血[11-12]。
3.2 FICH信号特征及胎儿MRI的序列优化 FICH信号与成人相似,由于FICH较隐匿,孕妇多无明显症状及异常感觉,多在常规孕检中偶然发现。FICH超急性期及急性期时间较短(<72 h),亚急性期演变过程缓慢、持续时间相对较长,因此MRI检查发现出血多为亚急性期,亚急性早期出血呈短T1短T2信号,DWI呈高信号;亚急性晚期呈短T1长T2信号。慢性期血肿完全液化、囊变,呈长T1长T2信号,DWI呈低信号。
胎儿MRI可以敏感地检测出不同类型的出血及不同阶段的血液分解产物[13]。磁敏感加权成像(SWI)采用三维平衡快速场回波序列,检测FICH优于超声和常规MRI序列[14-15],能准确地显示出血灶范围及部位,尤其对微小出血灶检出具有明显优势。因此在诊断FICH时,SWI常作为“金标准”检查[16]。然而,由于SWI成像时间较长,加上胎儿运动及母体呼吸运动,很难获得满意的图像,一般不作为常规扫描序列。本研究中胎儿颅脑MRI扫描常规选用2D-FIESTA、SSFSE、FIRM及DWI序列。SSFSE为快速T2WI图像,对含水分多的脑组织显示较好,仅数十秒即可完成图像的采集,对胎动及孕妇呼吸伪影不敏感,同时基于多源射频发射技术和全数字影像链采集,保障了扫描速度和图像信噪比[17],亚急性期出血多为低信号或混杂稍高信号,能清楚地分辨相对更高信号的脑组织及脑脊液。FIESTA序列对于脑结构的显示较好,但其血管内血流为高信号,亚急性期出血多为略低于脑脊液信号并与脑实质信号近似,需要仔细观察才可发现;而SSFSE图像中的血管及亚急性期早期出血为低信号,与周围的脑脊液背景有明显差异。因此SSFSE在观察亚急性期出血及发现血管畸形时较FIESTA序列有明显优势[18]。FIRM为快速T1加权序列,单层采集时间≤1 s,亚急性期出血呈高信号易于发现。DWI序列在观察血肿时也有一定的优势,由于血肿内的细胞聚集造成细胞密度增高,水分子扩散受限,因此大部分为高信号。本研究认为,在胎儿MRI检查中,SSFSE、DWI及T1WI-FIRM序列联合应用是诊断FICH的最佳选择。
FICH在自然演变过程的不同阶段信号各异[19],需要与颅内多种疾病鉴别。如Galen静脉动脉瘤样畸形、颅内肿瘤出血及血栓等。Galen静脉动脉瘤样畸形部位固定,常表现为大脑中线后部扩张流空信号;血栓多发生于静脉窦内,窦汇处多见,有时可见属支静脉的扩张流空信号,较大血栓可伴近侧硬膜窦扩张;肿瘤出血大部分可观察到肿瘤实性成分,另外占位效应、瘤周水肿及短期内复查病变无明显缩小或进展等可以鉴别。慢性期出血灶的囊变、液化需与脉络丛囊肿、蛛网膜囊肿等鉴别。脉络丛囊肿绝大多数在孕27周前消失[20];蛛网膜囊肿多位于脑表面或脑池内,MRI呈脑脊液信号,复查无明显变化。
3.3 FICH分级与预后的相关性 胎儿脑内富含神经干细胞,脑实质内出血或损伤后,神经干细胞可以通过向神经元、星形胶质细胞及少突胶质细胞分化,促进神经组织再生和修复,重建受损区神经功能。如果损伤较严重,神经干细胞代偿不完全,则会影响中枢神经系统发育,导致精神发育迟缓、运动障碍、视力及听力受损、癫痫发作等后遗症。研究发现,轻度PVH/IVH并非神经发育不良的独立危险因素,I~II级胎儿PVH/IVH较无出血者神经系统预后无明显差异[21-22]。但I~II级FICH于宫内或出生后出血范围增大,进展为III级或IV级,则预后不佳。III~IV级颅内出血的胎儿宫内死亡率和出生后神经系统后遗症发生率高达80%[23-24],本研究结果发现,PVH/IVH分级与胎儿出生预后呈正相关(r=0.689,P<0.05),分级越高,预后越差。
本研究中1例II级FICH合并巨细胞病毒感染的胎儿预后不佳,出生后1年内出现运动障碍;另外1例II级FICH为混合感染合并染色体检查低风险,出生后出现听力障碍;1例IV级FICH出生后出现单侧肢体运动障碍;其余大部分胎儿无明显神经系统后遗症。因此,推测宫内感染因素或染色体异常因素导致的FICH可能与神经系统后遗症关系密切,但由于样量本较少,其相关性有待进一步证实。本研究中选择继续妊娠的孕妇总体预后较好,因此对I~II级FICH胎儿可维持母胎生理状态至胎儿娩出,期间定期复查,不建议盲目终止妊娠。由于本研究样本量较少、出生后随访时间较短,需要进一步研究以准确评价胎儿神经发育的结局。
总之,MRI检查在观察胎儿解剖结构及胎儿病理改变方面明显优于超声检查。MRI不仅可以明确诊断FICH,并可以准确定位出血部位和范围、反映其病理演化过程并进行准确分级,从而对了解病情、评估预后、指导临床干预具有重要意义。
[1] Huang YF, Chen WC, Tseng JJ, et al. Fetal intracranial hemorrhage (fetal stroke): report of four antenatally diagnosed cases and review of the literature. Taiwan J Obstet Gynecol, 2006, 45(2): 135-141.
[2] 张亚林, 罗伟, 廖荣信, 等. MRI联合超声对胎儿脑室扩张病因的诊断价值. 中国医学影像学杂志, 2016, 24(7):486-489.
[3] Ghi T, Simonazzi G, Perolo A, et al. Outcome of antenayally diagnosed intracranial hemorrhage: case series and review of the literature. Ultrasound Obstet Gynecol, 2003, 22(2): 121-130.
[4] Ballabh P, Xu H, Hu F, et al. Angiogenic inhibition reduces germinal matrix hemorrhage. Nat Med, 2007, 13(4): 477-485.
[5] Braun A, Xu H, Kocherlakota P, et al. Paucity of pericytes in germinal matrix vasculature of premature infants. J Neurosci,2007, 27(44): 12012-12024.
[6] El-Khoury N, Braun A, Hu FR, et al. Astrocyte end-feet in germinal matrix, cerebral cortex, and white matter in developing infants. Pediatr Res, 2006, 59(5): 673-679.
[7] Raets M, Dudink J, Raybaud C, et al. Brain vein disorders in newborn infants. Dev Med Child Neurol, 2015, 57(3): 229-240.
[8] Poretti A, Prayer D, Boltshauser E. Morphological spectrum of prenatal cerebellar disruptions. Eur J Paediatr Neurol,2009,13(5): 397-407.
[9] Haines KM, Wang W, Pierson CR. Cerebellar hemorrhagic injury in premature infants occurs during a vulnerable developmental period and is associated with wider neuropathology. Acta Neuropathol Commun, 2013, 1(1): 1-14.
[10] Hassan A, Ahmad B, Ahmed Z, et al. Acute subarachnoid hemorrhage. An unusual clinical presentation of cerebral venous sinus thrombosis. Neurosciences (Riyadh), 2015,20(1): 61-64.
[11] Akins PT, Axelrod YK, Ji C, et al. Cerebral venous sinus thrombosis complicated by subdural hematomas: case series and literature review. Surg Neurol Int, 2013, 4: 85.
[12] Paladini D, Sglavo G, Quarantelli M, et al. Large infratentorial subdural hemorrhage diagnosed by ultrasound and MRI in a second-trimester fetus. Ultrasound Obstet Gynecol, 2005, 26(7): 789-791.
[13] Mhabrech HE, Khalfalli A, Mazhoud I, et al. Imaging of fetal intracranial hemorrhage. Journal of Neuroradiology, 2016,43(2): 107.
[14] Bosemani T, Poretti A, Huisman TA. Susceptibilityweighted imaging in pediatric neuroimaging. J Magn Reson Imaging, 2014, 40(3): 530-544.
[15] Mody S, Yeo L, Neelavalli J, et al. Susceptibility weighted imaging of the fetal brain is superior to ultrasound and conventional MRI sequences in detecting intracranial hemorrhage. Ultrasound in Obstetrics and Gynecology, 2013,41(6): 719.
[16] Parodi A, Morana G, Severino MS, et al. Low-grade intraventricular hemorrhage: is ultrasound good enough? J Matern Fetal Neonatal Med, 2015, 28(Suppl 1): 2261-2264.
[17] Glenn OA. MR imaging of the fetal brain. Pediatr Radiol,2010, 40(1): 68-81.
[18] Ueda K, Yanagawa M, Ueguchi T, et al. Paradoxical signal pattern of mediastinal cysts on T2-weighted MR imaging: phantom and clinical study. Eur J Radiol, 2014, 83(6): 1016-1021.
[19] Manganaro L, Bernardo S, La Barbera L, et al. Role of foetal MRI in the evaluation of ischaemic-haemorrhagic lesions of the foetal brain. J Perinat Med, 2012, 40(4): 419-426.
[20] 张冬梅, 侯莉, 叶才为. 脉络丛囊肿胎儿产前超声图像分析. 中华医学超声杂志(电子版), 2015, 12(10): 812-815.
[21] Ann Wy P, Rettiganti M, Li J, et al. Impact of intraventricular hemorrhage on cognitive and behavioral outcomes at 18 years of age in low birth weight preterm infants. J Perinatol,2015, 35(7): 511-515.
[22] Payne AH, Hintz SR, Hibbs AM, et al. Neurodevelopmental outcomes of extremely low-gestational-age neonates with lowgrade periventricular-intraventricular hemorrhage. JAMA Pediatr, 2013, 167(5): 451-459.
[23] Kutuk MS, Yikilmaz A, Ozgun MT, et al. Prenatal diagnosis and postnatal outcome of fetal intracranial hemorrhage.Childs Nerv Syst, 2014, 30(3): 411-418.
[24] Sarkar S, Bhagat I, Dechert R, et al. Severe intraventricular hemorrhage in preterm infants: comparison of risk factors and short-term neonatal morbidities between grade 3 and grade 4 intraventricular hemorrhage. Am J Perinatol, 2009,26(6): 419-424.
