ADAR1通过RNA编辑上调ZNF655表达并促进人肝癌细胞系HepG2中HBV复制
2018-06-14李京源朱席琳伍晓盼
李京源, 李 涛,朱席琳,伍晓盼,刘 英
(中国医学科学院 北京协和医学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
慢性乙型肝炎病毒(hepatitis b virus,HBV)感染是全世界严峻的健康问题,大约有3.5亿人携带乙型肝炎病毒[1]。目前常用干扰素-α治疗乙肝,但是复发率较高[2]。除此之外,个体对干扰素-α的应答差异也是影响其临床用药的主要因素。干扰素-α可以诱导众多抗病毒基因蛋白,其中包括作用于RNA 的人类腺苷脱氨酶1(adenosine deaminase acting on RNA,ADAR1)。
ADAR1属于ADARs家族,是一种RNA 编辑酶,可以催化其RNA 底物上的腺苷(A) 转化为肌苷(I) ,而肌苷(I) 能被核糖体及RNA 聚合酶识别为鸟苷(G) 。因此, 在转录时能导致 RNA 碱基 A→G 的替换[3- 4]。因为密码子改变,就有可能造成基因的复制、转录、翻译、表达以及其功能发生变化[5]。本课题组前期研究发现,在HBV阳性的HepG2.2.15细胞中,ADAR1通过对线粒体抗病毒信号蛋白基因MAVS3′-UTR进行RNA编辑促进HBV表达,因此推测ADAR1可以通过对其下游基因的RNA编辑作用,对乙肝病毒的复制产生影响,故进一步探究除MAVS之外,对其他基因的编辑及作用。
1 材料与方法
1.1 试剂
1.1.1 细胞系: 人肝癌细胞系 HepG2.2.15 和Hep3B (中国医学科学院基础医学研究所细胞中心) 。
1.1.2 试剂: MEM 培养基 (中国医学科学院基础医学研究所细胞中心);胎牛血清(Gibco公司);兔抗ZNF655抗体和鼠抗 ADAR1 抗体(Abcam公司);兔抗GAPDH 抗体、羊抗鼠 IgG、羊抗兔 IgG、超纯RNA 提取试剂盒、 SYBR Green PCR Mix、2×Goldstar PCR Mix和 RIPA细胞裂解液(康为世纪生物科技有限公司);RNA 反转试剂盒(Toyobo公司);限制性内切酶NotⅠ、XbaⅠ、XhoⅠ和Lipofectamine 3000(Thermo Fisher 公司);双荧光素酶报告基因检测试剂盒(Promega公司);Western blot 发光液(上海天能科技有限公司);ELISA试剂盒(北京万泰生物药业股份有限公司)。
1.2 方法
1.2.1 细胞培养及转染: 将细胞培养于 MEM培养基中(含10%胎牛血清),37 ℃、 5% CO2培养箱中培养; 当细胞汇合度达到90%时,用胰蛋白酶适度消化,800 r/min离心5 min,传代。转染前1 d以合适的密度将细胞接种于24孔板中,待细胞汇合度达到70%~80%时,按照 LipofectamineTM3000说明书进行转染。
1.2.2 RT-qPCR:根据超纯RNA提取试剂盒说明书操作步骤提取细胞总RNA后反转录得到cDNA。设置20 μL qPCR体系:SYBR Green Mix 10 μL,H2O 7 μL,cDNA 1 μL,上下游引物各1 μL。引物序列为: ADAR1上游引物5′-GTCGTCAGCTTGGGAACA-3′,下游引物5′-CGCAGTCTGGGAGTTGTA-3′;ZNF655上游引物5′-AGGACACCGACATGGAACAG-3′,下游引物5′-CAGGAACTTGGGTAATATCG-3′;GAPDH上游引物5′-TCTGACTTCAACAGCGACAC-3′,下游引物5′-CAAATTCGTTGTCATACCAG-3′;HBV 3.5 kb RNA上游引物5′-GAGTGTGGATTCGCACTCC-3′,下游引物5′-GAGGCGAGGGAGTTCTTCT-3′;HBV total RNA上游引物5′-TCACCAGCACCATGCAAC-3′,下游引物5′-AAGCCACCCAAGGCACAG-3′。
1.2.3 质粒构建:ADAR1过表达质粒为实验室构建并保存质粒;ZNF655过表达质粒构建方法为利用PCR将ZNF65基因CDS序列5′端加上Kozak序列、酶切位点和保护碱基,随后插入到经NotⅠ和XbaⅠ双酶切回收的p3x-FLAG-CMV- 14克隆载体中,4 ℃过夜连接,转化。后挑取菌落提取质粒进行测序鉴定。ZNF655双荧光素酶报告基因质粒构建过程为将ZNF655 3′UTR中包含编辑位点区域克隆到pimR-RB-REPORT载体中,酶切位点为XhoⅠ和NotⅠ。克隆ZNF655 CDS序列引物为: 上游引物5′-AAGGAAAAAAGCGGCCGCGCCACCATGGAGGAA ATACCAGGC-3′,下游引物5′-GCTCTAGATGAGTTC TCTTTGGTATGAATGCTC-3′。克隆3′UTR片段引物为:上游引物5′-CCGCTCGAGGCTGTCTTGTGTGC ATCCAC-3′,下游引物5′-AAGGAAAAAAGCGGCC GCCCCAGGTTCAAGCAGTTCTC-3′。
1.2.4 双荧光素酶报告基因检测实验:通过检测海肾荧光素酶活性的相对变化情况,鉴定位点的编辑变化对基因是否有表达调控作用。HepG2和Hep3B细胞系中都分别在转染ZNF655-A质粒和ZNF655-G质粒48 h后,收集细胞裂解液,按照双荧光素酶报告基因检测试剂盒说明书要求操作。利用Promega GloMax 96微孔板发光检测仪读取数值,计算荧光素酶相对活性=海肾荧光素酶活性/萤火虫荧光素酶活性。
1.2.5 Western blot检测蛋白表达: 转染48 h后收集细胞,用预冷的PBS洗2遍,加入RIPA裂解液(含蛋白酶抑制剂)冰上摇20 min以充分裂解细胞,8 000 r/min离心10 min收集上清,加入上样缓冲剂煮沸10 min变性。采用12% SDS-PAGE分离蛋白后进行转膜,5% 的脱脂奶粉TBST 溶液封闭1 h,加入抗ADAR1(1∶1 000)、ZNF655(1∶1 000)和GAPDH(1∶20 000)的抗体,4 ℃孵育过夜,TBST缓冲液冲洗3遍后,二抗(1∶10 000)室温孵育2 h,再用TBST缓冲液冲洗3遍后,加入发光液显影。
1.2.6 ELISA检测:转染72 h后收集细胞上清,按照ELISA说明书步骤进行操作,最后用酶标检测仪检测A450数值。
1.3 统计学分析
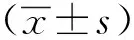
2 结果
2.1 ZNF655基因3′UTR存在ADAR1 RNA编辑位点
HepG2细胞中ZNF655(zinc finger protein 655)基因3′UTR上的chr7:99575277位点存在RNA编辑现象,在DNA水平上纯合型,而在RNA水平上为杂合型(图1A)。在HepG2.2.15细胞中过表达ADAR1后发现,ZNF655 chr7:99575277位点G的比例明显高于FLAG对照组(图1B)。
2.2 双荧光素酶报告基因实验检测ZNF655基因3′UTR 不同编辑位点对表达活性的影响
在HepG2.2.15细胞中,ZNF655 3′UTR中 G编辑位点比正常 A 位点的荧光素酶活性显著升高(P<0.001)(图2A),同样的实验也在 Hep3B 细胞中进行,得到一致的结论(P<0.01)(图2B)。
A.sanger sequencing in the level of DNA and RNA in HepG2;B.sanger sequencing in the level of RNA in HepG2.2.15; the arrows point to edited sites
图1ZNF6553′UTR测序结果
Fig1SangersequencingresultsofZNF6553′UTR

A.HepG2.2.15; B.Hep 3B;*P<0.01,**P<0.001 compared with ZNF655-A group图2 ZNF655 3′UTR双荧光素酶活性Fig 2 Luciferase activity of ZNF655
2.3 ADAR1对 ZNF655基因mRNA及蛋白水平表达的作用
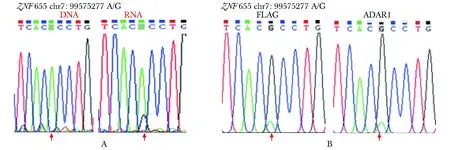
验证ADAR1质粒在HepG2.2.15 细胞内 mRNA和蛋白水平有效过表达后,检测其对ZNF655表达的影响,发现过表达ADAR1组相对FLAG对照组mRNA上升了约30% (P<0.01) (图 3A) ,另外在蛋白水平也显著升高(图3B)。

A.quantitative RT-qPCR analysis of ADAR1 and ZNF655 mRNA;**P<0.01 compared with FLAG-control group;B.Western blot analysis of ADAR1 and ZNF655 protein expression; *P<0.05 compared with FLAG-control group图3 在mRNA和蛋白水平检测ADAR1和ZNF655的表达Fig 3 ADAR1 and ZNF655 expression at the mRNA
2.4 ELISA检测ZNF655对乙肝病毒表面抗原及e抗原的影响
在HepG2.2.15细胞中,ZNF655有效过表达(图4A),并且与FLAG对照组相比,过表达组中乙肝病毒表面抗原(HBsAg)显著上升了29.1% (P<0.05),e抗原(HBeAg)上升了47.3%(P<0.001)。细胞内部HBV 3.5kb RNA上升了22%(P<0.05),HBV total RNA 上升了14.9%(P<0.01)(图4B)。
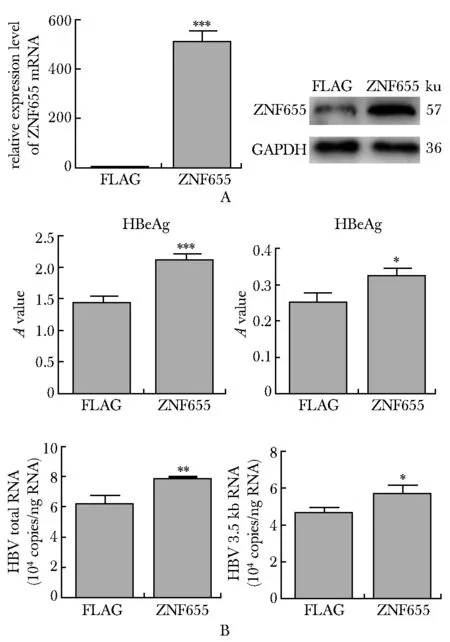
A.RT-qPCR and Western blot demonstrated the overexpression of ZNF655;B.expression of HBV markers concluding HBsAg,HBeAg,HBV total RNA and HBV 3.5 kb RNA;*P<0.05,**P<0.01 ,***P<0. 001 compared with FLAG-control group图4 ZNF655对HBV标志物的影响Fig 4 Effect of ZNF655 on the HBV markers
3 讨论
特异性作用于RNA的腺苷脱氨酶家族包括ADAR1,ADAR2和ADAR3三种[6],其中ADAR1是表达丰度最高的。目前已有报道ADAR1介导的RNA编辑在丙型肝炎及丁型肝炎中起着重要的作用[7- 8],而对乙型肝炎的感染作用尚未见文献报道。RNA编辑作用可以发生于编码区和非编码区,非编码区的改变可以影响基因的表达水平和稳定性等。本研究中ZNF655 3′UTR中碱基的改变可能导致原来能够与之结合并发挥调控作用的小RNA或者RNA结合蛋白不能顺利结合,从而产生影响。
ZNF655属于锌指蛋白,锌指蛋白是指含有通过结合Zn2+形成稳定的短的可以自我折叠形成“手指”结构的一类蛋白质,对基因调控起重要的作用,在免疫调控方面也有所涉及[9],但其对HBV的复制表达影响并未见报道。
综上,本研究中 ADAR1 通过对下游基因ZNF655的 3′UTR上的位点进行RNA编辑, 使发生碱基A→G的替换,从而上调了ZNF655的表达水平,而ZNF655具有促进病毒复制的作用,实现ADAR1通过RNA编辑活性调控HBV表达的通路,为HBV治疗提供新的基于ADAR1及其下游基因的策略。
参考文献:
[1] WHO,in Guidelines for the prevention,care and treatment of persons with chronic hepatitis B infection[M].Geneva, 2015.
[2] Saracco G, Rizzetto DM. A practical guide to the use of interferons in the management of hepatitis virus infections[J]. Drugs, 1997, 53:74- 85.
[3] Wang Q, Li X, Qi R,etal. RNA editing, ADAR1, and the innate immune response[J]. Genes, 2017, 8:41.doi:10.3390/genes 8010041.
[4] George CX, Gan Z, Liu Y,etal. Adenosine deaminases acting on RNA, RNA editing, and interferon action[J]. J Interferon Cytokine Res, 2011, 31:99- 117.
[5] George CX, John L, Samuel CE. An RNA editor, adenosine deaminase acting on double-stranded RNA (ADAR1)[J]. J Interferon Cytokine Res, 2014, 34:437- 446.
[6] Savva YA, Rieder LE, Reenan RA. The ADAR protein family[J]. Genome Biol, 2012, 13:1- 10.
[7] Jayan GC, Casey JL. Effects of conserved RNA secondary structures on hepatitis delta virus genotype I RNA editing, replication, and virus production[J]. J Virol, 2005, 79:11187- 11193.
[8] Taylor DR, Puig M, Darnell ME,etal. New antiviral pathway that mediates hepatitis C virus replicon interferon sensitivity through ADAR1.[J]. J Virol, 2005, 79:6291- 6298.
[9] 赵楠, 赵飞, 李玉花. 锌指蛋白结构及功能研究进展[J]. 生物技术通讯, 2009, 20:131- 134.
新闻点击
多吃苹果可降低患癌风险
据英国《BBC新闻》(BBCNEWS)2016- 10- 03报道,根据一项研究,每天至少吃一个苹果的人比那些很少吃或从来不吃苹果的人更不容易患肺癌、结肠癌、口腔癌、食道癌或乳腺癌。
意大利佩鲁贾大学( University of Perugia)的专家们总结过去超过40项的研究数据时发现吃苹果对预防肿瘤风险的好处,尤其是对胃癌和食道癌的功效最大,能减少近一半的肿瘤风险。爱吃苹果的人患肺癌的概率减少25%,而患乳腺癌的概率也降低20%。
虽然,民众知道选择健康饮食,多食用蔬果蔬可以帮助预防多种类型的癌,但很少有证据来证明食用哪一种蔬果最有益。
研究人员对世界上食用最广泛的水果之一的苹果进行了研究,汇集了40多个不同研究饮食和癌的数据。该研究结果发表在《公共健康营养》。
数据显示越爱吃苹果的人患癌几率越低。研究人员说:“这是因为苹果含有特殊的化学成分和潜在的分子机制,所以比其他类型的水果或蔬菜更能降低患癌的几率。”研究者们对苹果含有的丰富的植物化学物质很感兴趣,并认为这种天然的植物性物质具有强效的抗癌性。
科学家们据此得出结论,苹果是预防癌最有力的武器之一。他们在报告中说:“研究有力的证明了苹果对肺、肠、口腔、食道和乳腺具有防护能力。但至于其对其他部位的效用还需要更多的研究来证明。”
苹果也含高量抗氧化剂黄酮类化合物,这种化合物被认为可降低癌和心脏疾病的发病率。
