丰富环境对食管癌患者围术期心理状况及认知功能影响
2018-06-14朱富祖白毅平莫利群
朱富祖,白毅平,莫利群
(西南医科大学附属医院 麻醉科,四川 泸州 646000)
食管癌患者因长期进食困难、营养不良、癌症恐惧、家庭及经济等因素产生焦虑抑郁的心理应激反应。焦虑抑郁可影响神经、免疫及内分泌等功能,甚至造成术后认知功能障碍(postoperative cognitive dysfunction, POCD)[1]。POCD是老年患者术后常见并发症之一[2-3],而食管癌POCD发生率为5%~15%[4-5]。POCD可导致患者康复延迟、并发症增多、住院天数及医疗费用增加,甚至可能增加死亡率[6]。既往研究报道[7-8],通过药物干预、缩短手术时间、减少出血及维持血流动力学稳定等方式可预防患者POCD发生。认知训练是丰富环境的一种方式,有研究显示,认知训练在老年相关的认知改变上有积极的作用[9-10]。同时动物实验也证明,丰富环境可改善大鼠POCD[11-12],若食管癌患者通过丰富环境,能有效改善患者POCD,对患者转归起到积极作用,同时也可降低医疗护理成本费,有效预防POCD。
1 资料与方法
1.1 一般资料
选取2015年6月-2016年6月该院行食管癌手术患者80例。其中,男性54例,女性26例;年龄20~65岁;美国麻醉医师协会(american society of anesthesiologists, ASA)Ⅰ、Ⅱ级。排除标准:①患有中枢神经系统和心理疾病;②术前长期服用镇静剂、抗抑郁药、帕金森病、酗酒及药物依赖;③有严重的听力或视力障碍、文盲及有沟通障碍者。
1.2 方法
患者入院时即采用随机数字表法分为丰富环境组和对照组,每组各40例。丰富环境组入院后即接受心理辅助治疗(包括心理疏导和认知训练[9]),持续到评估结束。治疗师通过说服劝导、合理宣泄及放松调节方式,对患者进行心理疏导。治疗师耐心倾听患者疾病的相关知识、治疗态度、日常活动、饮食习惯、经济及家庭成员关系状况等情况。再根据个体情况,改变其因认知偏差而导致情绪困扰或行为异常,帮助纠正错误认知,恢复理性思考,改善情绪和行为。认知训练每天进行1次,持续到评估完毕(内容包括声音、图形、颜色、字词辨认、动作模仿学习、时间空间定位及自身体表定位训练)。根据患者具体情况反复朗读书籍和难度,逐渐加强拼图游戏。同时结合患者的文化程度、爱好及欣赏水平,给予不同的音乐旋律,进行30 min音乐疗法。对照组进行常规处理,无心里辅助治疗。数据采集人员不同于治疗师,采取盲法对两组患者于入院时术前1天、术后第3、7天应用焦虑自评量表(self-rating anxiety scale, SAS)和抑郁自评量表(self-rating depression scale, SDS)评估焦虑抑郁状态,于术前1天和术后第7 d进行神经精神功能测验并抽取外周静脉血3 ml,采用酶联免疫吸附测定法测定白细胞介素6(interleukin 6, IL-6)、白细胞介素8(interleukin 8, IL-8)及肿瘤坏死因子α(tumor necrosis factor α, TNF-α)。
1.3 工具
使用ZUNG氏SAS和SDS[13],该表不受年龄、性别及经济状况等因素影响。SDS≥53分即存在抑郁,SAS≥50分即存在焦虑。神经精神功能测验,共7个测验项目:①韦氏成人记忆量表中的累加(注意力,分数高功能好);②视觉再生(视觉记忆,分数高功能好);③联想学习(语言记忆,分数高功能好);④数字广度(分顺向和逆向两部分,注意力集中程度,分数高功能好);⑤韦氏成人智力量表(修订)中的数字符号测验(精神运动速度,分数高功能好);⑥联想测验(注意力转移和精神运动速度,分数低功能好);⑦钉板测验(分利手和非利手两部分,精神运动速度,分数低功能好)。POCD判定[14]:患者以其本人术前值为对照,术后评分等于或超过术前值的1个标准差就判定该项测验出现功能恶化;若≥2个的测验项目恶化则判定该患者发生POCD。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,两独立样本比较采用t检验或χ2检验;SAS和SDS采用重复测量设计的方差分析;IL-6、IL-8及TNF-α采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般情况比较
两组一般情况比较,差异无统计学意义。见表1。
2.2 两组SAS和SDS比较
两组入院时的SAS高于全国常模。两组SAS比较,采用重复测量设计的方差分析,结果:①不同时间的SAS有差异(F=126.659,P=0.000);②两组的SAS有差异(F=37.473,P=0.000);③两组的SAS变化趋势有差异(F=40.163,P=0.000)。两组SDS比较,采用重复测量设计的方差分析,结果:①不同时间的SDS有差异(F=82.618,P=0.000);②两组的SDS有差异(F=29.994,P=0.000);③两组的SDS变化趋势有差异(F=7.202,P=0.000)。丰富环境组SAS术前1天、术后第3、7天低于入院时评分(P<0.05);SDS术后第3、7天低于入院时评分(P<0.05)。与对照组比较,其SAS术前1 d、术后第3、7天均降低(P<0.05);其 SDS术后7 d降低(P<0.05);术后3、7 d,其SDS与常模比较,差异无统计学意义(P>0.05)。见表2。
2.3 两组术后POCD比较
两组术后POCD比较,差异有统计学意义(χ2=2.051,P=0.045)。丰富环境组术后POCD低于对照组。见表3。
2.4 两组患者术后第7天与基础值比较
两组术后第7天与术前炎症介质比较,差异有统计学意义(t=12.944,P=0.001)。其 IL-6、IL-8及TNF-α均增高;对照组的IL-6和TNF-α比丰富环境组相对更高。见表4。

表1 两组一般情况比较 (n =40)
表2 两组SAS和SDS比较 (±s)

表2 两组SAS和SDS比较 (±s)
注:1)与常模比较,P <0.05;2)与对照组比较,P <0.05;3)组内与入院时比较,P <0.05
SAS/(分,±s)入院 术前1天 术后第3天 术后第7天丰富环境组 40 54.8±9.41) 42.8±9.21)2)3) 40.7±8.81)2)3) 41.8±9.31)2)3)对照组 40 55.5±10.61) 54.7±10.31) 51.3±10.41) 49.9±8.61)常模 1 388 29.8±10.1 29.8±10.1 29.8±10.1 29.8±10.1组别 例数SDS/(分,±s)入院 术前1天 术后第3天 术后第7天丰富环境组 52.2±11.51) 47.3±9.31) 44.1±8.43) 40.7±8.42)3)对照组 51.2±10.21) 51.3±10.21) 48.4±8.41) 47.7±9.91)常模 41.9±10.6 41.9±10.6 41.9±10.6 41.9±10.6组别
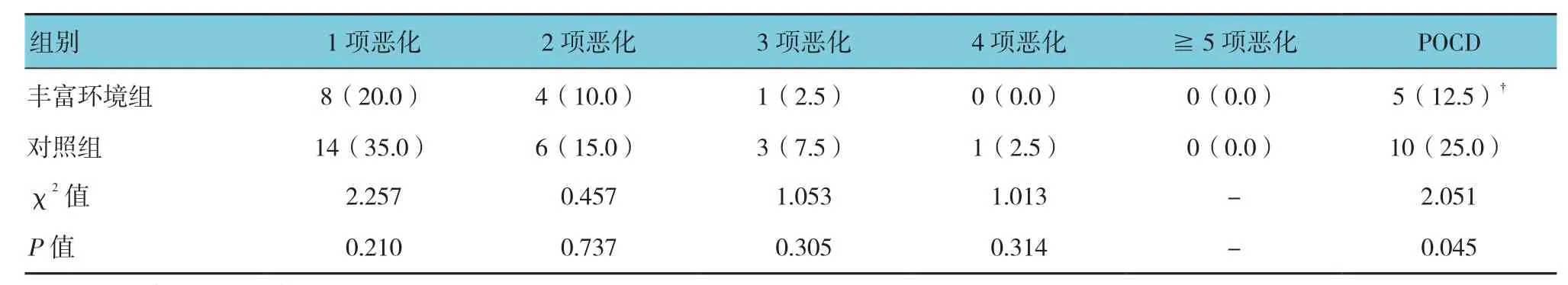
表3 两组术后神经精神功能变化比较 [n =40,例(%)]

表4 患者术后第7天与术前炎症介质比较
3 讨论
食管癌患者除身体遭受巨大伤害外,其还因对癌症的恐惧产生巨大心理压力,造成患者对他人依赖性增强和猜疑心加重[15],加上患者社会、家庭及经济等因素产生以焦虑、抑郁为代表的心理应激反应[16]。有研究表明,严重持久的焦虑会因精力过度消耗而对个体造成威胁,抑郁则会影响人体中枢神经系统、内分泌系统及免疫系统功能,从而降低机体的防御功能[17]。本实验拟通过心理辅导和认知训练,观察其对食管癌术后POCD的影响。
本研究发现,食管癌患者术前存在焦虑、抑郁,少部分患者因接受抗抑郁治疗而排除试验。对焦虑、抑郁原因进行综合调查后发现:多数患者表现为对死亡恐惧;治疗前景灰心;部分因素为造成家庭经济负担;部分因素为对手术麻醉不了解;极少数因素为对自己社会政治地位的绝望。实验结果显示,患者采用丰富环境方案后,可减轻围手术期焦虑、抑郁情绪,这与治疗师了解患者焦虑、抑郁原因后,增强和患者沟通密切有关。丰富环境方案虽然不能解决患者对死亡的极度恐惧感,但提高患者对治疗前景的信心,能减轻患者内心的孤独与无助感。同时患者家庭成员的配合度与患者的遵从医生行为,能减轻患者焦虑、抑郁的程度。
既往研究发现,围术期患者的焦虑、抑郁会使机体免疫系统紊乱从而导致POCD[17]。本研究也有类似结果,神经精神测验功能恶化比较发现,丰富环境组焦虑、抑郁及POCD发生率都相对更低。可能与治疗师的认知训练有关。KAWANO等[18]发现,认知训练可通过保护脑源性神经营养因子表达,减少患者因手术引起的学习记忆和神经功能减退,从而改善术后POCD。本研究中还发现,术后第7天,POCD发生率更低的丰富环境组炎症因子相对更低,和近期研究结果相同[19],并且其研究还提出IL-6、IL-8及TNF-α可作为术后POCD高危的预测因子。本研究中,丰富环境组如何导致炎症因子降低,目前还未发现相关的资料,可能与患者焦虑抑郁的减轻及认知训练对免疫系统的作用,最终引起炎症因子的改变有关,但有待于进一步研究。
既往POCD的防治都是通过药物干预、加强术中管理等方式[5],仅通过心理疏导和认知训练的丰富环境方案改善POCD的文献少有报道,目前已有动物实验显示,丰富环境方案有效[18,20],但临床研究有待于进一步多中心加大样本量的研究。同时如能有一套完善的手术医生、麻醉医生及护士联合的规范化防治方案,更能有效推进术后POCD的防治。
综上所述,本实验中认知训练时间仅局限于围术期,但对于患者而言[21],如果平时有更多的认知训练(阅读、跳舞、学习乐器、语言及玩精神刺激的游戏),建立认知功能储备,相信对老年患者认知功能改善会起到积极的作用。
[1]YOO I, WOO J M, LEE S H, et al. Influence of anxiety symptoms on improvement of neurocognitive functions in patients with major depressive disorder: a 12-week, multicenter, randomized trial of tianeptine versus escitalopram, the CAMPION study[J]. Journal of Affective Disorders, 2015, 185: 24-30.
[2]DEINER S, SILVERSTEIN J H. Postoperative delirium and cognitive dysfunction[J]. British Journal of Anaesthesia, 2009,(1031): i41-i46.
[3]曹学照, 房特, 马虹, 等. 笑气对早期术后认知功能障碍发生率的影响[J]. 中国现代医学杂志, 2010, 20(12): 1901-1903.
[4]YONEKURA H, HIRATE H, SOBUE K. Incidence, risk factors,and effects on outcome of postoperative delirium in patients undergoing esophagectomy[J]. Masui. the Japanese Journal of Anesthesiology, 2015, 64(6): 597-602.
[5]姜徽, 李元海, 周磊, 等. 不同镇痛方法对老年食管癌患者术后疼痛及早期认知功能的影响[J]. 临床麻醉学杂志, 2016, 32(5):472-475.
[6]STEINMETZ J, CHRISTENSEN K B, LUND T, et al. Longterm consequences of postoperative cognitive dysfunction[J].Anesthesiology, 2009, 110(3): 548-555.
[7]WANG W, WANG Y, WU H, et al. Postoperative cognitive dysfunction: current developments in mechanism and prevention[J]. Med Sci Monit, 2014(20): 1908.
[8]杨记名. 高龄髋部骨折手术患者术后认知功能障碍的临床分析[J]. 中国现代医学杂志, 2014, 24(7): 92-94.
[9]WOODS B, AGUIRRE E, SPECTOR A E, et al. Cognitive stimulation to improve cognitive function ing in people with dementia[J]. Cochrane Database Syst Rev, 2012(2): CD5562.
[10]BLONDELL S J, HAMMERSLEY-MATHER R, VEERMAN J L. Does physical activity prevent cognitive decline and dementia:a systematic review and meta-analysis of longitudinal studies[J].BMC Public Health, 2014, 14(1): 510.
[11]KAWANO T L, EGUCHI S, IWATA H, et al. Impact of preoperative environmental enrichment on prevention of development of cognitive impairment following abdominal surgery in a rat model[J]. Anesthesiology, 2015, 123(1): 160-170.
[12]DEGOS V, FLOOD P. Are epigenetic changes the key to the elusive mechanism for the long-lasting effects of anesthetic drugs that persist after emergence[J]. Anesthesiology, 2016, 124(3):530-531.
[13]LANGDON K D, CORBETT D. Improved working memory following novel combinations of physical and cognitive activity[J]. Neurorehabil Neural Repair, 2012, 26(5): 523-532.
[14]王多友. 术后谵妄与认知功能障碍[J]. 大连医科大学学报,2013, 35(5): 409-415.
[15]WANG M S, EVANS C T, RODRIGUEZ T, et al. Clos tridium difficile infection and limitations of markers for severity in patients with hematologic maligna[J]. Infect Control Hosp Epidemiol, 2013, 34(2): 127-132.
[16]ESTEGHAMAT S S, MOGHADDAMI S, ESTEGHAMAT S S,et al. The course of anxiety and depression in surgical and nonsurgical patients[J]. Int J Psychiatry Clin Pract, 2014, 18(1): 16-20.
[17]HOVENS I B, SCHOEMAKER R G, VAN DER ZEE E A,et al. Postoperative cognitive dysfunction: involvement of neuroinflammation and neuronal functioning[J]. Brain, Behavior,and Immunity, 2014, 38(5): 202-210.
[18]KAWANO T, EGUCHI S, IWATA H, et al. Impact of preoperative environmental enrichment on prevention of development of cognitive impairment following abdominal surgery in a rat model[J]. Anesthesiology, 2015, 123(1): 160-170.
[19]KLINE R, WONG E, HAILE M, et al. Peri-operative inflammatory cytokines in plasma of the elderly correlate in prospective study with postoperative changes in cognitive test scores[J]. Int J anesthesia Res, 2016, 4(8): 313.
[20]FAN D, LI J, ZHENG B, et al. Enriched environment attenuates surgery-induced impairment of learning, memory, and neurogenesis possibly by preserving BDNF expression[J]. Mol Neurobiol, 2016, 53(1): 344-354.
[21]RUDOLPH J L, SCHREIBER K A, CULLEY D J, et al.Measurement of post-operative cognitive dysfunction after cardiac surgery: a systematic review[J]. Acta Anaesthesiol Scand, 2010,54(6): 663-677.
