两种检测HAV-IgM试剂的敏感性评价
2018-06-14张海莹王震宇孔祥沙季颖朱凌魏来
张海莹,王震宇,孔祥沙,季颖,朱凌,魏来
[北京大学人民医院 北京大学肝病研究所(丙型肝炎和肝病免疫治疗北京市重点实验室),北京 100044]
甲型肝炎病毒(hepatitis A virus, HAV)感染及所导致的疾病成为我国严重的社会公共卫生问题[1]。我国属于甲型肝炎的高发区,HAV感染可导致肝衰竭甚至死亡[2]。人感染HAV后多表现为亚临床症状,检测性能好的HAV诊断试剂,对HAV的防治尤为重要。HAV实验室检测主要包括HAV-IgM和HAV-IgG两种抗体。HAV-IgG阳性表明患者既往感染过HAV,HAV-IgM是用于诊断HAV新近感染的血清学标志[3]。近年来HAV检测试剂已得到广泛应用,但关于不同HAV-IgM检测试剂的敏感性如何?目前相关研究较少。为加强HAV抗体实验室检测的质量控制,确保检测结果的准确性,以及为甲肝抗体人群血清流行病学调查选择试剂提供参考,本文旨在全面评价国内市场上应用较广的2种HAV-IgM检测试剂,并探讨其原因。
1 资料与方法
1.1 一般资料
选取2015年5月-2017年6月该院就诊的疑似急性HAV感染门诊和住院患者血清样本196例。其中,男性108例,女性88例;年龄11~84岁,中位43岁。患者均转氨酶异常升高或伴有黄疸,且均排除乙型、丙型、丁型及戊型肝炎病毒感染。
1.2 试剂与仪器
HAV-IgM检测甲型肝炎病毒IgM抗体检测试剂盒[化学发光微粒子免疫检测法(chemiluminesent microparticle immuno assay, CMIA),批号:72366LI00、配套仪器为ARCHITECT i2000SR,美国雅培公司,S/CO为0.00~0.79]。当S/CO≤0.79,仪器报告结果判为阴性;S/CO为0.80~1.20是HAV-IgM试剂检测灰区;当S/CO≥1.21,仪器报告结果判为阳性。万泰甲型肝炎病毒IgM抗体检测试剂盒[酶联免疫法(enzyme-linked immunosorbent assay, ELISA)],批号:AM20170609,北京万泰生物药业股份有限公司,检测波长450 nm,阳性对照吸光度值(optical delnsity, OD)平均值≥0.80,阴性对照OD值平均值≤0.10,样本临界值(Cut-off)=阴性对照孔OD均值×2.1,凡样本OD值>Cut-off值为阳性。北京高达甲型肝炎病毒IgM抗体检测试剂盒(ELISA),批号:201707006,北京现代高达生物技术有限责任公司,检测波长450 nm,阳性对照OD值平均值≥1.00,阴性对照OD值平均值≤0.10,Cut-off=0.7116,凡样本OD值>Cut-off值为阳性。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,两组间数据比较采用独立样本t检验,相关性检验采用Spearman相关分析,一致性检验采用Kappa检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 两种HAV-IgM敏感性和特异性
雅培HAV-IgM阳性35例,万泰HAV-IgM阳性58例,高达HAV-IgM阳性48例。以雅培HAV-IgM检测试剂为金标准,万泰和高达HAV-IgM的敏感性、特异性。见表1。
万泰、高达试剂与雅培检测HAV-IgM有检测结
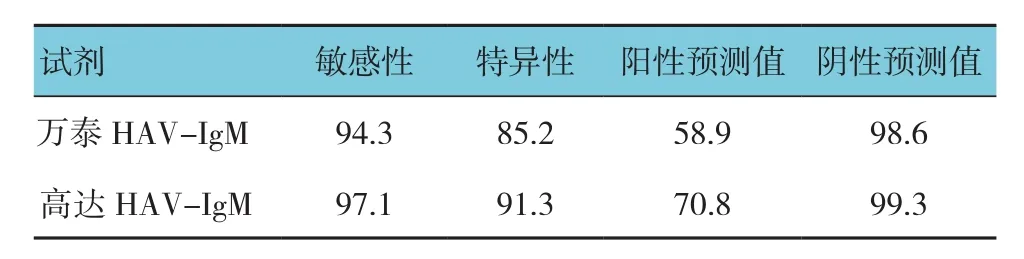
表1 两种HAV-IgM试剂检测性能分析 %
果不一致的标本,其中1例雅培HAV-IgM阳性但其S/CO值较低(1.30~1.47),万泰和高达HAV-IgM均阴性;1例雅培HAV-IgM阳性,高达HAV-IgM阳性,万泰HAV-IgM阴性;4例雅培HAV-IgM灰区(0.80~1.20),万泰HAV-IgM阳性但S/CO值较低(0.50~1.10),高达HAV-IgM阳性但S/CO值较低(0.80~1.10);5例雅培HAV-IgM阴性,万泰HAVIgM阳性,其中4例S/CO值较低(均>1.00),高达HAV-IgM阳性但S/CO值为弱阳性(0.75~1.00);14例雅培HAV-IgM阴性,高达HAV-IgM阴性,万泰HAV-IgM阳性。
2.2 两种HAV-IgM S/CO值相关性
万泰和雅培试剂检测HAV-IgMS/CO值相关(r=0.597,P=0.000);高达和雅培试剂检测HAVIgMS/CO 值相关(r=0.541,P=0.000)。见图1、2。

图1 万泰和雅培试剂检测HAV-IgM S/CO值相关性

图2 高达和雅培试剂检测HAV-IgM S/CO值相关性比较
2.3 两种HAV-IgM检测试剂一致性比较
Kappa系数解释如下,<0.00:没有一致性;0.00~0.19:极低的一致性;0.20~0.39:一般的一致性;0.40~0.59:中等的一致性;0.60~0.79:高度的一致性;0.80~1.00:几乎完全一致。万泰HAV-IgM检测试剂与雅培HAV-IgM试剂高度一致(K=0.648,P=0.000);高达HAV-IgM检测试剂与雅培HAV-IgM检测试剂高度一致(K=0.772,P=0.000)。见表2。
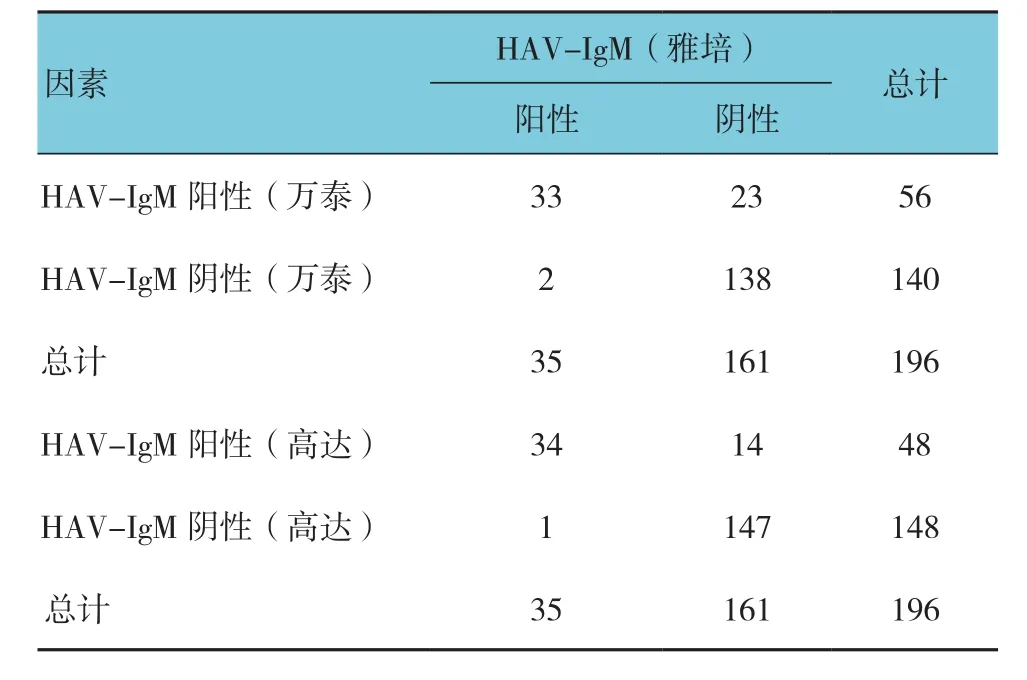
表2 两种HAV-IgM试剂一致性比较
3 讨论
甲型肝炎是世界范围内最常见的急性病毒性肝炎[4],为许多国家严重的公共卫生问题之一[5]。它主要经粪-口途径传播,通过污染水源、食物及食具等广泛流行[6-10],也可通过器官移植传播[11]。甲型肝炎的实验室诊断主要包括ELISA、CMIA及电化学发光免疫分析法(electro chemi luminescence immuno assay,ECLIA)检测血清中HAV-IgM。雅培全自动化学发光免疫分析仪利用化学发光原理结合免疫技术进行检测,具有敏感性好、特异性高及受干扰小的特点,与其他电化学发光免疫分析法有相关性,在临床检验中有广泛的应用,是公认的临床检测HAV-IgM金标准[12-14]。
本研究发现,高达试剂的敏感性、特异性均高于万泰试剂,高达试剂和万泰试剂均有较高的阴性预测值。研究还发现万泰、高达试剂与雅培HAV-IgM试剂S/CO值均有相关性;万泰、高达试剂与雅培试剂均有高度的一致性。说明两种试剂均有很好的诊断性和可靠性,为临床检测试剂的选择提供更多的依据。国内外研究对临床常用的甲型肝炎检测方法进行比较,黄妩姣等[15]比较瑞士罗氏公司的ECLIA方法和上海科华生物工程股份有限公司的ELISA方法检测HAV-IgM,发现两种检测结果的一致性较低。该研究使用ECLIA方法不同于笔者研究的雅培CMIA方法以及ELISA。HYEWON等[12]比较雅培CMIA、罗氏ECLIA及德国西门子公司的ADVIA Centaur全自动化学发光免疫分析系统检测HAV-IgM,发现3种方法有高度的一致性,对16例检测不一致的结果,雅培试剂显示灰区,其他两种方法均为阴性。
两种试剂盒在检测IgM低水平患者标本时,出现结果不一致的情况,不排除有假阳性或假阴性的可能,是临床检测、临床诊断及人群血清流行病学调查时选择检测试剂需注意的问题。黄妩姣等[15]研究发现,ELISA法检验敏感性高,但易出假阳性,罗氏ECLIA特异性好,检测结果更符合临床。本研究发现,虽然两种检测HAV-IgM试剂有不一致结果,但两种试剂检测的S/CO值有相关性。但HYEWON等[12]比较雅培CMIA、罗氏ECLIA及西门子ADVIA Centaur检测HAV-IgM的S/CO值有相关性。
万泰、高达试剂均采用ELISA法检测HAV-IgM。ELISA法检测HAV-IgM假阳性的主要原因:①类风湿因子,自身免疫性疾病及肾衰竭等的干扰,都可导致HAV-IgM假阳性[16-17];②标本性状的影响,标本溶血、乳糜血或分离血清不彻底而使血清中含有纤维蛋白原影响检测结果引起假阳性。为降低检测假阳性率,可增大标本离心转速(3 000 r/min),延长标本离心时间,使抗凝血标本得以彻底离心分离。ELISA法洗板机洗板时,保证洗板针无纤维蛋白或异物堵塞,将洗液注满各反应孔,防止产生假阳性[18]。
综上所述,国内常用的两种HAV-IgM检测试剂盒有很好的检测性和一致性,可在临床实验室广泛应用,为HAV诊断提供有力的支持,防止甲型肝炎流行。但在部分IgM水平较低的患者中,两种抗体检测试剂会存在不一致的结果,对这一部分结果还有待进一步研究,应是临床检测、临床诊断及人群血清流行病学调查时选择参考试剂需要注意的问题。进一步研发HAV-IgM的定量试剂有助于诊断不典型的HAV感染及移植后的HAV再激活。
[1]宁桂军, 程萱芹, 陈园生, 等. 贵州省旱灾期间一起甲型病毒性肝炎爆发的流行病学调查[J]. 中国疫苗和免疫, 2013, 19(5):435-438.
[2]BOSE M, BOSE S, SAIKIA A, et al. Molecular epidemiology of hepatitis A virus infection in Northeast India[J]. J Med Virol, 2015,87(7): 1218-1224.
[3]BARZAGA B N. Hepatitis A shifting epidemiology in South-East Asia and China[J]. Vaccine, 2000, 18(Suppl 1): S61-S64.
[4]FRANCO E, MELELEO C, SERINO L, et al. Hepatitis A:epidemiology and prevention in developing countries[J]. World J Hepatol, 2012, 4(3): 68-73.
[5]LIMA L R, DE ALMEIDAl A J, TOURINHO RDOS S, et al.Evidence of hepatitis A virus person-to-person transmission in household outbreaks[J]. PLoS One, 2014, 9(7): e102925.
[6]NEFFATTI H, LEBRAUD P, HOTTELET C, et al. Southern Tunisia: A still high endemicity area for hepatitis A[J]. PLoS One,2017, 12(4): e0175887.
[7]SEVERI E, VENNEMA H, TAKKINEN J, et al. Hepatitis A outbreaks[J]. Lancet Infect Dis, 2015, 15(6): 632-634.
[8]CHI H, HAAGSMA E B, RIEZEBOS-BRILMAN A, et al. Hepatitis A related acute liver failure by consumption of contaminated food[J]. J Clin Virol, 2014, 61(3): 456-458.
[9]SHIN E, KIM J S, OH K H, et al. A waterborne outbreak involving hepatitis A virus genotype IA at a residential facility in the Republic of Korea in 2015[J]. J Clin Virol, 2017, 94: 63-66.
[10]MESSENS W, FERNANDEZ-ESCAMEZ P S, LEES D, et al.Thermal processing of live bivalve molluscs for controlling viruses:on the need for a risk-based design[J]. Crit Rev Food Sci Nutr, 2017, 19: 1-12.
[11]FOSTER M A, WEIL L M, JIN S, et al. Transmission of hepatitis A virus through combined liver-small intestine-pancreas transplantation[J]. Emerg Infect Dis, 2017, 23(4): 590-596.
[12]PARK H, LEE Y J, SEONG M W, et al. Comparison of 3 automated immunoassays for detection of anti-hepatitis A virus immunoglobulin M in a tertiary care hospital[J]. Ann Lab Med,2013, 33(2): 121-124.
[13]马红霞, 杨蔺. MODULAR ANALYTICS E170全自动免疫分析仪精密度验证情况分析[J]. 国际检验医学杂志, 2012, 33(4):476-478.
[14]周文亭, 王锋, 尹文娇, 等. 国产甲型肝炎病毒总抗体检测试剂的评价[J]. 中国疫苗和免疫, 2013, 19(3): 240-245.
[15]黄妩姣, 薛元霞, 杨佩桦, 等. 电化学发光免疫分析和酶联免疫吸附试验检测甲型肝炎病毒IgM抗体的比较[J]. 现代医院,2016, 16(3): 383-385.
[16]张海军. 类风湿因子对酶联免疫法检测HBsAg的影响[J]. 内蒙古医学杂志, 2013, 45(3): 295-297.
[17]MYLONAKIS E, PALIOU M, LALLY M, et al. Laboratory testing for infection with the human immunodeficiency virus:established and novel approaches[J]. Am J Med, 2000, 109(7):568-576.
[18]吴玉红. ELSIA法检测HBsAg出现假阳性的原因探讨[J]. 中国现代医生, 2010, 48(19): 81-82.
