125I对涎腺腺样囊性癌移植瘤中MMP-2和VEGF的表达影响*
2018-06-14白忠诚汤楚华付崇建
朱 栩 白忠诚 汤楚华 付崇建
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)在早期即可发生局部侵袭且远处转移率较高,是恶性度较高的口腔颌面部肿瘤[1]。临床治疗主要是手术扩大切除,术后局部放射治疗。125I粒子植入机体组织内放射较外放疗具有明显优势[2],在涎腺腺样囊性癌的治疗中,已被普遍应用并具有显著的疗效[3-4]。癌细胞侵袭和转移关键在于细胞外基质及基底膜的分解,金属基质蛋白酶 -2(matrixmetallop roteinases-2,MMP-2)[5-6]几乎能降解所有的细胞外基质。毛细血管新生为肿瘤提供营养和癌细胞远处移动提供血行性通道[7]。血管内皮生长因子(vascular endothelial grow th factor,VEGF)是目前已知的血管生成最重要的调节因子。本实验使用免疫组化SP法测定MMP-2和VEGF在125I放射粒子照射组和对照组中的表达水平,为125I粒子用于临床治疗涎腺腺样囊性癌提供实验依据。
1.材料与方法
1.1 标本来源 石蜡标本制备方法为:将ACC-2细胞株(由济南军区总医院实验室提供)进行体外培养、传代、收集后,注射到8只裸鼠右腋下皮下,3×107/0.1ml,待瘤体长至10±2mm时,将裸鼠随机分为2组(4只/每组),照射组4只裸鼠移植瘤中央植入0.7mci的125I粒子1颗(半衰期60.1d,放射活度0.7mCi2.58×107Bq,上海欣科医药有限公司),对照组4只裸鼠移植瘤内植入同等大小和材质的不含125I的金属钛管1颗,4周后处死裸鼠,无菌条件下取出瘤体自中央切开后放入4%多聚甲醛,制做石蜡标本。
1.2 试剂与方法 MMP-2、VEGF鼠抗人单克隆抗体(美国SANTA CRUZ公司)浓度均为1∶200,S-P免疫组化试剂盒(北京中衫公司)。实验对照:阴性对照用PBS代替一抗,已知阳性表达组织(乳腺癌、口腔鳞癌)为MMP-2、VEGF作阳性对照。
将标本进行连续切片,厚度3μm,每20张取4张。免疫组织化学链霉菌抗生物素蛋白过氧化酶法(SP二步法)按试剂盒说明操作。
1.3 判断标准 使用高、低倍镜挑选肿瘤细胞较丰富且坏死少的视野。MMP-2表达产物主要分布于细胞浆,胞浆中出现棕色或棕黄色颗粒为阳性;VEGF表达产物主要分布胞膜,胞膜中见棕色或棕黄色颗粒为阳性。高倍镜下各选30个不同的肿瘤细胞野使用Image j软件对每个野计阳性细胞数并计算阳性细胞百分比,再求其标准差。按shimizu[8]评分标准进行半定量积分判断结果:无明显阳性细胞为(-),阳性细胞百分率在1%-25%为(+)、26%-50%为(++)、51%-75%为(+++)、76%-100%为(++++)。
1.4 统计学方法 采用SPSS17.0统计软件进行统计学分析。全部实验数据均用(平均值士标准差)表示,用t检验行两组之间样本均数的比较,P<0.01为差别有统计学意义。
2.结果
2.1 MMP-2免疫组织化学染色 MMP-2主要表达在SACC瘤细胞的胞浆中,胞浆中出现棕色或棕黄色颗粒为阳性。MMP-2在对照组(图1)呈强阳性表达,在照射组(图2)呈阴性和弱阳性表达。照射组(图2)中,在距粒子较近侧细胞内MMP-2多数呈现阴性表达,随肿瘤细胞与粒子距离逐渐变远,MMP-2表达逐渐增强。
在照射组中癌瘤边缘处MMP-2表达呈强阳性(图2箭头所示)。实验发现癌细胞浸润骨骼肌及在神经周围浸润的现象,MMP-2在神经周围的癌组织中表达明显强于远离神经处(见图3,其中箭头所指为神经)。对照组中肿瘤侵袭骨骼肌处MMP-2的表达明显强于远离骨骼肌处(见图4)。

图2 照射组弱阳性400×SP
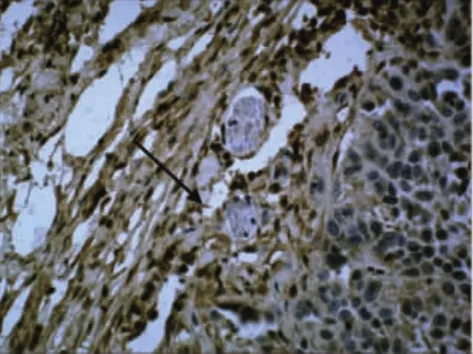
图3 神经周围强阳性表达(对照组)400×SP

图4 瘤细胞侵袭肌肉处强阳性表达(对照组)400×SP
在照射组和对照组中分别随机取30个视野,用Iamge j软件计数MMP-2阳性细胞数并计算阳性细胞百分比,按shimizu评分标准进行半定量积分判断结果。MMP-2在照射组阳性细胞百分比为:(22.07±3.6)%,t值为:33.66;显著低于对照组阳性细胞百分比:(59.53±8.11)%,t值为:40.22,P<0.01差异有统计学意义。

表1 MMP-2在SACC裸鼠移植瘤中的表达(均数±标准差,n=30视野)
2.2 VEGF免疫组织化学染色 VEGF在SACC中主要表达于瘤细胞的胞膜中,胞膜中呈现棕色或棕黄色颗粒为阳性。VEGF在照射组(见图5)主要呈阴性或弱阳性,表达明显弱于对照组,在照射组中随与粒子距离增大,VEGF表达逐渐增强。VEGF在对照组中(见图6)主要呈强阳性表达,越靠近癌瘤浸润的前缘VEGF的表达越强。
对照组肿瘤组织中的血管内皮细胞内VEGF强阳性表达(图7,箭头所示),周围呈弱阳性或阴性。对照组肿瘤边缘可见瘤体包绕神经(图8,箭头所示)且包绕神经处VEGF强阳性表达,与周围组织对比明显。
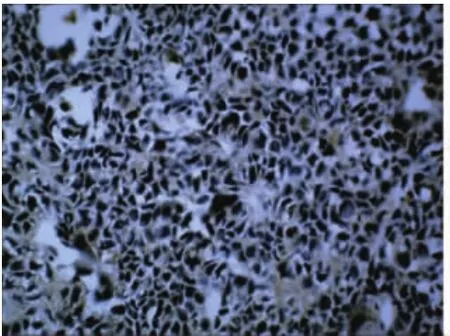
图5 照射组弱阳性400×SP
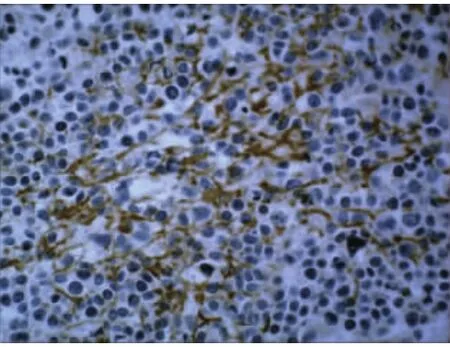
图6 对照组强阳性400×SP
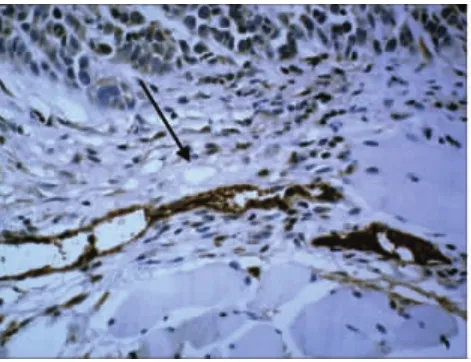
图7 血管内皮细胞处阳性表达(对照组)400×SP
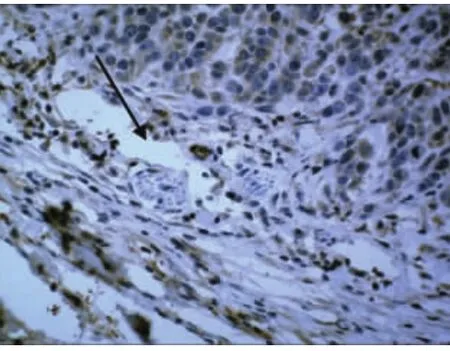
图8 在肿瘤边缘瘤细胞嗜神经(对照组)400×SP
在照射组和对照组中分别随机取30个视野,用Iamgej软件计数VEGF阳性细胞数并计算阳性细胞百分比,按shimizu评分标准进行半定量积分判断结果。VEGF在照射组阳性细胞百分比:(24.3±3.02)%,t值为:44.09;显著低于对照组阳性细胞百分比:(63.07±5.72)%,t值为:60.42,差别有统计学意义为P<0.01。

表2 VEGF在SACC裸鼠移植瘤中的表达(均数±标准差,n=30视野)
3.讨论
最近研究[5]认为,在癌症的发展中癌细胞与基质间相互作用发挥主要影响,可使癌细胞完成对周围组织的局部浸润、促使瘤体内血管新生为癌细胞生长提供营养和转移创造通道。MMP-2几乎能降解所有的细胞基质和促进血管生成及生长[9]。瘤体内血管新生提供营养是癌细胞能继续生长的基础和首要前提,血管新生也可能是癌细胞侵袭转移最主要的影响因子。VEGF是目前已知与血管生成最重要的因子。
通过实验可以发现MMP-2在照射组阳性细胞百分比为:(22.07±3.6)%,t值为:33.66;显著低于对照组:(59.53±8.11)%,t值为:40.22,P<0.01差异有统计学意义。这说明125I放射粒子可以显著抑制肿瘤中MMP-2的表达。在实验中我们发现MMP-2在肿瘤侵蚀骨骼肌处的细胞中表达呈强阳性,这符合在肿瘤侵袭时MMP-2通过溶解细胞基质建立细胞间通道促使肿瘤局部侵袭。此外在肿瘤边缘处的MMP-2表达要明显高于远边缘处,说明涎腺腺样囊性癌是一种极具侵袭性的肿瘤,这也提示,在临床病理HE染色较难判定肿瘤边界的情况下,通过MMP-2免疫组化可以帮助明确肿瘤的边界。研究中还发现,神经组织周围的MMP-2阳性率要显著高于其他组织。这与黄圣运[10]报道的MMP-2与神经侵犯有一定相关性。MMP-2在肿瘤细胞中分泌量大,其在神经周围的强阳性表达,说明在神经周围的癌细胞有较强的活性,这与SACC极强嗜神经性相符合。MMP-2在癌细胞中分泌增高,其在肿瘤组织的表达显著高于正常结构,组织中其分泌增多代表癌细胞数目多,肿瘤生长越旺盛,瘤细胞对周围组织的侵袭能力亦更强[11-12],大量研究表明其活性和表达的增多与多种肿瘤的侵袭和转移及患者预后密切相关,被认为是肿瘤侵袭的特异性指标。
在实验中发现,VEGF在照射组阳性细胞百分比:(24.3±3.02)%,t值为:44.09;显著低于对照组:(63.07±5.72)%,t值为:60.42,P<0.01差异有统计学意义,这说明125I粒子可以显著抑制肿瘤细胞中VEGF的表达。在肿瘤浸润的前缘VEGF呈现强阳性表达,这说明肿瘤前缘的癌细胞生长较旺盛,具有强侵袭性,符合其诱导内皮细胞迁移,降解细胞外基质及基底膜,促进肿瘤浸润作用的特性,同时也说明肿瘤前缘的细胞更易生成血管,提供营养向周围浸润,为远处转移提供血行性通道,这与吴巍[13]等研究结果相一致。在瘤体组织的血管内皮细胞中,VEGF强阳性表现,这符合其高特异性血管内皮分裂原特性[14],说明VEGF可促进血管内皮细胞的增值、血管新生、肿瘤生长和远处转移[15]。此外,在实验中还发现裸鼠移植瘤中有神经出现,这可能与VEGF介导血管生长对维持神经系统发育和功能有关,也可能与VEGF和血管上的nrp1相互作用、正反馈调节,形成血管和神经相伴行,为神经生长提供营养和氧支持有关[16],也可能是因为SACC癌细胞具有神经内分泌性,通过BDNF/Trk B系统促使血管内皮细胞生长,使得VEGF表达增强。具体的相关机制是未来要解决的问题及下一步实验的研究方向。
此外,本实验中发现相同组织或相近组织中(如肿瘤侵袭浸润前缘,肿瘤嗜骨骼肌处)VEGF和MMP-2都呈现高表达,考虑可能是因为VEGF是促进MMPS分泌最具活性的因子之一,特别是对于MMP-2的分泌;同时,MMP-2能水解血管基底膜胶原蛋白,进而突破细胞基底膜,这是恶性肿瘤发生侵袭的最为关键的步骤。单纯从两种蛋白同时升高尚不能说明两者的相关性。如果要证实两者的相关性,可从分子生物学角度上探究是否有共同信号通路,在基础实验中增加MMP-2、VEGF双抗免疫组化实验等相关实验,再下结论较为合理,这也将是课题组下一步研究方向。
综上所述,125I粒子可能通过抑制MMP-2、VEGF在SACC细胞中的表达,进而抑制涎腺腺样囊性癌侵袭、转移。这为125I放射粒子治疗涎腺腺样囊性癌的有效性奠定了初步的理论基础。
[1]Hata K,Yamamoto Y,Kiyomatsu T,et al.Hereditary gastrointestinal cancer[J].Surgery Today,2015:1-8
[2] Zhang J,Zheng L,Liu SM,et al.Brachytherapy for recurrent malignant tumoursof theparotid gland[J].British Journal of Oral&Maxillofacial Surgery,2015,53(1):58-62
[3] 付尚志,张佳节.125I粒子植入在肿瘤治疗中的应用[J].临床军医杂志,2014,42(5):517-519
[4] 姚 秀,顾 玲,刘 颖,等.125I放射粒子植入治疗颌面部性恶性肿瘤43例疗效分析[J].实用口腔医学杂志,2016,32(2):220-224
[5] Puente X S,Sánchez L M,Overall C M,et al.Human and mouseproteases:a comparativegenomic approach[J].Nature Reviews Genetics,2003,4(7):544-58
[6]Gong Y,Chippadavenkata U D,Oh W K.Roles of matrix metalloproteinases and their natural inhibitors in prostate cancer progression[J].Cancers,2014,6(3):1298
[7] Sun H,Guo D,Su Y,et al.Hyperplasia of Pericytes Is One of the Main Characteristics of Microvascular Architecture in Malignant Glioma[J].PloSone,2014,9(12):e114246
[8]Shimizu M,Saitoh Y,Itoh H.Immunohistochemical staining of Ha-ras oncogene product in normal,benign,and malignant human pancreatic tissues[J].Human Pathology,1990,21(6):607-612
[9] Pytliak M,Vargová V,Mechírová V.Matrix Metalloproteinasesand Their Rolein Oncogenesis:A Review[J].Onkologie,2012,35(1-2):49-53
[10]黄圣运,周晓清,贾珊珊,等.涎腺腺样囊性癌中RECK、MMP-2的表达及与临床预后的关系[J].临床口腔医学杂志,2015,31(2):91-94
[11]仲肖静,颜丽丽.子宫内膜腺癌中MMP-2、MMP-9表达的免疫组化研究[J].中国医学创新,2014(9):48-50
[12]陈 翔,吴曙辉,陆宝华,等.MMP-2、MMP-9在老年结直肠癌中的表达及与其临床病理特征的关系[J].实用癌症杂志,2015(12):1779-1781
[13]吴 巍,姚欣欣,刘境华,等.VEGF与ILK在SACC中的表达及相关性研究[J].北华大学学报(自然),2015(1):47-50
[14]孙凤琳,王晓峰.VEGF及其相关调节因子促涎腺腺样囊性癌侵袭转移的研究进展[J].口腔医学研究,2014(4):371-374
[15]Sun H,Guo D,Su Y,et al.Hyperplasia of Pericytes Is One of the Main Characteristics of Microvascular Architecture in Malignant Glioma[J].PloSone,2014,9(12):e114246
[16]温 实,黄丽娟.血管内皮细胞相关的VEGF信号通路[J].兵团医学,2015,44(2):61-65
