血浆miRNA-486-5p作为口腔鳞癌复发标志物的临床研究
2018-06-14王璇闫妍高山孙正
王璇 闫妍 高山 孙正
口腔癌是全球范围内高发的恶性肿瘤,其发病率位居恶性肿瘤第六位,口腔癌中90%为鳞状细胞癌,预后差、易复发、具有明确的癌前损害[1-3]。目前缺少客观的、有效的、微创的监测手段。MicroRNA(miRNA)是一类内生的、长度约为20-24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用[4,5]。MiRNA表达谱有肿瘤特异性及组织特异性,在口腔癌前病损、鳞癌组织及肿瘤细胞内均可检测到某些异常表达的miRNA。在各种体液中,如血浆、血清、尿液和唾液等,无细胞miRNA可以作为癌症的微创诊断和预后生物标志物[6]。本研究拟采用高通量测序方法对口腔鳞癌患者术前1周内及术后一年血浆miRNA表达水平进行研究,筛选出能够反应肿瘤复发状况的miRNA;并采用qRT-PCR对筛选出的指标进行验证,以期发现能够反应肿瘤复发的生物标记物。
1.材料与方法
1.1 病例选择 选择外科病房口腔鳞癌患者28例,其中男19例,女9例,年龄44-90岁,平均64.32岁。门诊招募健康对照者21例,男6例,女15例,年龄37-73岁,平均54.05岁。纳入标准:(1)临床及病理诊断口腔鳞状细胞癌的患者纳入实验组,口腔健康者纳入对照组;(2)年龄18-90岁,无免疫系统疾病及HIV感染;(3)未经激光,放射线或化学等治疗。排除标准:(1)年龄18岁以下或90岁以上者;(2)妊娠或哺乳期妇女;(3)有严重心、肺、肝、肾等系统性疾病者;(4)其他肿瘤、精神病患者;(5)有免疫系统疾病或HIV感染者;(6)已经激光,放射线或化学等治疗。所有受试者知情同意。其中,有8例在术后一年随访时有肿瘤复发,20例术后一年无复发。
1.2 标本采集及处理 所有受试者均空腹用EDTA抗凝采血管采取静脉血5ml,口腔鳞癌患者术前(PB)一周内及术后(PA)一年复查时采集两次,健康对照者(PH)采集一次。4℃离心,3000转/分,离心5min,取上清于EP管中冻存于-80℃。
1.3 目标miRNA筛选 取8例鳞癌(术后1年复查无复发)术前及术后血浆样本和3例健康对照组血浆样本5μl用Illumina公司的Illumina TruSeq Small RNA Sample Prep Kit构建小RNA文库,使用2100 Bioanalyzer High Sensitivity DNA chip(Agilent)对纯化的cDNA文库进行确证及定量,并使用KAPA Library Quantification Kit(KAPA biosystems)进行浓度定量。使用Illumina HiSeq 2000对cDNA文库进行测序(由北京基因组研究所完成)。测序结果使用FASTX-Toolkit去除低质量读段后使用Bowtie与人miRNA、其他小RNA(piRNA、tRNA、snRNA、snoRNA及Y RNA)、长链RNA(r RNA、lincRNA、R fam及mRNA)及人类口腔微生物组成分进行比对,并对表达量高的前100种miRNAs进行主成分分析,对miRNA表达量标准化后筛选出在口腔鳞癌术前、后及健康对照组之间存在明显表达差异的miRNAs。某miRNA标准化表达=(该miRNA计数/所有miRNAs计数)×106。
1.4 血浆miR-486-5p的qRT-PCR验证 取剩余20例鳞癌(其中12例术后一年无复发,8例术后一年复发,复发者手术前取血浆)术前及术后复查时血浆样本和18例健康对照组血浆样本各200μl进行 PCR验证。首先加入 60μl的 TRIzol LS Reagent试剂提取血浆RNA,并加入1.5μl spikein(Qiagen),使用cDNA Synthesis kit II(Exiqon)进行反转录,将所得的cDNA样品加入到含有miRNA-486-5p引物的Pick-&-Mix microRNA PCR Panels(Exiqon)。将准备好的PCR板置于Realtime PCR仪上进行PCR反应。所有的指标均设置3次重复,并按以下程序进行:95℃10min;共40个PCR循环(95℃10s,60℃60s,荧光检测1次)。miRNA-486-5p表达值根据内参进行标准化。某miRNA相对表达量=2-⊿CT(⊿CT=CTsample-CTspike-in)。
1.5 GO分析 利用DAVID在线工具[7]对miR-486-5p靶基因进行GO分析,获知其参与的生物学过程。
1.6 统计处理 如方差齐性,术前与术后结果进行配对t检验,术前与健康组、术后与健康组均进行成组t检验,如方差不齐,则采用秩和检验。根据观察期内肿瘤有无复发将口腔鳞癌病例分为复发组和无复发组,并将两组分别进行组内和组间比较。以双尾α=0.05为检验水准,P<0.05为差异具有统计学意义。
2.结果
2.1 高通量测序结果 在去除低质量读段及连接体序列后,清晰读段的产量平均为5.15×106(范围从2.83×106到8.47×106)(见表1)。所有样本的长度分布分析显示:在我们预期的20-24nt处出现峰值,该长度符合miRNAs的大小。除此之外,在27nt及31-33nt处也出现了峰值(如图1A)。对所有样本的注释分析显示:40%的清晰读段被注释为人类小RNA,35%符合Y RNAs片段,约9%符合mRNA(见图1B)。在我们的测序数据中Y RNA片段主要来源于可与人类基因组GRCh37/hg19染色体3:156,871,337-156,871,429配对的Y4的5′末端,这些片段使得长度分布在27nt及31-33nt处出现了波峰宽度增加(见图1A)。
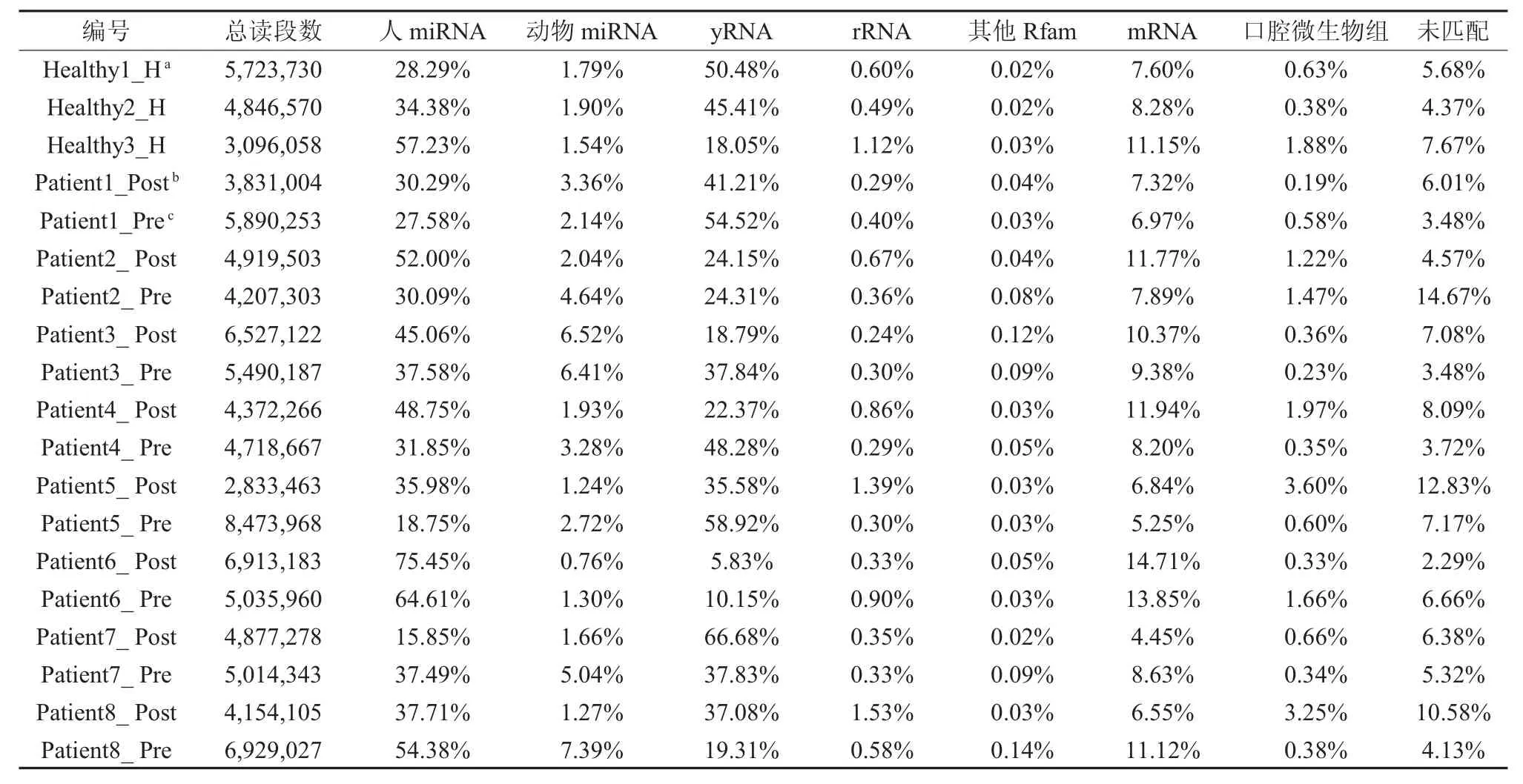
表1 血浆样本测序数据分析注释

图1 血浆小RNAs高通量测序结果长度分布及注释分析
所有样本的比对及注释分析显示:在本研究的三组样本(PB、PA、PH)中,比对出已知的人类miRNAs分别为1156,1066及810种,其中大部分(745种)miRNAs在三组样本中均有出现,而分别有161,81及11种为每组中特异性出现的,且均为低表达量(RPM<50),提示我们这些小RNA具有有限的生物学意义。因此,我们选取的目标小RNA为在所有标本中均有表达者,按照表达量由高到低进行排序,前10种见表2。MiRNA-486-5p表达量最高,占所有miRNAs读段的39.6%(PH组为53.0%,PA组为44.8%,PB组为21.3%),且存在差异性表达(表3)。
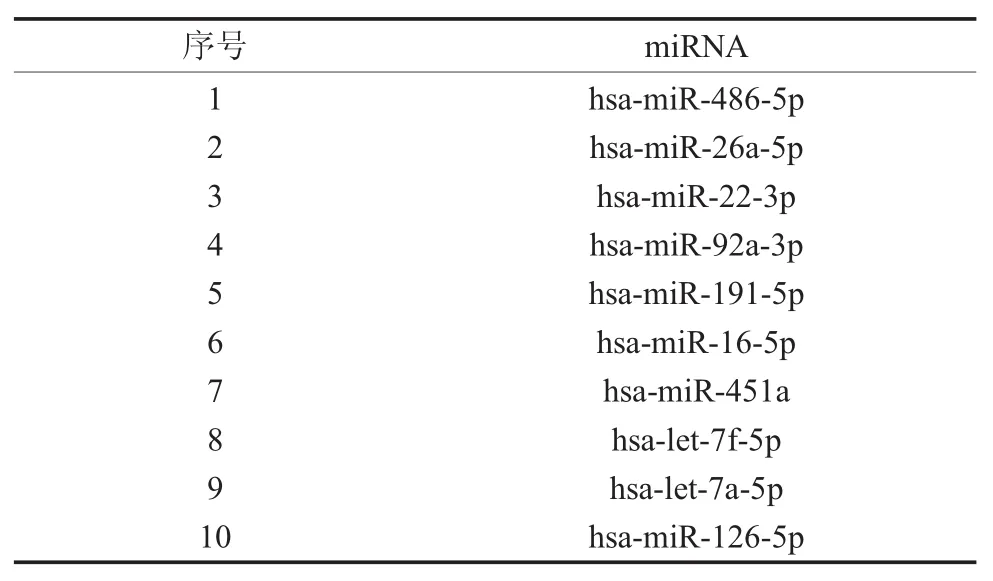
表2 血浆测序数据标准化结果排序(前10种,按表达量由高到低排列)

表3 miRNA-486-5p血浆高通量测序结果的组间比较
2.2 PCR验证结果 各组miRNA-486-5p表达量见表4。在20名OSCC受试者中有16名在术后较术前表达升高,且此种改变有统计学意义(P<0.01)。同时,这种表达水平的升高也体现在健康对照组与肿瘤术前组的比较中(P<0.05)。为进一步研究,我们将肿瘤术后组与健康对照组进行了比较,结果无统计学差异(P>0.05),这意味着外科手术后miRNA-486-5p表达水平表达得到了恢复。

表4 miRNA-486-5p在各组中的表达量
按照肿瘤有无复发将患者分为有复发及无复发两组,将肿瘤术前(PB)与健康对照(PH)血浆miRNA-486-5p表达水平进行比较,有复发组及无复发组均表达降低,且此种改变均有统计学意义(P<0.05)。
将肿瘤术后(PA)与术前(PB)血浆 miRNA-486-5p表达水平进行比较,在无复发的12名患者中,有11名出现miRNA-486-5p表达升高,且此种改变有统计学差异(P<0.01)。在肿瘤复发的8名患者中,仅有3名患者出现表达升高,且此种改变无统计学差异(P>0.05)。
将肿瘤术后(PA)与健康对照(PH)组血浆miRNA-486-5p表达水平进行比较,复发组及无复发组均未出现有统计学意义的改变。
2.3 GO分析结果 对miRNA-486-5p进行了GO分析,结果如下:从图2中可以发现miRNA-486-5p参与许多生物过程,如程序性细胞死亡、细胞凋亡、细胞周期等。尤其是miRNA-486-5p参与包括凋亡的正调节和程序性细胞死亡,这与其在口腔鳞癌患者血浆中的表达下调相匹配。
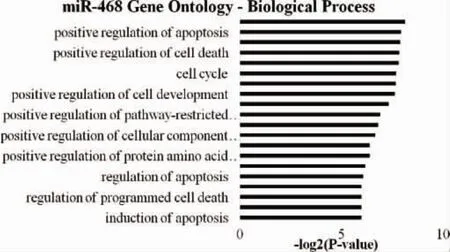
图2 miR-486-5p靶基因功能注释图
3.讨论
本研究中,我们选择了8例无复发口腔鳞癌患者作为研究对象,分别于术前1周内及术后一年复查时收集血浆标本,同时收集健康人的血浆标本,进行高通量测序,旨在筛选血浆中miRNA生物标志物用于诊断口腔鳞癌及对鳞癌患者手术后的预后判断。在术前和术后配对的口腔鳞癌患者血浆和健康对照血浆中,使用高通量测序方法分析血浆中的循环小RNA。查阅相关文献,本研究是第一次使用高通量测序技术对口腔鳞癌中配对的术前和术后血浆样品中的小RNA进行测序分析,并用于检测癌症复发相关的miRNA的报告,目前未见其他文献报道。测序结果显示,口腔鳞癌术前血浆中miRNA-486-5p的表达水平较健康对照者明显下调,术后又回升到正常水平。
为了避免重复,我们使用不同的病例集进行了PCR验证,包括12例鳞癌无复发者、8例有复发者和18例健康对照者,并据此分层分组,对血浆中miRNA-486-5p的表达水平进行分析,发现鳞癌术前组和术后复发组的血浆miRNA-486-5p表达是降低的,而鳞癌术后无复发组血浆miRNA-486-5p的表达是升高的。这提示对于有过鳞癌病史的人群,miRNA-486-5p的降低可能标志着鳞癌的复发。
我们血浆样品中表达最丰富的miRNA是miRNA-486-5p,占所有miRNA读段总数的39.6%,在以前的研究文献中也显示了血浆中miRNA-486-5p较高的丰度[8],与本研究的结果一致。它从锚蛋白1(一种在红细胞前体,内皮细胞和骨骼肌中表达的基因)转录而来,因此我们在血浆中检测到高表达的miRNA-486-5p是不足为奇的。通过文献检索发现:我们检测到的非常高的miRNA-486-5p表达也可能是由用于本研究的文库制备试剂盒(Illumina TruSeq小RNA文库制备试剂盒)引起的。该试剂盒已报道产生高于预期的miRNA-486-5p的表达[9]。然而,qRT-PCR验证高通量测序结果发现miRNA-486-5p可作为口腔鳞癌的潜在诊断生物标志物,因为其在口腔鳞癌术前血浆(PB)和健康对照血浆(PH)比较中,在PB组中表达明显下降。此外,miRNA-486-5p与OSCC复发高度相关,在观察期内,术前组(PB)与术后血浆(PA)相比,口腔鳞癌复发的患者miRNA-486-5p的表达失调现象不显著。然而,在没有OSCC复发的患者组中,术前miRNA-486-5p的表达是显著下调的。因此,患者手术前后miRNA-486-5p的表达改变可作为生物标志物来监测手术后口腔鳞癌的复发。文献显示,也已经在其他类型的肿瘤中检测到miRNA-486-5p的下调。有研究发现miRNA-486-5p在乳腺癌组织和细胞系中被抑制,并通过直接靶向癌基因PIM-1作为肿瘤抑制性miRNA[10]。在肺癌中,miRNA-486-5p通过下调调节肿瘤性ARHGAP5和胰岛素生长因子信号传导被鉴定为肿瘤抑制因子,其下调在血浆样品中也得到验证[11-13]。在胃癌中,在组织和细胞系中证实了miRNA-486-5p的调节,并且确定了OLFM4作为其靶标[14]。已经报道[15]认为,miRNA在肿瘤中的特异性表达使其可以成为肿瘤的标志物,并用于对肿瘤的诊断和评价预后。miRNA-486-5p在口腔鳞癌组织中表达下调[16],但未见关于循环miRNA-486-5p在口腔癌中表达失调的报道。我们的研究也是第一次使用miRNA-486-5p作为口腔鳞癌复发的潜在循环生物标志物的报告。
综上所述,miRNA-486-5p有潜力作为口腔鳞癌诊断的候选生物标志物,可用于手术后监测口腔鳞癌复发的标记物。但在这项研究中,一方面,用于测序和qRT-PCR验证的血浆样品的数量是有限的;另一方面,少数病例血浆miRNA-486-5p的失调趋势不明确,因此,在这里发现的潜在miRNA生物标志物应该在大规模筛选中进一步验证以证实这些发现。
[1] Siegel R,Ma Z,Jemal A.Cancer statistics,2014[J].Cancer J Clin,2014,64(1):9-29
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].Cancer JClin,2013,63(1):11-30
[3] Messadi R,Wilder-Smith P,Wolinsky L.Improving oral cancer survival:the role of dental providers[J].J Calif Dent Assoc,2009,37(11):789-798
[4] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297
[5] Chen K,Rajewsky N.The evolution of gene regulation by transcription factorsand microRNAs[J].Nature Review s Genetics,2007,8(2):93-103
[6]Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006
[7]Huang DW,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID Bioinformatics Resources[J].Nature Protoc,2009,4(1):44-57
[8]Williams Z,Ben-Dov IZ,Elias R,et al.Comprehensiveprofiling of circulating microRNA via small RNA sequencing of cDNA librariesrevealsbiomarker potential and limitations[J].Proc Natl Acad Sci USA,2013,110(11):4255-4260
[9] Huang X,Yuan T,Tschannen M,et al.Characterization of human plasma-derived exosomal RNAs by deep sequencing[J].BMC Genomics,2013,10;14:319.doi:10.1186/1471-2164-14-319
[10]Zhang G,Liu Z,Cui G,et al.MicroRNA-486-5p targeting PIM-1 suppresses cell proliferation in breast cancer cells[J].Tumour Biol,2014,35(11):11137-11145
[11]Wang J,Tian X,Han R,et al.Dow nregulation of miR-486-5p contributesto tumor progression and metastasisby targeting protumorigenic ARHGAP5 in lung cancer[J].Oncogene,2014,33(9):1181-1189
[12]Peng Y,Dai Y,Hitchcock C,et al.Insulin grow th factor signaling is regulated by microRNA-486,an underexpressed microRNA in lung cancer[J].Proc Natl Acad Sci USA,2013,110(37):115043-115048
[13]Mozzoni P,Banda I,Goldoni M,et al.Plasma and EBC microRNAs as early biomarkers of non-small-cell lung cancer[J].Biomarkers,2013,18(8):679-686
[14]Oh HK,Tan AL,Das K,et al.Genomic loss of miR-486 regulates tumor progression and the OLFM4 antiapoptotic factor in gastric cancer[J].Clin Cancer Res,2011,17(9):2657-2667
[15]罗 伟,刘洪臣.MiRNA在肿瘤干细胞中作用的研究进展[J].中华老年口腔医学杂志,2013,11(6):352-355
[16]Soga D,Yoshiba S,Shiogama S,et al.microRNA expression profilesin oral squamous cell carcinoma[J].Oncol Rep,2013,30(2):579-583
