女性肥胖与宫颈人乳头瘤病毒持续性感染的相关性研究
2018-06-14申丽娟黄玉香陈伟平
申丽娟 黄 昕 黄玉香 冷 亮 陈伟平
1.深圳市龙岗中心医院,广东深圳 518116;2.湖南师范大学医学院预防医学系,湖南长沙 410013
宫颈癌是女性常见恶性肿瘤之一,2013年全球 有48.5万新发病例,23.6万名妇女死于该病[1]。在中国,每年约有3万名妇女死于该病[2]。既往的研究已经证实,人乳头瘤病毒(HPV)持续性感染是发生宫颈癌的必要病因[3-4]。然而,宫颈型别特异性HPV持续性感染的机制并未完全阐明[5]。有研究表明,肥胖者由于体内脂肪的积累,雌激素合成及分泌增加,其发生宫颈癌的风险也增加[6]。因此,了解肥胖者中HR-HPV持续感染情况及其关联程度和方向,对制定针对性的宫颈癌防治措施有重要意义。为了更好的促进我国妇女的健康,我们在深圳龙岗地区开展调查,进行前瞻性随访研究,以了解肥胖女性宫颈HPV的持续性感染情况及其影响因素,为制定预防宫颈HPV持续性感染策略和降低宫颈癌的疾病负担提供依据。
1 资料与方法
1.1 一般资料
2012年1月~2016年6月,招募在深圳市龙岗医院的体检中心进行女性职工宫颈HPV筛查的企事业单位,被选单位所有女性职工作为研究对象。此外,研究对象需符合以下纳入标准:(1)年龄≥21岁,并有过性行为;(2)未妊娠;(3)具有完整宫颈。
1.2 调查问卷和随访
所有研究对象在填写知情同意书入组后,需要填写自行设计的调查问卷和进行宫颈HPV-DNA的检测,对于首次检测阳性者需要在12个月后再次进行宫颈HPV-DNA的检测。调查问卷内容包括年龄、职业等社会人口资料。
1.3 体查及HPV-DNA分型
采用符合国家标准的杠杆式体重计和身高计进行对受检者进行测量,根据身高、体重测量值计算体重指数(BMI,body mass index),BMI=体重 /身高2(kg/m2)。利用宫颈细胞刷收集研究对象的宫颈上皮脱落细胞,并置于细胞保存液中,-20oC冰箱保存待检。按照美国Digene公司的HC2-HPVDNA检测试剂盒提供的操作流程,对脱落宫颈细胞进行DNA提取、扩增后进行HPV-DNA分型检测。每个标本一次检测13种高危型别HPV(HRHPV16、18、31、33、35、39、45、51、52、56、58、59 和68型),检测阳性的标准为病毒负荷半量(HPVDNA)≥ 1.0ng/L。
1.4 变量定义
根据研究对象的BMI,将研究人群其划分为非超重或肥胖(< 23.0kg/m2),超重(23.0 ~ 27.4kg/m2)、肥胖(≥ 27.5kg/m2)和超重及肥胖(≥ 23.0kg/m2)。HR-HPV感染指任一型别HR-HPV检测阳性;HR-HPV多重感染指两种及以上型别的HR-HPV检测呈现阳性。型别特异性HPV持续感染(type specific persistence HPV infection)指间隔12个月的两次HPV检测结果均为同一型别HPV阳性者;HPV一过性感染(transient HPV infection)指在间隔12个月的两次分型检测,第一次为阴性或两次感染型别不同者。
1.5 统计学处理
使用SAS9.2进行统计分析,患病率采用Segi世界人口构成进行标准化,各分组间患病率及发病率的比较采用χ2检验,并计算95%可信区间(CI,confidence interval);应用非条件logistic回归模型,估算超重、肥胖与HR-HPV感染之间的OR及95%CI;应用二项分布回归计算超重、肥胖与HPV持续性感染之间的RR及95%CI。所有检验显著性水平,以双侧检验α取值0.05。
2 结果
2.1 一般情况与首检HR-HPV感染情况
本研究最终招募了224家单位,共5114名研究对象,平均年龄(46.8±10.6)岁,其中704人检测为HR-HPV阳性,患病率13.77%(95%CI:12.85%~14.74%),标化患病率16.78%(95%CI:15.78%~17.83%);感染数最多的HPV型别为52、58和 16型,患病率分别为 4.16%,2.59% 和2.05%(表1)。有72例为多重型别HR-HPV感染,患病率1.41%(95%CI:1.12%~1.77%)),标化患病率2.74%(95%CI:2.32%~3.22%)。
研究对象的一般情况及HR-HPV感染现状如表2所示,年龄、文化程度不同者其HR-HPV感染情况不完全相同(P<0.05);已婚者感染率低于其他人群(P<0.05);不同职业者之间HR-HPV感染率差异无统计学意义(P>0.05)。
2.2 超重及肥胖与HR-HPV感染
如表3所示,所有研究对象中超重934人(超重率 18.26%)、肥胖 277人(肥胖率 5.42%)。非超重或肥胖HR-HPV患病率为14.22%(95%CI:13.16%~15.53%);超重及肥胖的HR-HPV患病率分别为12.30%(95%CI:10.57%~14.27%)和 12.27%(95%CI:8.92% ~ 16.66%),三 组 人群HR-HPV的患病率之间差异无统计学意义(χ2=2.86,P > 0.05)。
以非超重或肥胖者为对照,计算肥胖、超重与HR-HPV阳性的关联,结果显示,超重、肥胖、超重或肥胖与HR-HPV之间的关联不具有统计学意义(P>0.05)。为进一控制混杂因素,采用多因素logistic回归,在调整了研究对象的年龄、文化程度,职业和婚姻状况后,超重、肥胖、超重或肥胖与HR-HPV患病之间的关联仍无统计学意义,调整 OR值分别为 0.97(95%CI:0.61~ 1.23),0.95(95%CI:0.45 ~ 1.01) 和 0.96(95%CI:0.63~1.00)。见表 3。
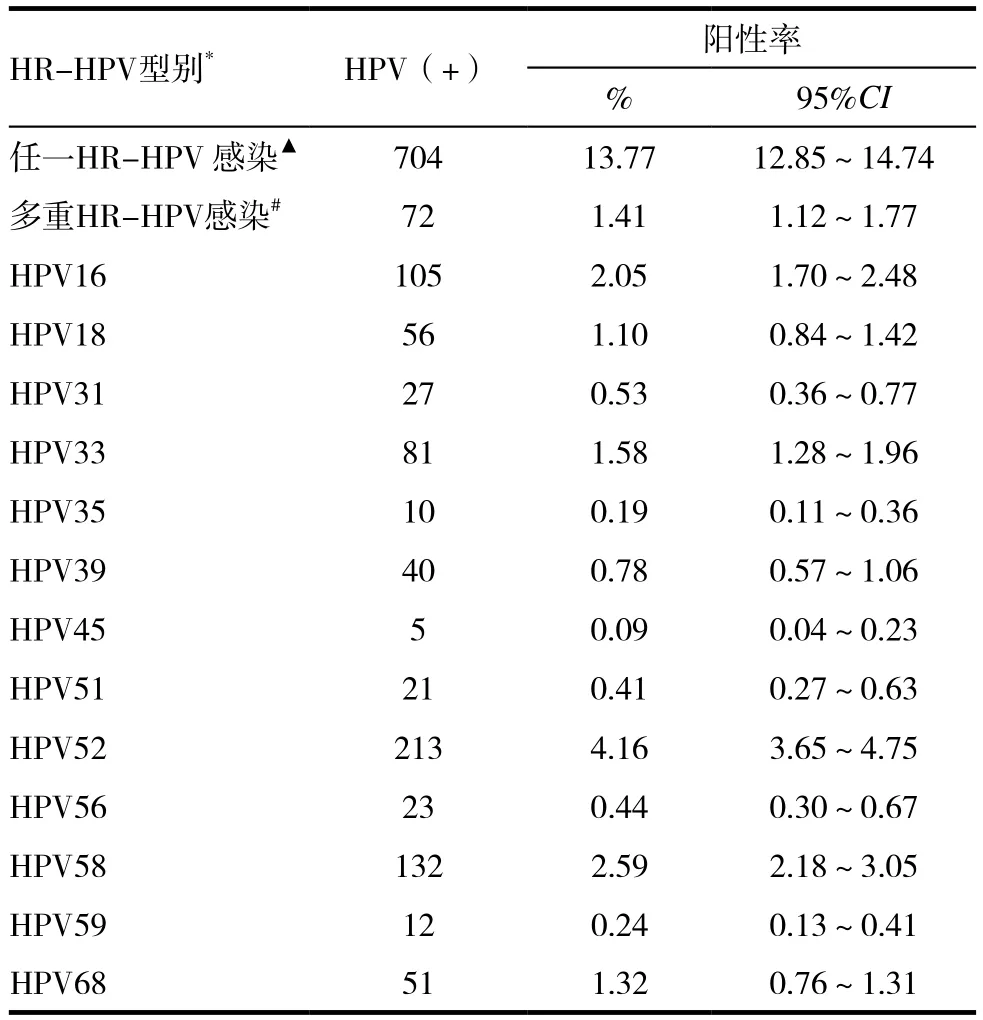
表1 研究对象宫颈HR-HPV感染情况(n=5114)

表2 研究对象特征及首检HR-HPV感染现状

表3 女性超重肥胖与宫颈HR-HPV感染的关联
2.3 型别特异性HR-HPV持续感染情况
704名首检HR-HPV阳性的妇女在间隔12个月后,有378人呈现同一型别HRHPV的持续性感染,发生率为53.69%(95%CI:50.00%~57.35%)。持续性感染发生率较高的型别有52、58和33型,发生率分别为(57.28%,55.30%和51.85%),HPV16和18型的持续感染发生率分别为42.86%和51.79%。见表4。
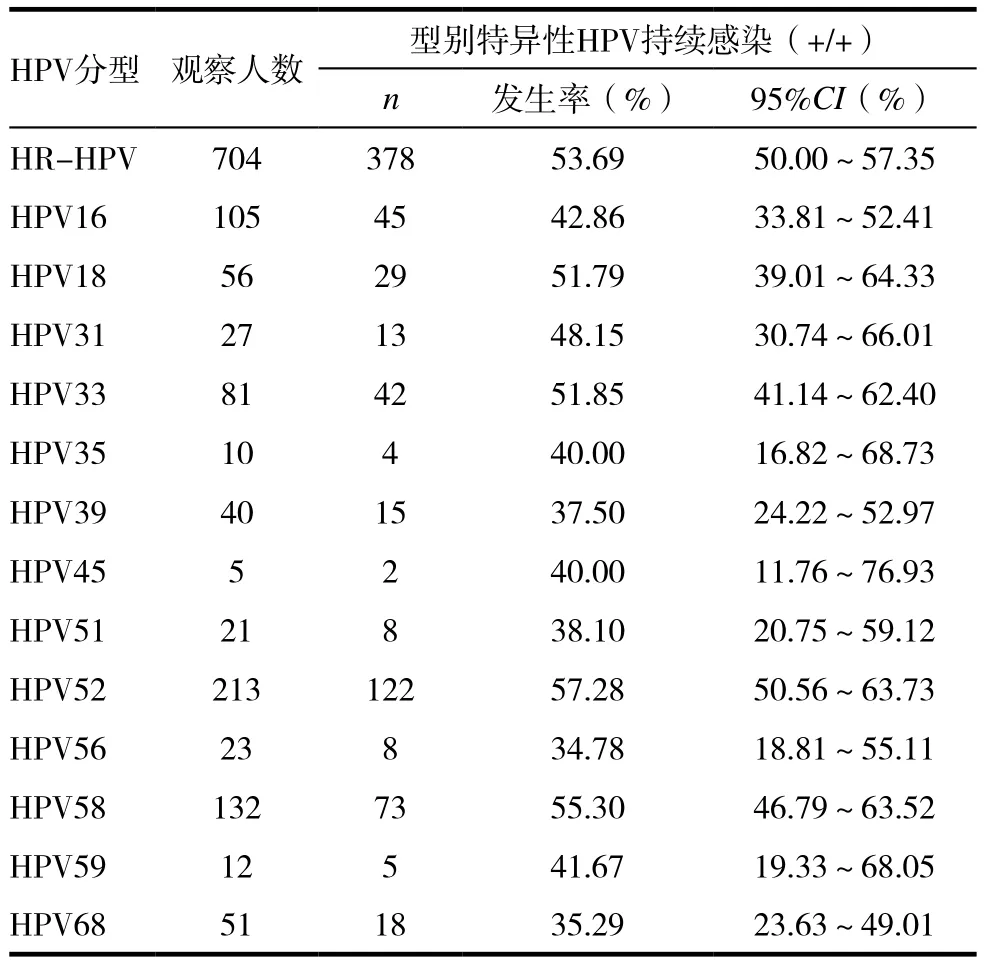
表4 研究人群型别特异性HPV持续感染情况(n=704)
2.4 超重及肥胖与特异性型别HPV持续感染
如表5所示,非超重或肥胖特异型别HRHPV持 续 感 染 发 生 率 为49.73%(95%CI:45.59%~53.88%),超重、肥胖者的持续感染发生 率 为 64.35%(95%CI:55.26% ~ 72.51%)和82.35%(95%CI:66.49%~91.65%),三组人群HR-HPV持续感染发生率不完全相同,差异具有统计学意义(χ2=19.89,P < 0.05)。

表5 女性超重肥胖与宫颈HR-HPV持续感染的关联
以非超重或肥胖者为非暴露组,计算肥胖、超重与特异型别HR-HPV持续感染的关联,结果显示,超重、肥胖、超重或肥胖与HR-HPV之间的RR值分别为 1.29(95%CI:1.00 ~ 1.67),1.66(95%CI:1.12~ 2.44)和 1.38(95%CI:1.10~ 1.73),均具有统计学意义(P<0.05)(见表5)。为进一控制混杂因素,采用多因素二项回归,在调整了研究对象的年龄、文化程度,职业和婚姻状况后,超重与HR-HPV持续感染之间的关联无统计学意义(RR=1.13(95%CI:0.96 ~ 1.35)),但是肥胖、超重及肥胖与HR-HPV持续感染之间的关联仍具有统计学意义,调整RR值分别为1.31(95%CI:1.03~ 2.00)和 1.18(95%CI:1.01~ 1.46)。
3 讨论
本研究结果显示深圳龙岗区女性宫颈HR-HPV患 病 率 为13.77%(95%CI:12.85%~14.74%),经标化后患病率为16.78%(95%CI:15.78% ~ 17.83%),该患病水平稍高于中国城市人口宫颈高危型HPV平均患病率水平(16.0%(95%CI:15.7% ~ 16.3%)[7]), 也 远高于全球宫颈HPV平均患病率(11.7%(95%CI:11.6%~11.7%))[8],提示需要加强深圳龙岗区女性的生殖道健康的宣教工作。同一型别HRHPV的持续性感染,发生率为53.69%(95%CI:50.00%~57.35%)。持续性感染发生率较高的型别有52、58和33型。超重及肥胖并不增加HR-HPV感染的风险,但是超重及肥胖HR-HPV感染者中发生持续感染的风险较非超重肥胖者显著增加。
不同国家和地区间HPV的主要感染型别存在差异性[7-8]。在贵阳、西安、沈阳和南宁地区的最常见的感染型别为16,52和58型,而在上海地区的常见型别为16,18和83型,合肥地区为16,33和82型[8];浙江地区为 52,16和 58型[9];新疆地区为16,51和31型[10]。本研究显示,深圳龙岗女性宫颈HR-HPV感染的主要型别为52、58和16型,与深圳其他地区的研究报道一致[11]。不同年龄段女性HR-HPV感染情况不完全相同,在本研究呈现出低年龄段(<30岁)和高年龄组(≥45岁)人群较高的情况,与其他研究者的结论相似[12],可能与低年龄段女性性生活频繁及高年龄组女性免疫能力发生下降有关[12]。婚姻状况会影响患者本人及其性伴侣发生高危性行为的风险及频率[13],本研究发现未婚者HR-HPV感染率高于已婚者。
据估计80%的女性在50岁之前的某些时段均感染过HPV,绝大多数情况是HPV在一年内被机体自动清除从而呈现一过性感染[14],只有部分妇女会发展为持续性感染。本研究显示,53.69%(95%CI:50.00%~57.35%)的女性在宫颈感染HPV一年后呈现型别特异性HPV持续性感染,该结果与Rositch AF[15]对86个研究,超过10万名妇女进行的型别特异性HR-HPV持续性感染进行的meta分析结果相似(43.5%(95%CI:30.8% ~ 57.6%))。宫颈 HPV持续性感染的妇女约有20%会在未来五年发生宫颈上皮内瘤样病变或宫颈癌[16]。因此,预防HPV持续性感染或对该部分人群进行干预是预防宫颈癌的主要策略。不同型别HPV持续性感染发生率有所不同,HPV16、18、31、52和58型感染较其他型别更容易发展成为持续性感染[17-18]。本研究的结果显示研究人群高危型HPV的持续性感染的主要型别依次为52、58和33、18、31和16型,持续性感染测量的间隔时间差异可能是造成结果差异的原因之一。
肥胖者发生宫颈癌的风险增加[6],而HR-HPV是宫颈癌发生的必要病因[3-4],因此研究者开始关注肥胖与HR-HPV感染、HR-HPV持续感染的关联。根据我们的检索,目前关于肥胖与HPV感染的报道仅有两篇[18-19]:Liu等[19]在2008~2010年对696名女性进行了HPV初筛,后对其中132名HPV阳性的妇女随访了2年,比较了肥胖者(BMI≥30kg/m2)与非肥胖者(BMI<30kg/m2)者HPV的患病率、新发感染率和清除率,结果发现肥胖与HR-HPV患病、HR-HPV新发感染及HR-HPV持续性感染之间的关联均无统计学意义;然而,2003~2010年参与美国国家健康与营养调查的(NHANES)4172名妇女[20]的横断面调查结果显示,肥胖者感染HR-HPV的风险降低(OR=0.77,(95%CI:0.62~0.95)。该效应可能由于肥胖女性较其他女性发生性行为的次数减少,使得其HPV感染机会降低造成[20]。我们的研究结果发现超重或肥胖者感染HR-HPV的风险稍低于其他人群,但该关联仅存在边界统计学效应(OR=0.96(95%CI:0.63~ 1.00))。通过12个月后的随访,我们还探讨了肥胖与HPV持续感染的情况,结果发现超重及肥胖HR-HPV感染者中发生持续感染的风险较非超重肥胖者显著增加(RR=1.18(95%CI:1.01 ~ 1.46)),这可能是肥胖增加宫颈癌的风险途径之一。
综上所述,本研究的调查结果发现,深圳龙岗区女性的宫颈高危型HPV标准化患病率16.78%,高于全国城市人口平均水平;53.69%的高危型HPV感染者可发展为持续性感染;超重及肥胖并不增加HRHPV感染的风险,但是超重及肥胖HR-HPV感染者中发生持续感染的风险较非超重肥胖者显著增加。
[1] Global Burden of Disease Cancer Collaboration.The Global Burden of Cancer 2013[J].JAMA Oncology,2015,1(4):505-527.
[2] Ferlay J,Soerjomataram I,Ervik M,et al.GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide:IARC Cancer Base No.11[Internet].International Agency for Research on Cancer,2008,136(5):E359–E386.
[3] Schiffman M,Castle PE,Jeronimo J,et al.Human papillomavirus and cervical cancer[J].Lancet,2007,370(9590):890-907.
[4] De Sanjose S1,Quint WG,Alemany L,et al.Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J].Lancet Oncology,2010,11(11):1048-1056.
[5] Castellsagué X.Natural history and epidemiology of HPV infection and cervical cancer[J].Gynecol Oncol,2008,110(3 Suppl 2):S4-7.
[6] Nagaraju GP,Rajitha B,Aliya S,et al.The role of adiponectin in obesity-associated female-specific carcinogenesis[J].Cytokine Growth Factor Rev,2016,31:37-48.
[7] Zhao FH,Lewkowitz AK,Hu SY,et al.Prevalence of Human Papillomavirus and Cervical Intraepithelial Neoplasia in China: A pooled analysis of 17 Population-based Studies[J].Int J Cancer,2012,131(12):2929–2938.
[8] Bruni L,Diaz M,Castellsagué M,et al.Cervical Human Papillomavirus Prevalence in 5 Continents:Meta-Analysis of 1 Million Women with Normal Cytological Findings[J].The Journal of Infectious Diseases,2010,202(12):1789-1799.
[9] Ye J,Cheng X,Chen X,et al.Prevalence and risk profile of cervical Human papillomavirus infection in Zhejiang Province,southeast China:a population-based study[J].Virol J,2010,7(1):1-11.
[10] Niyazi M1,Husaiyin S,Han L,et al.Prevalence of and risk factors for high-risk human papillomavirus infection:a population-based study from Hetian,Xinjiang,China[J].Bosn J Basic Med Sci.2016,16(1):46-51.
[11] 麦光兴,严泽浩,熊礼宽,等.深圳地区女性生殖道HPV 感染及基因型结果分析[J].国际检验医学杂志,2014,35(14):1878-1879.
[12] 董丽,胡尚英,张倩,冯等.山西省宫颈癌筛查队列中人乳头瘤病毒基因型别分布10年动态变化规律研究[J].中华流行病学杂志,2017,38(1):20-25.
[13] Kim JH,Lau JT,Cheuk KK.Sexlessness among married Chinese adults in Hong Kong:prevalence and associated factors[J].J Sex Med,2009,6(11):2997-3007.
[14] Castellsagué X.Natural history and epidemiology of HPV infection and cervical cancer[J].Gynecol Oncol,2008,110(3 Suppl 2):S4-7.
[15] Rositch AF,Koshiol J,Hudgens MG,et al.Patterns of persistent genital human papillomavirus infection among women worldwide: a literature review and metaanalysis[J].Int J Cancer.2013,133(6):1271-1285.
[16] Oakeshott P,Aghaizu A,Reid F,et al.Frequency and risk factors for prevalent,incident,and persistent genital carcinogenic human papillomavirus infection in sexually active women:community based cohort study[J].BMJ,2012,344(25):e4168.
[17] Louvanto K1,Rintala MA,Syrj nen KJ,et al.Genotypespecific persistence of genital human papillomavirus (HPV)infections in women followed for 6 years in the Finnish Family HPV Study[J].J Infect Dis,2010,202(3):436-444.
[18] Rautava J,Willberg J,Louvanto K,et al.Prevalence,genotype distribution and persistence of human papillomavirus in oral mucosa of women:a six-year follow-up study[J].PLoS One,2012,7(8):e42171.
[19] Liu SH,Rositch AF,Viscidi RP,et al.Obesity and human papillomavirus infection in perimenopausal women[J].J Infect Dis,2013,208(7):1071-1080.
[20] Liu SH,Chen HJ,Hsieh TH,et al.Excessive adiposity,metabolic health,and risks for genital human papillomavirus infection in adult women:a population-based crosssectional study[J].BMC Obes,2015,2(1):1-9.
