毛细支气管炎患儿血Th1/Th2相关细胞因子水平的研究
2018-06-14孙同英崔振泽黄燕徐超
孙同英, 崔振泽, 黄燕, 徐超
毛细支气管炎是婴幼儿时期最常见的急性下呼吸道感染性疾病,临床以咳嗽、呼吸急促、喘憋为主,且部分患儿愈后反复喘息,最终发展为哮喘。已知Th1/Th2亚群比例和功能失衡是哮喘的主要免疫学发病机制,表现为Th1细胞功能低下,Th2细胞功能亢进[1]。而毛细支气管炎患儿机体免疫功能如何,是否也存在Th1/Th2细胞比例失衡,一直都是国内外相关领域关注的焦点问题。为了解毛细支气管炎的发病机制并指导临床治疗,本研究对毛细支气管炎患儿血清中Th1/Th2相关细胞因子进行了检测,现报道如下。
1 资料与方法
1.1 临床资料 选择2016年9月至2017年2月大连市儿童医院呼吸科收治住院的毛细支气管炎患儿30例为观察组,其中男16例,女14例;年龄2~24个月,平均年龄(10.28±3.82)个月。同期选择本院健康体检儿童30例为对照组,其中男18例,女12例;年龄2~24个月,平均年龄(11.34±2.78)个月。两组儿童在性别、年龄方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 参照2006年毛细支气管炎的临床管理——美国儿科学会临床实践指南简介[2]中毛细支气管炎的诊断标准。
1.3 纳入标准 (1)符合儿童毛细支气管炎的诊断标准;(2)年龄2个月至2岁;(3)患儿家属知情同意。
1.4 排除标准 (1)重症肺炎引起的心、脑、肾等器官功能障碍或衰竭;(2)纵膈占位、心内膜弹力纤维增生症、异物吸入、支气管畸形等疾病。
1.5 检测方法 每天分别收集健康体检儿童、毛细支气管炎患儿的静脉血2~3 mL,以3 000 r/min离心,离心后收集血清,存于-80 ℃冰箱保存。采用ELISA法测定γ干扰素(IFN-γ)、白细胞介素(IL-4、IL-10、IL-13、IL-33、IL-17),试剂盒购自美国R&D Systems公司,检测步骤按试剂所附说明进行。
1.6 观察指标 两组IFN-γ、IL-4、IL-10、IL-13、IL-33、IL-17指标比较。
1.7 统计学方法 采用SPSS 17.0软件进行统计学处理,非正态分布的计量资料采用秩和分析,符合正态分布的计量资料采用显著性t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组儿童血清IFN-γ、IL-4水平及其比值的比较 见表1。

表1 两组儿童血清IFN-γ、IL-4水平及其比值比较
注:与对照组比较,at=-2.959,P<0.05。
表1结果表明,观察组血清中IL-4水平高于对照组,差异有统计学意义(P<0.05);两组血清中IFN-γ、IFN-γ/IL-4比较差异无统计学意义(P>0.05)。
2.2 两组儿童血清IL-10、IL-13水平比较 见表2。
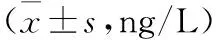
表2 两组儿童血清IL-10、IL-13水平比较
注:与对照组比较,at=-2.020,-2.150,P<0.05。
表2结果表明,观察组患儿血清中IL-10、IL-13高于对照组,差异有统计学意义(P<0.05)。
2.3 两组儿童血清IL-17、IL-33水平比较 见表3。
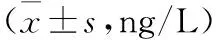
表3 两组儿童血清IL-17、IL-33水平比较
注:与对照组比较,at=-2.224,-2.065,P<0.05。
表3结果表明,与对照组相比,观察组患儿血清中IL-17、IL-33升高,差异有统计学意义(P<0.05)。
3 讨论
正常情况下,Th0按照一定比例分别向Th1(主要分泌IL-2、IFN-γ)和Th2(主要分泌IL-4、IL-10、IL-13、IL-33)分化,Th1可诱导巨细胞介导的免疫反应,延迟超敏反应,有利于机体抵抗外来病原微生物的侵袭,Th2主要刺激抗体介导的反应,释放IgE,促进Ⅰ型超敏反应,正常情况下二者细胞因子相互制约,使机体处于相对平衡状态[3-4],当机体受到外界刺激时,Th1/Th2细胞的平衡状态被打破,出现了向一侧漂移的情况。本研究毛细支气管炎患儿血清中Th1/Th2细胞因子分泌情况,结果显示,毛细患儿血清中IFN-γ水平较对照组下降,IL-4水平较对照组明显升高,初步提示毛细支气管炎患儿体内存在Th1/Th2细胞失衡状态,与相关研究结果一致[5]。IFN-γ是由Th1型淋巴细胞产生的细胞因子,被活化后的自然杀伤细胞也会产生IFN-γ,调节免疫反应,重要的是诱导Th0细胞向Th1转化,抵抗呼吸道病毒的感染[6]。而IL-4是CD4+T淋巴细胞向Th2型淋巴细胞生成的必需细胞因子,其辅助Th0淋巴细胞向Th2型淋巴细胞分化,并可以使IgE受体表达增加,分泌增多的IgE与嗜碱性粒细胞、肥大细胞相互作用,促进炎性介质释放,从而引起喘息。重要的是,IFN-γ和IL-4又分别体现着Th1和Th2型淋巴细胞的主要生物学效应,两者常作为监测Thl型淋巴细胞及Th2型淋巴细胞功能的指标,IFN-γ/IL-4平衡状态代表Th1/Th2免疫反应是否处于平衡状态。本研究结果显示,毛细支气管炎患儿体内IFN-γ/IL-4比值较对照组儿童有所降低,提示出现IFN-γ/IL-4平衡漂移,Th1型细胞因子表达受抑制,Th2型细胞因子处于优势表达,Th1/Th2相关细胞因子失衡,导致IgE合成增加,分泌增多的IgE与嗜碱性粒细胞、肥大细胞相互作用,炎性介质释放增加,从而引起喘息[7]。免疫学研究证实,哮喘患者体内也存在Thl/Th2型淋巴细胞功能失衡,出现IFN-γ/IL-4失衡[8],这也从Thl/Th2平衡角度提示,毛细支气管炎与哮喘的发生存在相似的机制。
IL-10、IL-13属于Th2型细胞因子,主要发挥Th2效应。IL-10由T细胞、B细胞以及单核巨噬细胞所产生,既能促使Th0淋巴细胞向Th2型淋巴细胞转化,还具有非常强的抗炎和免疫抑制的作用。本研究得出,毛细患儿血清中IL-10水平与对照组比较,明显升高。有研究报道,毛细支气管炎患儿鼻咽部IL-10水平升高,与毛细支气管炎后反复喘息相关[9]。而IL-13是一种多效能的细胞因子,可以促进B细胞的产生,进而提高体内IgE的水平,IgE作用于嗜碱性粒细胞、肥大细胞,引起哮喘的急性发作。本研究得出,毛细患儿血清中IL-13水平与对照组比较,明显升高,与相关报道相一致[10]。IL-4与IL-13通过其共同的受体IL-4Rα作用于气道平滑肌细胞内的靶细胞(增生/肥大)及B细胞(IgE分泌),肥大细胞(生长及分化)及杯状细胞 (化生及黏液分泌)[11],引起喘息。
IL-33也可促进Th2型细胞因子的分泌。本研究得出,毛细患儿血清中IL-33水平与对照组比较,明显升高,与国内外研究相一致[12-13]。IL-33可激活B1细胞并促进其增殖分化,加强IgM型抗体的产生,提高机体IL-5、IL-13水平。此外,IL-33还可有效活化嗜碱性粒细胞和肥大细胞,并促进嗜碱性粒细胞和肥大细胞脱颗粒、成熟,提高其生存,并可使Th2型淋巴细胞募集并活化,并且还可以募集、活化肥大细胞、嗜酸性粒细胞、树突细胞和嗜碱性粒细胞,在以上细胞所产生的趋化因子和细胞因子的作用下,使喘息加速发生[14]。
IL-17是由Th17淋巴细胞分泌的一种效应细胞因子,可以产生促进中性粒细胞聚集,引起炎症反应的作用。本研究得出,毛细患儿血清中IL-17水平与对照组比较,明显升高,与相关研究结果相一致[15]。IL-17可以引起机体炎症反应,并且能够激活巨噬细胞、上皮细胞,促进以上细胞分泌IL-1、IL-6、IL-8等细胞因子以及粒细胞-巨噬细胞集落刺激因子、肿瘤坏死因子α、前列腺素E2等因子,在以上因子的作用下促进气道平滑肌增生、纤维结缔组织形成,导致气道重塑和气道炎症反应。机体内IL-17的水平也受到了表观遗传学的影响[16],尚需要今后进一步的研究。
目前我们只是测定了刚入院时毛细支气管炎患儿血清中各细胞因子的水平,但患儿血清中各细胞因子水平随时间的变化情况以及患儿康复后喘息发作情况还需要进一步的随访完善,以明确毛细支气管炎与日后哮喘发生的相关性。但是并不是所有的毛细支气管炎患儿将来均发展为哮喘,这还与哮喘的遗传因素等复杂的发病机制有关。从检测手段来说,本研究只是从免疫细胞因子方面分析了毛细支气管炎与哮喘发生之间是否存在相关性,但是从基因检测、蛋白组学以及代谢等方面的研究还待进一步证实和研究。
[1] 黄燕.Th1/Th2细胞因子网络失衡与毛细支气管炎[J].医学综述,2008,14(16):2427-2430.
[2] 范娟,李茂军,吴青,等.毛细支气管炎的临床管理——美国儿科学会临床实践指南简介[J].中华实用儿科临床杂志,2015,30(10):730-732.
[3] 高雪,陈琪玮,罗佳,等.匹多莫德对哮喘患儿血清中Th1/Th2细胞因子表达的影响[J].中国中西医结合儿科学,2015,7(3):231-233.
[4] 黄莉,季伟,周卫芳,等.呼吸道合胞病毒毛细支气管炎患儿T细胞亚群和相关细胞因子的变化及其临床意义[J].苏州大学学报:医学版,2004, 24(1):85-86.
[5] 吴倩.IFN-1在系统性红斑狼疮中的表达及作用机制研究[D].济南:山东大学,2012.
[6] Schwarze J, Cieslewicz G, Joetham A, et al. Critical roles for interleukin-4 and interleukin-5 during respiratory syncytial virus infection in the development of airway hyperresponsiveness after airway sensitization[J]. Am J Respir Crit Care Med,2000,162(2 Pt 1):380-386.
[7] Meyer EH, DeKruyff RH, Umetsu DT. T cells and NK T cells in the pathogenesis of asthma[J]. Annu Rev Med,2008,59:281-292.
[8] Schuurhof A, Janssen R, de Groot H, et al. Local interleukin-10 production during respiratory syncytial virus bronchiolitis is associated with post-bronchiolitis wheeze[J]. Respir Res,2011,12:121.
[9] 王峻,李峰,王丽.婴幼儿毛细支气管炎患者血清IL-13、IL-8、TNF-α、TIgE水平的临床研究[J].中国医学创新,2014,11(27):4-6.
[10]Rael EL, Lockey RF. Interleukin-13 signaling and its role in asthma[J]. World Allergy Organ J,2011,4(3):54-64.
[11]胡应龙,周凤娟,雷震山,等.白细胞介素-12、13水平对儿童哮喘影响的研究[J].中华医学杂志,2005,29(1):29-30.
[12]戚菲菲,王锐莹,刘静,等.呼吸道合胞病毒感染诱导BALB/c鼠固有免疫细胞分泌IL-33[J].微生物学杂志,2014,34(4):37-41.
[13]Bahrami Mahneh S, Movahedi M, Aryan Z, et al. Serum IL-33 Is Elevated in Children with Asthma and Is Associated with Disease Severity[J]. Int Arch Allergy Immunol,2015,168(3):193-196.
[14]姚圣连,徐美玉,钱金强,等.辅助性T细胞17及白介素-17在呼吸道合胞病毒毛细支气管炎的表达及作用[J].临床儿科杂志,2013,31(9):850-853.
[15]Tripathi SK, Lahesmaa R. Transcriptional and epigenetic regulation of T-helper lineage specification[J]. Immunol Rev,2014,261(1):62-83.
[16]Iwakura Y, Ishigame H. The IL-23/IL-17 axis in inflammation[J]. J Clin Invest,2006,116(5):1218-1222.
