Ⅲ型脊髓灰质炎病毒抗原表位嵌合蛋白的免疫学研究
2018-06-13杨筱舟王晶夏文跃潘小霞赵冰心滕玉梅文喻玲陈元鼎
杨筱舟,王晶,夏文跃,潘小霞,赵冰心,滕玉梅,文喻玲,陈元鼎
1.中国医学科学研究院&北京协和医学院 医学生物学研究所,云南省重大传染病疫苗研发重点实验室,云南 昆明 650118;2.云南民族大学 化学与生物技术学院,民族药资源化学国家民委-教育部重点实验室,云南 昆明 650118
轮状病毒(rotavirus,RV)是人和动物腹泻的主要病原体,为正二十面体颗粒,含3层病毒衣壳,属于呼肠病毒科(Reovirudae)。RV一种分节段、无包膜的由11个双链RNA片段组成的病毒,可编码6个结构蛋白(VP)和6个非结构蛋白(NSP)[1]。根据组抗原蛋白VP6的血清型可将现有RV分为A~H共8个组,A、B、C、H组的RV可感染人类[2]。A组RV是引起婴幼儿病毒性腹泻的主要病原体。根据非糖基化刺突蛋白VP4和糖蛋白VP7编码基因的同源性差异,可将A组RV进行基因分型,目前共有27个G(VP7)型和37个P型(VP4)[3]。VP6是RV组抗原蛋白,最保守且最丰富,约占病毒结构蛋白总量的39%[4]。
至今尚无治疗RV感染的特效药物,疫苗仍是预防RV感染的最有效方法。作为全球首个口服轮状病毒疫苗,恒河猴人重组轮状病毒疫苗于1998年在美国上市,但由于存在肠套叠风险,一年后退出市场。随后使用最多的是RV减毒活疫苗,如英国产Rotarix疫苗,它是由G1P[8]病毒株所制备的口服减毒活疫苗,儿童接种Rotarix疫苗后抗轮状病毒IgA抗体阳转率在新加坡地区可高达93.0%,在印度地区则较低,最高达67.4%[5]。Rotarix对不同型别轮状病毒的有效性存在差异,比如对G1野生型的平均有效性达64.1%,对非G1型轮状病毒的平均有效性达59.7%,对P[4]型的平均有效性达70.9%,对P[6]型的平均有效性达55.2%,对P[8]型的平均有效性达59.1%[6]。此外还有美国产的RotaTeq疫苗,它是人牛(WC3)重配株,含5种重配轮状病毒的口服减毒活疫苗,其中1个表达人RVP[8]型重配株,4个表达人RV(G1-G4型)重配株[7],美国及芬兰的儿童在接种RV5疫苗的抗轮状病毒IgA阳转率可高达95.5%,在非洲的效率较差,最高可达82.5%[8-9]。美国利用VDS分析方法对RotaTeq进行安全检测后,发现服用RotaTeq儿童的肠套叠及其他不良反应发生率与正常组比较未见显著差异[10]。目前,我国自己生产的RV口服疫苗是兰州生物制品研究所的罗威特疫苗(LLR)。LLR是由羔羊体内血清型为G10P[15]的羊轮状病毒制备的单价轮状病毒疫苗,相关研究显示其平均保护率仅为76%[11]。RV口服减毒活疫苗虽为人们带来福音,但同时也存在一定的问题,如疫苗安全性问题,可能会发生毒株基因重配,从而引起其他疾病;疫苗污染问题,2010年美国FDA在Rotarix和RotaTeq中发现了猪圆环病毒1型的DNA片段[12];疫苗保护效果问题,不同地区的保护效果及有效性存在一定的差异,例如Rotarix和RotaTeq在发展中国家的保护性远低于发达国家。
脊髓灰质炎病毒(poliovirus,PV)属微小核糖核酸病毒科(Picornaviridae),肠道病毒属(Entero⁃virus)。基因组为正向单链RNA,约7.5kb,是由十二个五聚体构成的二十面体病毒颗粒[13],可编码VP4、VP2、VP3和 VP1共 4个结构蛋白及 2A、2B、2C、3A、3B、3C和3D共7个非结构蛋白[14]。根据病毒毒株的不同抗原性,PV被分为Ⅰ、Ⅱ和Ⅲ等3种血清型,血清型之间无交叉免疫反应。人是脊灰病毒惟一的自然宿主,会导致肢体肌肉发生不对称弛缓性麻痹,也称小儿麻痹症[15-16]。
脊灰病毒引起的脊髓灰质炎目前只能通过疫苗进行预防[17],如口服脊灰减毒活疫苗OPV和灭活疫苗IPV。但随着OPV的使用,疫苗相关麻痹性脊髓灰质炎(vaccine-associated paralytic po⁃liomyelitis,VAPP)和疫苗衍生脊髓灰质炎病毒(vaccine-derived poliovirus,VDPV)问题随之出现。VAPP会使因个体差异或具有免疫功能缺陷的接种者在接种过程中产生麻痹型脊灰问题,而VDPV会使已消除脊灰病毒的国家因为继续使用OPV而产生疫苗衍生脊灰病毒[18],进而会产生循环,形成 cVDPV(circulating vaccine-derived polio⁃viruses)[19]。IPV一般采用注射形式接种,且不存在上述OPV所引起的疫苗衍生病例,目前较为推广的是利用Sabin株病毒生产的IPV。
综上所述,由于现有的RV和PV疫苗都存在一定的弊端,因此研发新的疫苗是当今趋势。在此,我们通过分子克隆技术构建了包含RVVP6和PV3抗原表位1的载体质粒,在大肠杆菌中表达嵌合蛋白,为新型RV、PV疫苗和疫苗载体研究提供了新的方向,并有助于其开发利用。
1 材料和方法
1.1 材料
用于基因克隆和扩增的大肠杆菌DH5α以及用于蛋白表达的大肠杆菌BL21(DE3)由本实验室提供;RVSA11株和PVⅢ型457PfizerRS1(PV3)来自世界卫生组织(WHO);表达质粒pETL由本实验室自pET-3a改造而来;豚鼠抗载体蛋白VP6F血清抗体、抗轮状病毒Wa株血清抗体和抗PV3血清抗体由本实验室制备;限制性内切酶、250bpDNA分子量标准和T4DNA连接酶等购自TaKaRa宝生物工程(大连)有限公司;辣根过氧化物酶(HRP)标记的羊抗豚鼠IgG(含轻链和重链)购自KPL公司;二氨基联苯胺(DAB)购自Sigma公司。
1.2 pETP6F载体蛋白质粒的构建
克隆重组人RVTB-Chen株VP6的cDNA,在编码VP6蛋白结构表面位置插入6个内切酶位点(SacⅠ、BspT104、KpnⅠ、BlnⅠ、SacⅡ和XhoⅠ),得到含6个插入位点I1、I2、I3、I4、I5、I6的重组载体蛋白VP6F(380氨基酸残基,相对分子质量为43200)的编码DNA。将重组载体蛋白VP6F编码DNA插入空载体质粒pETL的NdeⅠ/BamHⅠ克隆位点,构建携带载体蛋白VP6F编码DNA的重组表达质粒pETP6F。
Aim: The aim of the study was to perform a comparative evaluation of the use of various methods of reconstructive assistance in the repair of the femoral-tibial segment in patients with peripheral arterial disease.
1.3 重组抗原表位
选取PV3中和位点1(NAg1)的氨基酸序列作为外源抗原表位(命名为PV3N1),其基因序列为GAGGTGGACAATGAACAAACCACCCGGGCACAGA AG,对应的氨基酸序列为EVDNEQPTTRAQK。人工合成编码抗原表位PV3N1的互补核苷酸引物,两端引入XhoⅠ酶切位点,上游引物为PV3/N1-308X-F:TCGAGGTGGACAATGAACAACCAACCA CCCGGGCACAGAAGC,下游引物为PV3/N1-308XR:TCGAGCTTCTGTGCCCGGGTGGTTGGTTGTTCA TTGTCCACC。将设计合成的互补引物片段进行退火,制备插入片段,并在T4DNA连接酶的作用下,插入VP6F载体蛋白上的I6位点。
1.4 嵌合蛋白表达质粒的构建
将抗原表位嵌合蛋白编码基因重组连接到pETL质粒的NdeⅠ/BamHⅠ克隆位点上,构建在VP6F上携带PV3抗原表位基因的重组嵌合表达质粒pETP6F/PV3N1。经双酶切反应鉴定该重组嵌合表达质粒连接成功,通过DNA测序确定目的基因正确完整。
1.5 重组嵌合蛋白的表达
将重组质粒pETP6F、pETP6F308X/PV3V1分别转化大肠杆菌DH5α进行表达,并利用碱裂解法提取大肠杆菌DH5α中的质粒DNA,经酶切鉴定及DNA测序确定。再将重组质粒pETP6F、pETP6F308X/PV3V1分别转化大肠杆菌 BL21(DE3)感受态细胞,在含有氨苄青霉素的LB培养基上于37℃表达。
1.6 重组嵌合蛋白的SDS-PAGE检测及纯化
重组质粒转化细胞培养液于4℃、4000r/min离心8min,菌体沉淀用超声波裂解缓冲液[200mmol/LNaCl,50mmol/LTris(pH7.5),5%甘油,5%Triton X-100,2mmol/LEDTA(pH8.0),0.2% β巯基乙醇]悬浮,于冰水浴中超声波裂解30min,功率30%,裂解液经4℃、12000r/min离心30min,沉淀(包涵体)蛋白溶于8mol/L尿素,分装,保存待检。
溶解于8mol/L尿素中的包涵体蛋白通过10%SDS-PAGE检测及分离纯化(电压130V,电流150mA,功率90W)。约电泳6h,溴酚蓝跑到胶面的最下端,取下凝胶,放入150mmol/L KCl中显色,当凝胶上出现明显条带时切下重组蛋白目的条带,放入12%SDS-PAGE的凝胶柱中电泳(20mA,4℃,15h),富集到与凝胶柱相连的盛有不含SDS的电泳液的回收杯中,收集蛋白回收液,加入叠氮化钠,分装,-20℃保存。
1.7 Western印迹
用载体蛋白和PV免疫动物血清抗体对重组蛋白进行Western印迹检测。用半干转印法将SDS-PAGE分离的凝胶上的嵌合蛋白转移至PVDF膜上(恒压15V,时间30min),用5%脱脂奶粉(TBS稀释)于4℃封闭过夜,加入抗VP6F或抗PV豚鼠免疫血清抗体(一抗,1∶500稀释),37℃孵育 1.5h,TBS-T(加入 0.05%Tween-20的TBS)漂洗5次,每次5min,加入HRP标记的羊抗豚鼠 IgG(二抗,1∶2000稀释),37℃孵育 1h;TBS-T漂洗5次,每次5min,将膜放入DAB溶液(10mg/mL,TBS稀释,使用前加入30%过氧化氢溶液)显色,蒸馏水漂洗终止显色,拍照。
2 结果
2.1 重组嵌合蛋白表达载体质粒的构建
用分子克隆手段构建载体蛋白VP6F表达质粒pETP6F及嵌合蛋白表达质粒pETP6F/PV3N1,经BlnⅠ/BamHⅠ双酶切鉴定,分别在相应位置可见约370和410bp的条带(图1),与预期相符,表明嵌合蛋白基因中成功插入PV3NAg1处的抗原表位基因。经DNA测序,确认所构建的质粒核苷酸序列完整正确。
2.2 重组嵌合蛋白在大肠杆菌BL21(DE3)中的表达和纯化
重组表达的载体蛋白VP6F和嵌合蛋白6F/PV3N1经SDS-PAGE分离,考马斯亮蓝染色后观察其蛋白相对分子质量,结果如图2。
2.3 Western印迹
载体蛋白VP6F免疫的豚鼠血清抗体能特异性结合载体蛋白VP6F和嵌合蛋白6F/PV3N1(图3A);轮状病毒Wa株免疫的豚鼠血清抗体能特异性结合载体蛋白VP6F和嵌合蛋白6F/PV3N1(图3B);PV3免疫的豚鼠血清抗体只能特异性结合嵌合蛋白6F/PV3N1(图3C);PV1免疫的豚鼠血清抗体无法特异性结合嵌合蛋白6F/PV3N1和载体蛋白VP6F(无条带,图未示)。
3 讨论
嵌合基因是指通过基因重组技术将来源不同的DNA序列重组而成的人造基因,将其通过载体转入宿主细胞表达产生的融合蛋白称为嵌合蛋白。在构建嵌合蛋白的过程中,我们首先选择A组人RVTB-Chen株的组抗原蛋白VP6的编码基因进行克隆,因为VP6蛋白是RV中含量最高、保守性最强的蛋白,在哺乳动物中其同源性可高达87%~99%[20],所以用它制备疫苗会产生较强的免疫原性。将VP6与空载体pETL重组后构建载体蛋白VP6F,再将PV3抗原表位NAg1插入载体蛋白VP6F,构建嵌合蛋白载体pET6F/PV3N1,将该载体转化大肠杆菌进行大量表达,获得嵌合蛋白6F/PV3N1。通过Western印迹可观察到6F/PV3N1可以与豚鼠抗载体蛋白VP6F血清抗体、抗轮状病毒Wa株血清抗体和抗PV3血清抗体产生特异性结合,但不能与抗PV1血清抗体产生反应,证明了6F/PV3N1的免疫原性和特异性,以及PV不同血清型间不产生交叉反应。该实验为RV和PV疫苗的发展提供了一定的基础。

图1 重组质粒BlnⅠ/BamHⅠ双酶切的琼脂糖凝胶电泳M:250bpDNAmarker;1:pETP6F;2:pETP6F/PV3N1
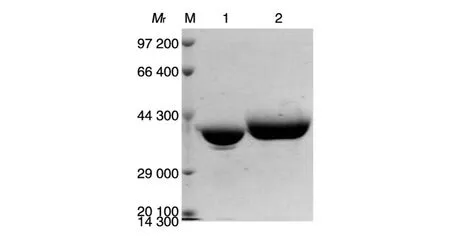
图2 载体蛋白和重组嵌合蛋白的SDS-PAGE

图3 VP6F(A)、轮状病毒Wa株(B)、PV(C)免疫豚鼠血清抗体的Western印迹
