苦玄参提取物中苦玄参苷ⅠA质量控制方法的建立
2018-06-13刘妍璨王秋华黄宏业段群棚林昌华蒋家霞胡庭俊
刘妍璨 ,王秋华 ,黄宏业 ,段群棚 ,林昌华 ,蒋家霞 ,张 宁 ,郭 旋 ,胡庭俊 ,何 颖
(1.广西大学动物科学技术学院,广西 南宁 530005;2.广西北斗星动物保健品有限公司,广西 南宁 530003;3.广西兽医生物技术重点实验室,广西 南宁 530001;4.广西农垦永新畜牧集团新兴有限公司,广西 柳州 545112;5.广西农垦永新畜牧集团金光有限公司,广西 南宁 530022)
苦玄参是玄参科植物苦玄参(Picria fel-tarrae)的干燥全草,别名苦草、蛇总管、四环素草。其味苦,性寒,具有清热解毒、消肿止痛的功能[1],是广西地区最有特色的中草药之一。现代药理研究表明:苦玄参具有中枢镇静、镇痛和安定作用[2],也有较好的抗炎、解热[3-6]和广谱抗菌、抗肿瘤等作用[7-8]。笔者所在课题组在前期研究中发现,将苦玄参提取物作为广西麻鸡饲料添加剂,可以显著提高广西麻鸡的生长性能、抗氧化性能和免疫器官指数,并且对停用后的鸡只生长还具有明显的促进作用[9-10]。苦玄参的有效成分主要为四环三萜苷类,其中又以苦玄参苷ⅠA和ⅠB为主[11-12]。为更好地控制苦玄参提取物的质量,保证临床疗效,应建立定性鉴别和定量测定方法。该研究在参考相关文献报道[13-14]的基础上,采用薄层层析技术(TLC)对苦玄参提取物中的苦玄参苷ⅠA(下文简称ⅠA)进行定性鉴别,利用高效液相色谱法(HPLC)对其进行定量分析,以期为提高和修订ⅠA的质量控制标准提供试验依据。
1 材料与方法
1.1 仪器
高效液相色谱仪(型号:LC-20A,日本岛津公司);电子分析天平(型号:BP211D,德国赛多利斯集团);超声仪(型号:B3200S-T,必能信超声有限公司);全自动薄层板器(型号:939,重庆南岸贝尔德仪器技术厂);色谱柱 [型号:Waters Symmetry C18(4.6×250 mm,5 μm),美国 Waters公司]。
1.2 主要试剂
ⅠA对照品(批号:111745-200501,购于中国食品药品检定研究院);苦玄参对照药材 (批号:121018-200904,购于中国食品药品检定研究院);硅胶G(化学纯,购于南宁恒鑫生物有限公司);乙酸乙酯、甲醇、甲酸、苯、香草醛、浓硫酸、盐酸、三氯甲烷(均为分析纯,购于南宁蓝天实验设备有限公司);乙腈、甲醇(均为色谱纯,购于南宁市恒鑫生物有限公司)。
1.3 试验药物
3个批次的苦玄参提取物 (批号分别为:20170908、20170915、20170922),由广西兽药制剂工程技术研究中心提供。
1.4 试验方法
1.4.1 鉴别法:称量苦玄参浸膏适量,取样量相当于药材 0.5 g,加乙酸乙酯—甲醇(5∶1)混合溶液25 mL,放入具塞锥形瓶中超声处理30 min,滤过,滤液蒸干,残渣加乙醇1 mL使其溶解,作为供试品溶液;此外,分别取苦玄参对照药材及ⅠA对照品,加乙醇制成每毫升含1 mg药品的溶液,作为对照药材及对照品溶液。按照参考文献[1]推荐的薄层色谱法试验方法,吸取上述2种溶液各3 μL,分别点于同一硅胶G薄层板上,以三氯甲烷—甲醇(4∶1)为展开剂,展开,取出,晾干,喷以 5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材及对照品色谱相应的位置上,显现相同颜色的斑点。
1.4.2 重复性考察:取3个批次的苦玄参提取物样品,按薄层鉴别标准方法进行检测,考查该方法的重复性。
1.4.3 含量测定
1.4.3.1 色谱条件:以十八烷基硅烷键合硅胶为填充剂,以乙腈—水(35∶65)为流动相,检测波长为264 nm,柱温 35℃,流速 1.0 mL/min,检测时间45 min,理论塔板数按ⅠA峰计算应不低于4 000,ⅠA含量不低于 2.5 mg/g。
1.4.3.2 对照品溶液的制备:取ⅠA对照品适量,精密称定,加甲醇制成每毫升约含0.1 mg药品的溶液,即得。
1.4.3.3 供试品溶液的制备:称取苦玄参浸膏适量(相当于药材1 g),过3号筛,精密称定,置具塞锥形瓶中,精密加入60%甲醇25 mL,密塞,称定重量,加热回流30 min,放冷,再称定重量,用60%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
1.4.3.4 测定:分别精密吸取对照品溶液、供试品溶液和阴性对照品溶液10 μL,注入液相色谱仪,测定,即得。本品按干燥品计算,ⅠA含量不得少于2.5 mg/g。
1.4.3.5 专属性试验:分别取ⅠA对照品溶液、供试品溶液、阴性样品溶液按色谱条件测定,考查方法的专属性。
1.4.3.6 线性考查试验:精密吸取上述对照品溶液 1、3、5、7、9 mL,分别置 10 mL 量瓶中,加甲醇至刻度,制成不同浓度对照品溶液,精密吸取上述不同浓度的对照品溶液各10 μL,注入液相色谱仪,在色谱条件下测定,记录峰面积,以对照品浓度为横坐标(x),峰面积为纵坐标(y),绘制苦玄参苷标准曲线,求出ⅠA的线性方程,考查ⅠA在规定浓度范围内的线性关系。
1.4.3.7 回收率试验:精密称取已知含量的同一批号苦玄参提取物供试品,称取3份颗粒样品,分别加入3个不同浓度的ⅠA对照品溶液各1 mL,平行3份,再按供试品制备方法处理,按标准的色谱条件测定,记录峰面积,按峰面积计算每份样品的ⅠA含量,分别计算回收率(%)和相对标准偏差RSD(%)。
1.4.3.8 精密度试验
1.4.3.8.1 重复性试验:精密称取同一批号苦玄参提取物供试品,平行6份,按“1.4.3.3”项下方法制备供试品溶液,再按标准的色谱条件测定,分别记录峰面积,分别根据其峰面积计算相对标准偏差RSD(%)。
1.4.3.8.2 中间精密度试验:在同一个实验室,不同时间由不同分析人员用不同设备测定结果之间的精密度。
1.4.3.9 稳定性试验:取同一批号苦玄参提取物供试品,按“1.4.3.3”项下方法制备供试品溶液,分别在第 0、4、8、12、16、20、24 h 进样 1 次,每次进样10 μL,测定ⅠA的峰面积,考查其稳定性。
1.4.3.10 样品测定:按色谱条件方法测定3批苦玄参提取物样品的含量,计算ⅠA的含量。
1.5 结果评价
以鉴别试验中的专属性、重复性结果以及含量测定中的专属性、线性、回收率、精密度、稳定性和样品测定结果为评价指标,验证所采用的苦玄参提取物质量标准分析方法的可靠性。
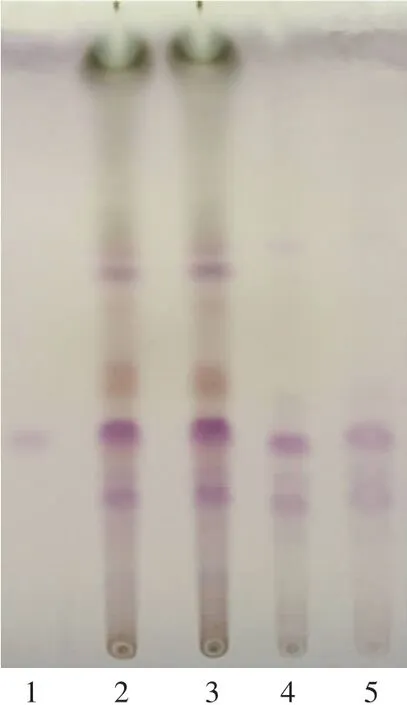
图1 苦玄参提取物中苦玄参鉴别薄层色谱图
2 结果与分析
2.1 鉴别法
经试验证明,利用薄层色谱法鉴别苦玄参是可行的。对3个批次的苦玄参提取物按标准规定的薄层鉴别方法进行检测,结果显示(见图1),在薄层色谱中,3批供试品在与ⅠA对照品及苦玄参对照药材相应的位置上,显现相同颜色的荧光斑点,背景清晰,分离效果好,无干扰,结果易判断,符合薄层色谱系统适用性检验。因此,该项定性鉴别方法对供试品的处理及展开系统的选择是合理的,说明对苦玄参的薄层鉴别已具备专属性,故可作为标准中苦玄参的鉴别方法。
2.2 含量测定
2.2.1 ⅠA含量分析方法的建立
2.2.1.1 波长的选择:取ⅠA对照品,经UV检测器在200~300 nm内进行紫外扫描,结果显示(见图2),ⅠA在260 nm波长附近有最大吸收值。参照参考文献[1]收载的“苦玄参”含量测定项下的波长,选择264 nm为该试验测定波长。
2.2.1.2 系统适应性试验及专属性试验:取苦玄参提取物供试品溶液及对照品溶液,按“1.4.3.1”项下色谱条件分别测定。结果表明(见图3),供试品中ⅠA与相邻峰的分离度良好 (均大于1.5);理论塔板数按ⅠA色谱峰计算,为14 000;阴性样品对测定无干扰,说明方法的专属性良好。
2.2.1.3 线性和范围考察试验:以峰面积积分值y(取平均值)为纵坐标,以对照品浓度x(μg/mL)为横坐标进行回归分析。由表1可知,得到ⅠA的回归方程为:y=7645.5x+18364,R2=0.9992。结果表明,ⅠA在20.06~104.10 μg/mL内线性关系良好。
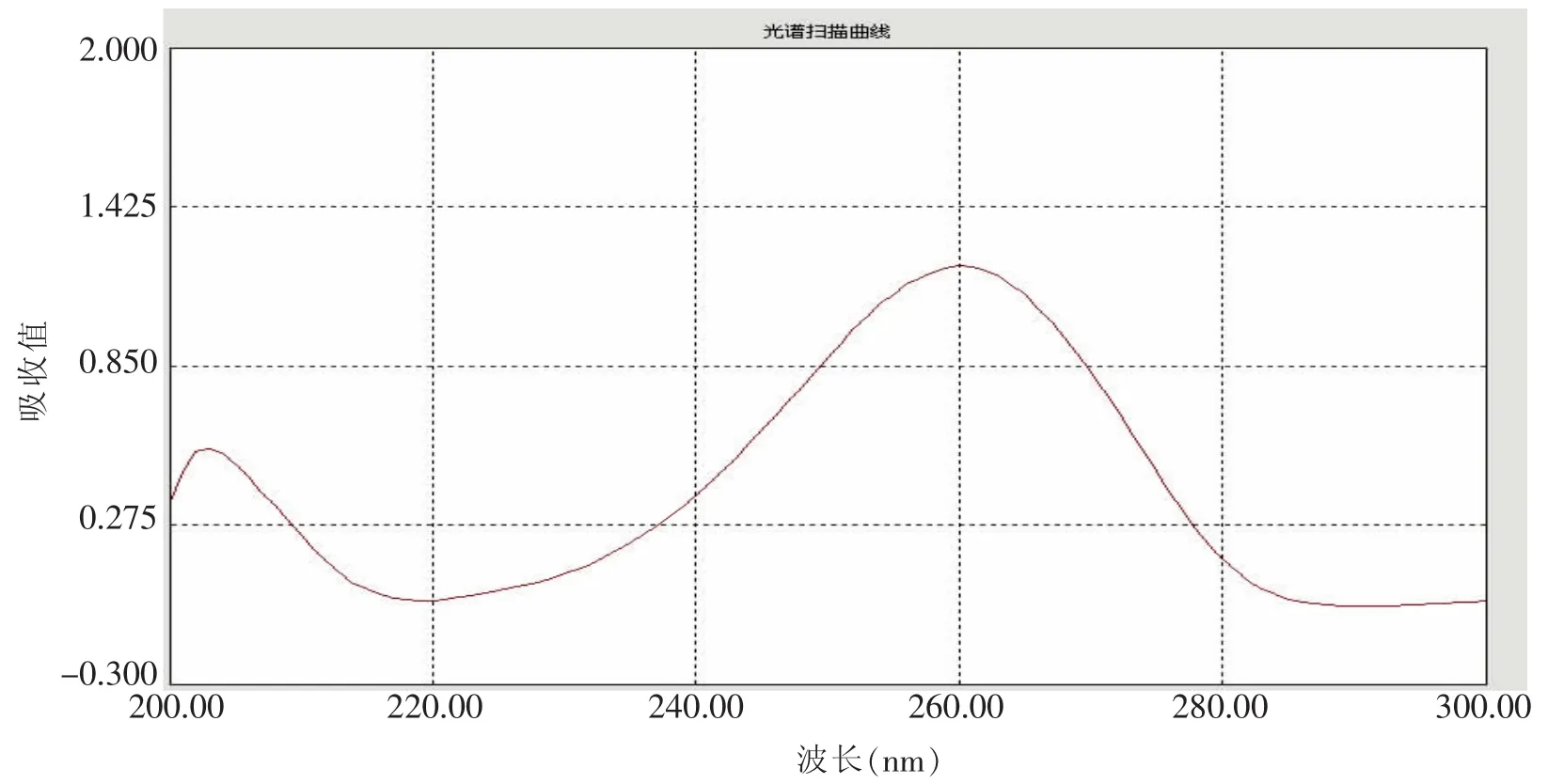
图2 苦玄参苷光谱扫描曲线图
2.2.1.4 仪器精密度试验
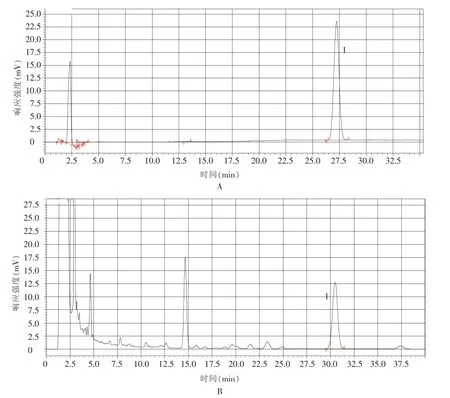
图3 系统适应性试验及方法专属性考察色谱图
2.2.1.4.1 重复性试验:在相同操作条件下,由一个分析人员在较短的间隔时间内测定所得结果的精密度。取同一份苦玄参提取物样品 (批号:20170908),精密称定0.5 g,制备供试品溶液,并依照色谱条件连续进样6次进行测定,计算所含苦玄参苷的含量并统计RSD。由表2可知,样品中ⅠA的平均含量为19.18 mg/g,RSD为0.002%。结果表明,仪器的精密度良好。
2.2.1.4.2 中间精密度试验:在同一实验室,不同时间由不同分析人员用不同设备测定结果之间的精密度。取同一份苦玄参提取物样品 (批号:20170908),充分研碎,精密称定0.5 g,依照上述方法制得供试品溶液,并依照“1.4.3.1”项下所述色谱条件连续进样6次进行测定,计算所含ⅠA的含量并统计RSD。由表3可知,样品中ⅠA的平均含量为19.20 mg/g,RSD为0.001%。结果表明,仪器的精密度良好。
2.2.1.5 稳定性试验:取同一份苦玄参提取物样品(批号:20170908),精密称定 0.5 g,依照上述方法制得供试品溶液,分别于室温下[温度为(25±2)℃,湿度为(60±10)%]放置 0、4、8、12、16、20、24 h,然后依照“1.4.3.1”项下所述色谱条件测定,计算ⅠA的含量并统计RSD。由表4可知,24 h内苦玄参提取物供试品中ⅠA的平均含量为3.04 mg/g,RSD为0.02%。结果表明,供试品溶液在室温下24 h内稳定。

表1 不同浓度的苦玄参苷对照品的峰面积
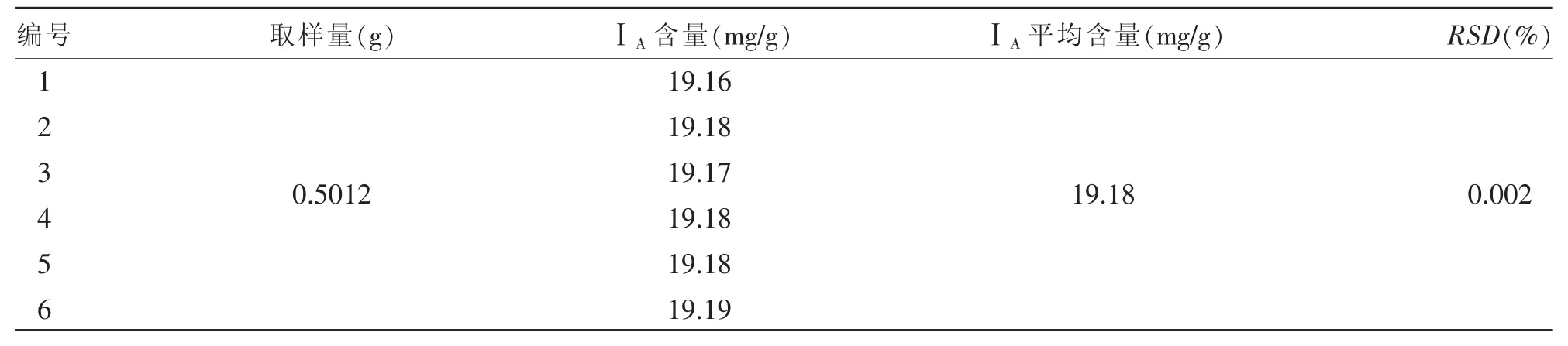
表2 ⅠA重复性试验结果(n=6)
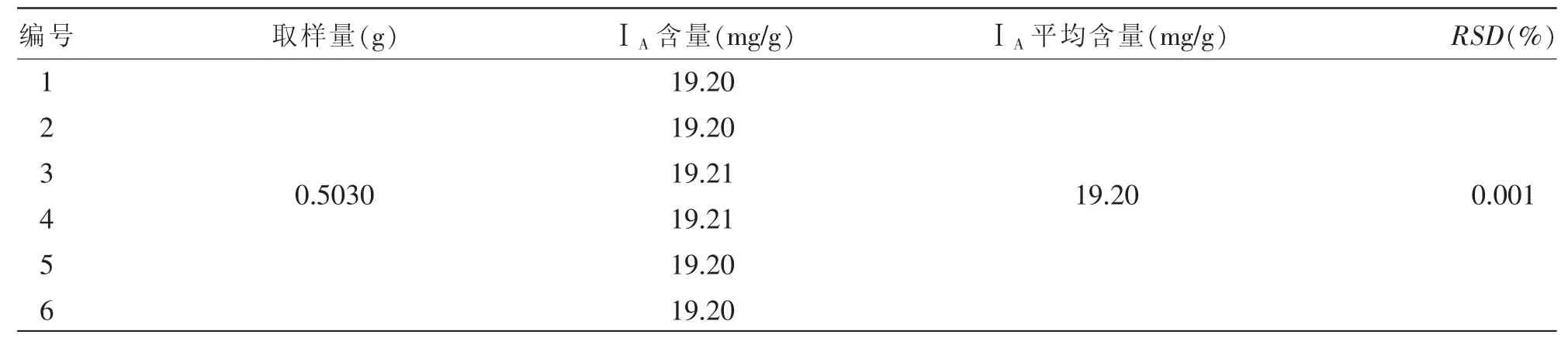
表3 ⅠA的中间精密度试验结果(n=6)

表4 ⅠA的稳定性试验结果(24 h)
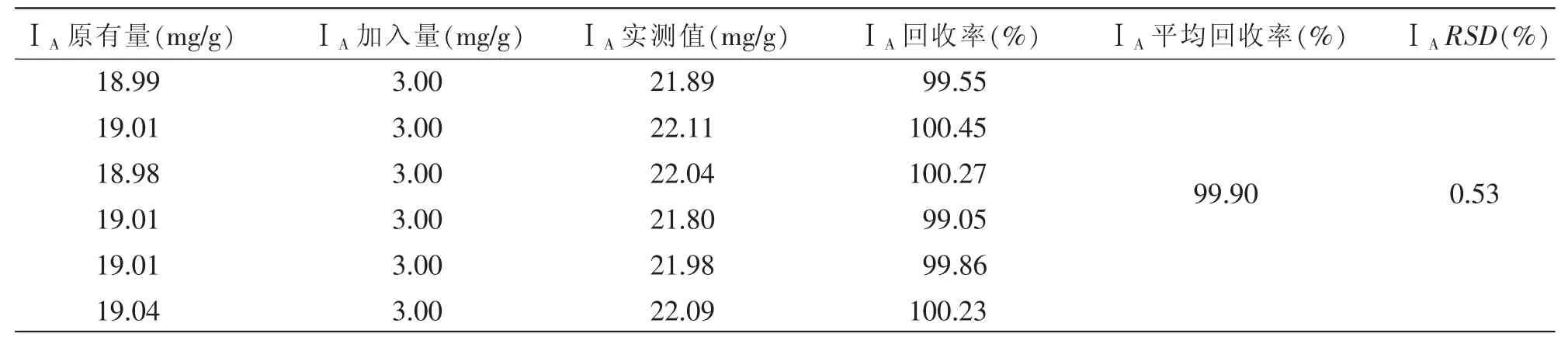
表5 ⅠA加样回收率试验结果(n=6)
2.2.1.6 方法准确度(加样回收率)试验:取已知含量的苦玄参提取物 (批号:20170908),称取约0.1 g,平行6份,分别精密加入已知浓度的对照品溶液适量,配制供试品溶液,然后依照“1.4.3.1”项下所述色谱条件测定。由表5可知,ⅠA的平均回收率为99.90%,RSD为0.53%(n=6)。结果表明,该方法用于苦玄参提取物中ⅠA含量测定的准确度良好。
2.2.1.7 样品测定:取不同批次的苦玄参提取物样品,分别精密称取0.5 g,配制供试品溶液,然后依照 “1.4.3.1”项下所述色谱条件测定,批号20170908、20170915和20170922的样品中ⅠA的含量分别为19.06、19.11、18.99 mg/g。 按照3批样品计算,以均值的80%作为含量下限,每批苦玄参提取物中ⅠA含量应不少于15.24 mg/g。
3 讨论
关于苦玄参的薄层色谱鉴定方法,该研究参照《中国药典》(2015 年版 1 部)[1]收载的药材苦玄参的薄层鉴别方法。用该方法进行苦玄参提取物中ⅠA的薄层鉴别,分离效果较好,该法对苦玄参的鉴别符合专属性、重复性及系统适应性试验要求,可作为标准中苦玄参的鉴别方法。
关于苦玄参的HPLC鉴定方法,该研究参照相关文献资料[1,13-18]报道,建立了苦玄参苷ⅠA的含量测定方法。对于提取条件的选择,该研究在ⅠA供试液制备方法考察中,选择了碱提取法(pH值=11),提取3次,提取时间1 h,优选的提取工艺稳定性好,合理可行。该方法对ⅠA对照品的紫外吸收光谱 (200~300 nm)测定结果表明,ⅠA在260 nm附近有强吸收。为能灵敏地检出上述成分,选择264 nm作为检测波长。该研究考查了不同比例的乙腈—水流动相系统,结果表明,选择采用乙腈—水(35∶65)作为流动相,具有峰形及分离度良好、出峰时间快等优点。结果显示,供试品在该色谱条件下,ⅠA的峰纯度良好,未与其他峰混杂,专属性好。
4 结论
该研究建立了苦玄参提取物薄层色谱鉴定方法,该方法分离效果好,专属性强,重复性高;建立了苦玄参提取物中ⅠA含量测定的HPLC分析方法,该方法快速简便,结果准确,专属性强,精密度高,可用于苦玄参提取物中指标性成分ⅠA的含量测定。
[1]国家药典委员会.中华人民共和国药典:一部[M].2015年版.北京:中国医药科技出版社,2015.
[2]张银娣,刘小浩,沈建平.绵毛黄芪苷和苦玄参苷的中枢抑制作用[J].南京医学院学报,1990,10(1):17-19.
[3]周芳,李萍,陈勇,等.苦玄参干浸膏抗炎镇痛作用的实验研究 [J]. 中国中医药科技,2006,13 (4):244-245.
[4]陈君,甄汉深,韦建华.苦玄参叶抗炎药理作用研究[J].海峡药学,2013,25(2):23-25.
[5]吴建璋,文永新,黄永林,等.苦玄参提取物对小鼠的抗炎及镇痛作用 [J].中国医院药学杂志,2012,32(16):1303-1304.
[6]曾金强,潘小姣,杨柯.苦玄参不同提取部位抑制2215细胞分泌 HBe Ag和 HBs Ag的实验研究[J].中国医药导报,2010,16(7):27-29.
[7]黄燕,肖艳芬,甄汉深,等.苦玄参体外抗菌作用的实验研究[J].广西中医药,2008,31(1):46-47.
[8]秦秀霞.苦玄参药理研究进展 [J].亚太传统医药,2014,10(2):41-42.
[9]杨翠,廖玉英,韦凤英,等.苦玄参提取物对广西麻鸡生长性能及免疫器官指数的影响[J].粮食与饲料工业,2016,14(9):53-56.
[10]杨翠,胡庭俊,杨剑,等.苦玄参提取物对广西麻鸡血清生化指标及免疫功能的影响 [J].中国畜牧兽医,2017,44(1):65-73.
[11]岑菲菲,甄汉深,宋志华.苦玄参化学成分和定量分析研究进展 [J]. 时珍国医国药,2008,19 (2):290-292.
[12]黄永林,陈月圆,文永新,等.苦玄参的化学成分研究[J].广西植物,2010(6):887-890.
[13]李玲,金李峰.HPLC法测定不同产地苦玄参中3种成分的含量[J].中药材,2016,39(2):355-357.
[14]张新建,郭美华,马妍妍,等.RP-HPLC法测定清炎滴丸中苦玄参苷ⅠA的含量 [J].中华中医药学刊,2014,32(10):2425-2427.
[15]丘琴,苏春妹,甄汉深,等.不同生产期苦玄参中苦玄参苷ⅠA含量测定[J].中国实验方剂学杂志,2013,19(5):108-110.
[16]邹节明,吴敏菊,王力生.苦玄参HPLC指纹图谱研究[J].中国药学杂志,2005,40(9):664-666.
[17]方宏,梁小燕,宁德生,等.苦玄参药材中苦玄参苷ⅠA和ⅠB的含量分析[J].广西植物,2008,28(5):708-710.
[18]聂海英,唐廷崇,杨善忠,等.复方苦玄参颗粒提取工艺的优化[J].动物医学进展,2017,38(5):49-52.
