芘丁酸与牛血清白蛋白作用的荧光光谱研究
2018-06-13王丽芳
王丽芳
(吕梁学院 化学系,山西 吕梁 033000)
芘丁酸(pyrenebutyric acid,PBA)具有较强的荧光强度,化学性质稳定,极性小,制成敏感膜后不易向水中泄漏。因此是制备光纤化学传感器的一种理想分子探针[1]。在医药领域中,以芘丁酸为分子探针的光纤化学传感器可用于片剂和胶囊的体外溶出度监测及清醒动物尿药和脑脊液药物浓度的监测[2]。芘丁酸还可以用来合成荧光化学敏感器,应用于超分子化学领域的分子识别[3]。研究芘丁酸与牛血清白蛋白(BSA)间作用可获取其在体内被转运、分配和代谢过程的重要信息,在蛋白质检验、药物药理和毒理研究、污染毒物的危害机理及基因变异研究等方面具有重要意义。
本文通过荧光光谱技术,研究芘丁酸与牛血清白蛋白(BSA)间的相互作用。
1 实验部分
1.1 仪器和试剂
牛血清白蛋白(生化试剂,中国科学院生物化学研究所);芘丁酸(Sigma公司);三羟甲基氨基甲烷,盐酸,氢氧化钠等均为分析纯;二次蒸馏水;HITACHI 850型荧光分光光度计,HP8453 UV-Vis吸收光谱仪,Beckman酸度计,Finnpipette加样器。
1.2 实验方法
1.2.1 储备液的配制
配制 0.05 mol·L-1Tris-HCl缓冲液(内含0.15 mol·L-1NaCl,pH 7.4),然后,用该溶液配制BSA溶液。BSA的浓度通过测定278 nm处的吸光度确定(ε = 43, 000 cm-1·mol-1·L)[4]。
1.2.2 荧光光谱的测定
移取2 mL BSA于1 cm石英池中,用可调式移液器逐次加入芘丁酸(PBA)水溶液进行荧光滴定,每次加入溶液后混合均匀,以 290 nm为激发波长,在HITACHI 850 型荧光分光光度计上记录310~580 nm波长范围内的发射光谱。文中所用荧光强度均为考虑稀释效应后的值。
1.2.3 吸收光谱的测定
吸收光谱在 HP8453 UV-Vis吸收光谱仪上使用1 cm吸收池测定。
2 结果与讨论
2.1 芘丁酸对BSA荧光猝灭的机理

图1 PBA对BSA荧光光谱的影响
图1中a为BSA的荧光发射谱。由a线可见,BSA在343 nm处出现最大荧光峰,说明BSA的荧光是Trp残基的荧光峰[5]。用PBA溶液滴定BSA,其343 nm处的荧光峰被逐渐猝灭,同时在377 nm及395nm处又出现新的发射峰,且在370 nm处存在一个等发射点,如图1中b-h所示。PBA的加入使BSA的荧光被有规律地猝灭,其发射峰位置不变。说明二者发生了相互作用,PBA的加入对BSA分子的构象没有明显影响。
荧光猝灭过程通常可以分为两种:一种是动态猝灭,另一种是静态猝灭。动态猝灭过程遵循Stern-Volmer方程[6]:

图2 η = log[(F0-F)/F]与 log[PBA]的关系图

对于静态猝灭,荧光强度与猝灭剂的关系满足双倒数方程[7]
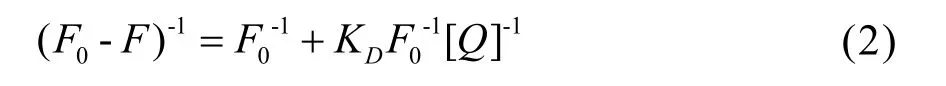
对于蛋白质与小分子的静态猝灭,结合位点数可由荧光分子与猝灭剂的结合常数表达式推导求出,即:

图2 是实验数据按(3)式处理得到的曲线。
由图2可见,三条曲线均呈良好的线性关系,且随温度升高,直线斜率减小,猝灭过程应为静态猝灭。
表 1是由 Stern-volmer曲线拟合得到的 Ksv和Kq数据。

表1 Stern-volmer曲线拟合得到的Ksv和Kq数据
从表1看出Ksv均大于104mol-1·L。生物大分子荧光平均寿命τ0大约为 10-8s[6],从表中可以看出 Kq均大于1012mol-1·L,各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数为 2.0×1010s-1·mol-1·L[6]。显然,PBA 对 BSA 荧光猝灭的速率远大于扩散控制的Kq。由此可以推断,猝灭过程为形成化合物所引起的静态猝灭,不是由于分子碰撞所引起的动态猝灭。
2.2 芘丁酸与 BSA的结合位点数 n、结合稳定常数K
由图2线性拟合方程斜率可以得到结合位点数 n,所得结果列于表 2。利用静态猝灭的双倒数方程(2)式处理实验数据,计算PBA与BSA的结合稳定常数K=1/KD,结果亦列于表2。
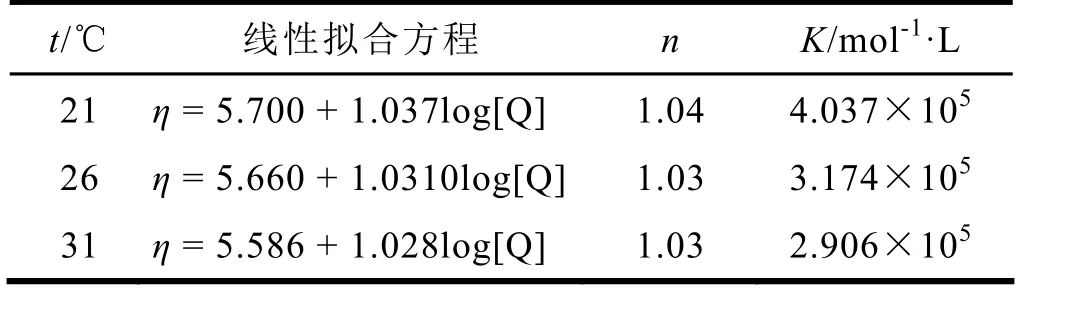
表2 不同温度下线性拟合方程和结合位点数n
由表2可知,PBA与BSA结合形成较稳定的配合物,结合位点数为1,而且K值随温度的升高而降低,说明二者的结合稳定性随温度的升高而减弱。
2.3 芘丁酸和BSA色氨酸残基间距离
前文述及,BSA的荧光主要是来自色氨酸。根据 Förster无辐射能量转移理论,可以计算有机小分子与色氨酸残基之间的距离。
比较PBA的吸收光谱与BSA的荧光发射光谱,发现两者有不同程度的重叠(见图3)。根据 Förster型偶极-偶极无辐射能量转移机理[7],求得光谱的重叠积分 J=1.15×10-13cm3·L·mol-1。在上述实验条件下,参照文献[7],以色氨酸为标准物(φ= 0.14),测得BSA中色氨酸量子效率ΦD为0.118,取向因子取给体-受体各向随机分布的平均值K2= 2/3,折射指数n取水和有机物平均值 1.336,求得 R0为 3.68 nm。再通过 PBA与BSA摩尔比为1:1时配合物的荧光强度,计算得到能量转移效率E = 0.43,求得PBA距色氨酸残基最短距离为r = 3.86 nm。

图3 BSA的荧光光谱和PBA的吸收光谱
2.4 芘丁酸与BSA作用的热力学性质
小分子与蛋白质间的作用力主要包括以下几种类型:氢键、范德华力、静电因力、疏水作用力。根据热力学参数与作用力的关系,可以确定其作用力类型、当温度变化不大时,反应的焓变ΔH可以看作一个常数,改变温度,求得不同温度下的结合常数,根据公式即可求得ΔH、ΔG、ΔS。

由 PBA与 BSA的猝灭过程所得的结合常数,求得不同温度下的ΔH、ΔG、ΔS,列于表3。
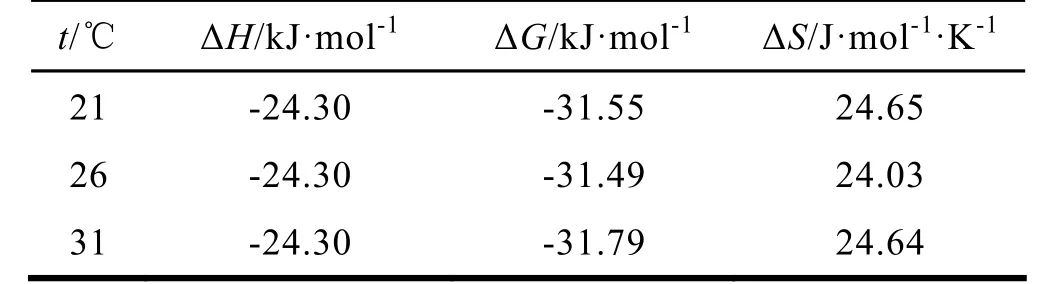
表3 PBA与BSA结合过程的热力学参数
Ross等认为,在很多情况下,即使ΔH<0,蛋白质和一些小分子之间,主要作用力仍为疏水作用力[8]。对于实际体系中,其宏观表现往往是几种作用力同时作用的结果。因此,PBA与BSA可能主要以疏水作用力结合,同时也包括其他作用力。
3 结论
以芘丁酸滴定牛血清白蛋白,BSA的荧光被有规律的猝灭,两者之间的作用为单一的荧光静态猝灭过程。PBA的加入对BSA分子的构象没有明显影响。二者以摩尔比 1:1结合。BSA 与PBA主要依靠疏水作用力结合形成配合物。当在合适的激发波长扫描 BSA与芘丁酸的复合体系的荧光光谱时,它们之间能发生能量转移,能量转移给体(BSA分子中色氨酸残基)与受体(PBA)之间的距离为3.86 nm。
[1] 陈坚,朱滨,袁立懋,等.基于荧光猝灭原理的光纤化学传感器研究:II.比较五种分子探针制成敏感膜的动力学猝灭性质[J].新疆医学院学报,1993,16(4):303-307.
[2] 陈坚,李伟,阎超,等.基于多猝灭响应原理的 PBA 光纤化学膜传感器的性能和应用研究[J].中国科学(C辑),1997,27(1):69-76.
[3] 李华平,汪鹏飞,吴世康.含芘荧光化学敏感器及其与核苷磷酸盐的相互作用[J].中国科学(B辑)1999,29(3):229-237.
[4] Zhang Y, Wilcox D E. Thermodynamic and spectroscopic study of Cu(II) and Ni(II) binding to bovine serum albumin[J]. J Biol Inorg Chem, 2002, (7): 327-337.
[5] 魏永巨.蛋白质分子吸收与散射光谱探针的研究[D].北京:北京大学,1996:11-12.
[6] 刘雪锋,夏咏梅,方云,等.三种香豆素类中药小分子与牛血清白蛋白的相互作用[J].化学学报,2004,62(16):1484-1490.
[7] 杨斌盛,杨频.稀土离子与人血清白蛋白的作用[J].生物化学与生物物理学报,1988,20(5):499-503.
[8] Philip D. Ross, S. Subramanian. Thermodynamics of protein association reactions: forces contributingto stability[J]. Biochemistry, 1981, 20(11): 3096-3102.
