新型培美曲塞衍生物对A549细胞增殖、迁移及细胞凋亡的影响
2018-06-13刘秀贾玉萍贾庆文郭中坤王可洲卢美超刘莎袁栋栋
刘秀,贾玉萍,贾庆文,郭中坤,王可洲,卢美超,刘莎,袁栋栋
新型培美曲塞衍生物对A549细胞增殖、迁移及细胞凋亡的影响
刘秀,贾玉萍,贾庆文,郭中坤,王可洲,卢美超,刘莎,袁栋栋
250200 济南大学/山东省医学科学院医学与生命科学学院(刘秀、郭中坤、王可洲);250101 济南,山东省药学科学院(贾玉萍、贾庆文、卢美超、刘莎、袁栋栋);250002 济南,山东省医学科学院山东省实验动物中心(郭中坤、王可洲)
探究新型培美曲塞(PMX)衍生物对 A549 细胞增殖、迁移及细胞凋亡的影响。
MTT 法初步筛选 12 种化合物对 A549 细胞的细胞毒性,筛选出高活性候选化合物进一步研究其对A549 细胞增殖的影响;Transwell 细胞迁移实验及划痕愈合实验测定候选化合物对 A549 细胞迁移的影响;流式细胞术测定候选化合物对 A549 细胞凋亡的影响。
初筛发现其中 9 种化合物对 A549 细胞增殖具有抑制作用,其中化合物 A12 抑制作用最为显著,IC50为(1.26 ± 0.15)μmol/L,且抑制作用存在浓度及作用时间依赖性:IC50在作用 72 h 处最低,为(1.06 ± 0.24)μmol/L;Transwell 细胞迁移实验及划痕愈合实验结果表明 A12 能够抑制 A549 细胞的迁移能力,且抑制作用具有浓度依赖性;流式细胞术实验结果显示 A12 能够显著提高 A549 细胞的早期凋亡率(< 0.05)、晚期凋亡坏死率(< 0.01)及总凋亡率(< 0.05)。
筛选得到的新型 PMX 衍生物 A12 能够明显抑制 A549 细胞的增殖及迁移活性,并能诱导其凋亡。
细胞增殖; 细胞迁移抑制; 细胞凋亡; 培美曲塞衍生物; A549 细胞
二氢叶酸还原酶(dihydrofolate reductase,DHFR)是叶酸代谢过程中必不可少的酶,能够催化二氢叶酸转化为四氢叶酸,进而参与生物合成。DHFR 抑制剂能选择性地与 DHFR结合,阻止或抑制正常底物与酶的结合,阻碍叶酸代谢,最终导致细胞死亡,从而达到治疗肿瘤等目的[1]。近年来,由于其明显的活性,DHFR 抑制剂在对抗一些病原体和肿瘤细胞方面引起了广泛的研究[2]。培美曲塞(pemetrexed,PMX)作为 DHFR 抑制剂的常用药物之一,主要用于恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)及非小细胞肺癌(non-small-cell lung cancer,NSCLC)的二线治疗[3-4]。为了检测新型培美曲塞衍生物对人肺癌细胞 A549 细胞的毒性,以及筛选出合适的化合物及浓度进行后续机制研究,本文首先采用 MTT 法检测了不同浓度的不同化合物对 A549 细胞活力的影响,从中选择一种化合物,并选择其合适的浓度进行细胞迁移实验、划痕愈合实验及流式细胞术实验,从而检测该浓度的化合物是否对 A549 细胞的迁移活力及细胞凋亡存在影响。
1 材料和方法
1.1 试剂与器材
1.1.1 试剂 RPMI1640 培养基为赛默飞世尔仪器有限公司产品;新生牛血清为浙江天杭生物科技股份有限公司产品;MTT 为 Biosharp 公司产品;DMSO、甲醇(分析纯)为国药集团化学试剂有限公司产品;青链霉素混合液(100 ×)、胰蛋白酶-EDTA 消化液、吉姆萨染液、Annexin V-FITC/PI 凋亡检测试剂盒为 Solarbio 公司产品;氟尿嘧啶注射液(5-Fu)为上海旭东海普药业有限公司产品。
1.1.2 器材 Transwell、96 孔细胞培养板购自美国 Costar 公司;水套式 CO2培养箱购自赛默飞世尔科技公司;SW-CJ-2FXS 超净工作台购自苏州佳宝净化工程设备有限公司;Spectra Max I3 多功能酶标仪购自美国 MD 公司;倒置生物显微镜购自重庆奥特光学仪器有限公司;Guava easy cyte 6 HT-2L 流式细胞仪购自美国默克密理博公司;常温低速离心机购自安徽嘉文仪器装备有限公司;ZD-9556 水平摇床购自太仓市科教器材厂。
1.2 方法
1.2.1 细胞培养 A549 细胞培养于含有 10% 新生牛血清、100 U/ml 青霉素和 100 μg/ml 链霉素的 RPMI1640 培养基中,置于 37 ℃、5% CO2、饱和湿度细胞培养箱中培养,取对数生长期细胞用于实验[5]。
1.2.2 MTT 法检测化合物(A1 ~ A12)对 A549 细胞的毒性 取处于对数生长期的 A549 细胞,消化离心之后,调整细胞浓度至 5 × 104个/ml,取 100 μl 接种于 96 孔板中。待细胞贴壁后,各孔分别加入对应化合物 100 μl,使终浓度分别为 200、40、8、1.6、0.32 μmol/L,每组设 3 个复孔,同时设阴性对照孔(PMX)、阳性对照孔(5-Fu),96 孔板四周孔用培养基填充。加药完毕,96 孔板置于 5% CO2、37 ℃培养箱中培养 44 h 后,每孔加入5 mg/ml MTT 溶液 10 μl,继续培养 4 h 后,小心吸去上清,加入 DMSO 100 μl,振荡 5 min。用酶标仪测定振荡之后的 96 孔板在 570 nm 处的光密度值(570 nm)。计算各个化合物对 A549 细胞的增殖抑制率及 IC50[6-7]。
1.2.3 化合物不同作用时间对 A549 细胞毒性及细胞形态观察 根据 MTT 实验结果挑选出一种化合物,并进行不同作用时间(8、24、48、72 h)MTT 实验,各孔终浓度为 8、4、2、1、0.5、0.25、0.125 μmol/L,在加入 MTT 溶液之前,将 96 孔板置于倒置显微镜下观察细胞形态[8]。
1.2.4 Transwell 细胞迁移实验 取对数生长期细胞消化计数,用无血清 RPMI1640 培养基调整浓度为 5 × 105个/ml。上室分别加入 200 μl 含有不同药物浓度(A12:1、0.5、0.25、0.125、0 μmol/L,5-Fu:1 μmol/L)的细胞悬液;下室加入 800 μl 含 10%新生牛血清的 RPMI1640 培养基,药物终浓度与上室相同,在 37 ℃、5 % CO2培养箱中培养,8 h 后用镊子小心取出上室,吸干上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞,移到预先加入 800 μl 甲醇的孔中,室温固定 30 min;取出上室,吸干固定液,移到预先加入 800 μl 吉姆萨染液的孔中,室温染色 30 min;轻轻用纯水冲洗浸泡数次,取出上室,吸去上室液体,在倒置显微镜下随机选取 6 个视野拍照计数[9]。
1.2.5 划痕愈合实验 6 孔细胞培养板在使用前,预先用水性笔在底部划 5 条平行直线作为位置标识。取对数生长期细胞,用新鲜培养基调整细胞密度为 1 × 105个/ml,铺于 6 孔细胞培养板,每孔 1 ml 细胞,放入培养箱中培养 24 h 后,观察细胞呈现融合生长状态,进行划痕。吸去培养液,用 100 μl 无菌枪头在各孔底部均匀地划 2 条与所划标识垂直的直线。划痕结束后用 PBS清洗3 遍,以去除划下的细胞。各孔分别加入不同浓度的药物(A12:1 μmol/L;5-Fu:1 μmol/L),同时设阴性对照组,每个浓度设 3 个复孔。在倒置荧光显微镜下观察拍照,此时间点设置为 0 h,6 孔细胞培养板置于培养箱培养 24 h 后,再拍照并观察划痕愈合程度[10]。
1.2.6 流式细胞术分析细胞凋亡的变化 用新鲜培养基调整细胞密度为 1 × 105个/ml,铺于 6 孔细胞培养板,每孔 1 ml 细胞,贴壁后向每孔加入含有相应药物的培养基,设阴性对照组、药物处理组(A12 终浓度分别为 1 μmol/L、0.5 μmol/L),阳性对照组(5-Fu)终浓度为 1 μmol/L,加药完毕后置于培养箱中培养。48 h 后小心收集细胞培养液至 10 ml 离心管中,PBS 清洗 2 遍后,胰蛋白酶-EDTA 消化液消化,细胞变圆后加入前面收集的细胞培养液,轻轻将细胞从培养瓶壁吹打下来,再次收集,1000 r/min 离心 5 min,小心吸除上清,加入预冷 PBS,重悬洗涤细胞,再次离心,小心吸除上清。加入 1 ml 染色缓冲液(1 ×)重悬细胞,1000 r/min 离心 5 min,小心吸除上清,加入适量染色缓冲液(1 ×)重悬细胞,使细胞密度达到 1 × 106个/ml。取 100 μl 细胞悬液于 1.5 ml 离心管中。向 1.5 ml 离心管中加入 5 μl Annexin V-FITC,轻轻混匀,室温避光染色 10 min 后,加入 5 μl PI 染液,轻轻混匀后室温避光孵育 5 min。加入染色缓冲液(1 ×)至 500 μl,轻轻混匀。在染色后 1 h 内用流式细胞仪检测,Annexin V-FITC 是绿色荧光,PI 是红色荧光[11-12]。
1.3 统计学处理
2 结果
2.1 MTT 法检测细胞毒性结果
化合物对 A549 细胞作用 48 h 后,MTT 法检测各个化合物的细胞毒性,结果表明化合物 A1、A6、A7、PMX 对 A549 细胞增殖无抑制作用(IC50> 200 μmol/L),其余化合物存在不同程度的抑制作用,其中 A12 对 A549 细胞增殖的抑制作用较明显[IC50=(1.26 ± 0.15)μmol/L],且强于 5-Fu[IC50=(6.27 ± 2.29)μmol/L],由此选用化合物 A12 进行后续实验,具体数值如表 1 所示。
2.2 化合物 A12不同作用时间对 A549 细胞毒性与形态的影响
PMX 衍生物 A12 进行不同作用时间(8、24、48、72 h)MTT 实验并拍照,结果如表 2 所示。A12 对 A549 细胞增殖存在明显的抑制作用,且抑制作用存在浓度及作用时间依赖性:细胞存活率随着浓度的提高而降低,IC50在作用 72 h 处最低,为(1.06 ± 0.24)μmol/L。通过倒置显微镜观察各孔的细胞形态,阴性对照孔细胞边缘整齐,细胞生长状态良好;A12 处理后的 A549 细胞数明显少于阴性对照组,有极少部分细胞体积变小、形态变圆,而 5-Fu 处理后的 A549 细胞,不仅细胞数少,还出现染色质固缩及明显的细胞核形态改变。
2.3 Transwell 细胞迁移实验结果
化合物 A12 不同浓度作用 8 h 后,对 A549 细胞迁移能力影响结果如图 1 及图 2所示:阴性对照组细胞迁移数为(183.75 ± 2.71)个,A121、0.5、0.25、0.125 μmol/L 组细胞迁移数分别为 74.25 ± 1.30、105.17 ± 0.24、112.92 ± 0.35、140.25 ± 1.30 个,迁移抑制率分别为 59.59%、42.77%、38.55%、23.67%,阳性对照组(5-Fu 1 μmol/L)细胞迁移数83.42 ± 0.12 个,迁移抑制率为 54.60%。随着作用药物浓度的提高,迁移至膜底部的细胞数逐渐减少,迁移抑制率逐渐提高,且相同作用浓度下,化合物 A12 抑制迁移结果优于 5-Fu,此结果表明化合物 A12 能够有效抑制 A549 细胞的迁移,且抑制作用具有浓度依赖性。
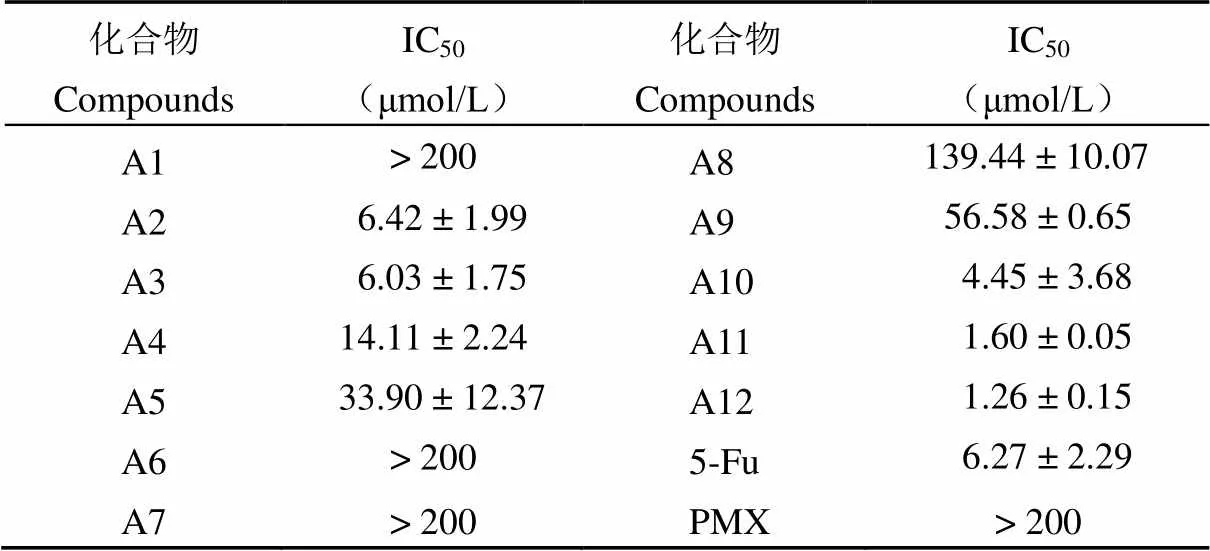
表 1 化合物对 A549 细胞增殖的抑制作用初筛结果
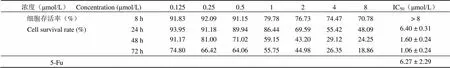
表 2 不同作用时间点化合物 A12 对 A549 细胞的增殖活性抑制结果
Figure 1 Effect of compound A12 on the migration of A549 cells (A: Negative control group; B: 1 μmol/L group; C: 0.5 μmol/L group; D: 0.25 μmol/L group; E: 0.125 μmol/L group; F: Positive control group)
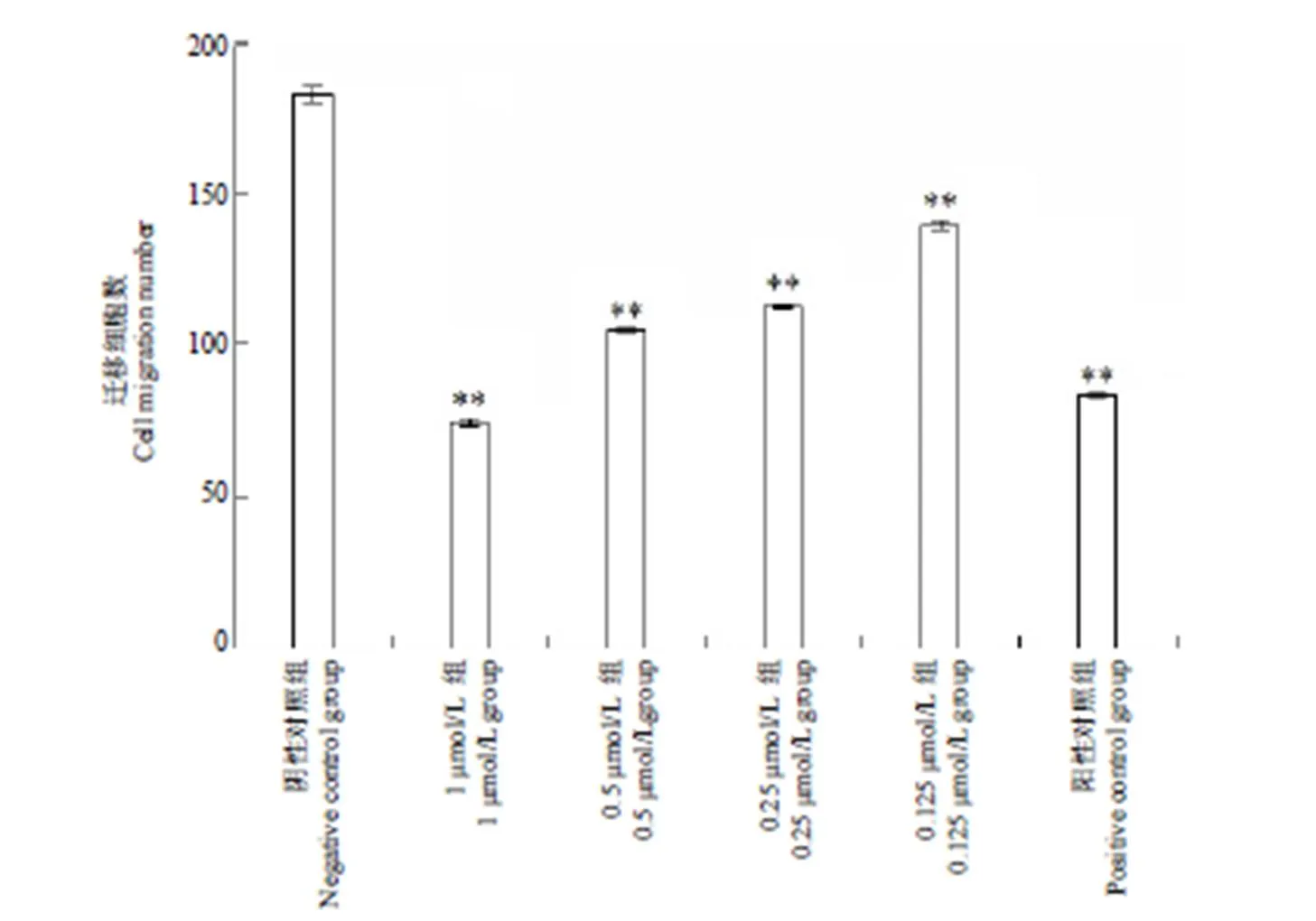
图 2 不同浓度化合物 A12 对 A549 细胞迁移能力影响统计学分析(与阴性对照组比较,**P < 0.01)
Figure 2 Effect of compound A12 on the migration of A549 cells statistical analysis (Compared with negative control group,**< 0.01)
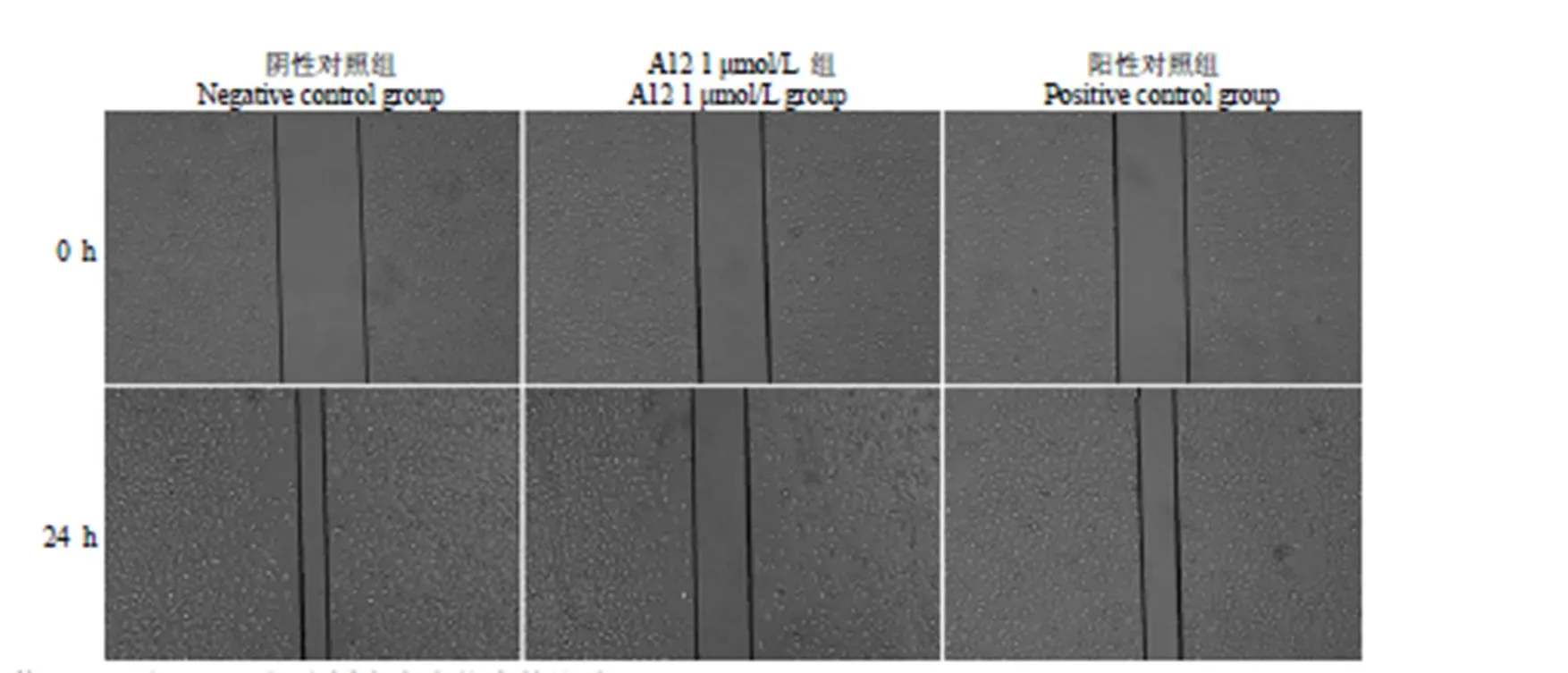
图 3 化合物 A12 对 A549 细胞划痕愈合能力的影响
Figure 3 Effect of compound A12 on the wound healing ability of A549 cells
2.4 划痕愈合实验结果
化合物 A12 对划痕后的 A549 细胞作用 24 h后,倒置显微镜拍照并观察划痕线附近A549 细胞的愈合情况及生长状态,结果表明:阴性对照组在划痕 24 h 后,与此组 0 h 状态对比,划痕两侧细胞分别向对侧生长,划痕间距明显缩小,由(0.90 ± 0.02)mm 缩短至(0.21 ± 0.02)mm;A12 作用24 h 后,划痕间距由(0.83 ± 0.02)mm 缩短至(0.62 ± 0.03)mm,抑制愈合率为 74.10%,提示A12 作用后,A549 细胞的运动能力减弱,且同种作用浓度(1 μmol/L)下,A12 对 A549 细胞的抑制运动作用强于阳性对照组。结果如图 3 所示。
2.5 流式细胞术检测细胞凋亡影响结果
化合物 A12 对 A549 细胞作用 48 h 后,对细胞凋亡的影响见表 3。与阴性对照组比较,A12 能够显著提高 A549 细胞的早期凋亡率(< 0.05)、晚期凋亡坏死率(< 0.01)及总凋亡率(< 0.05),且相同作用浓度(1 μmol/L)下,对 A549 细胞凋亡的影响优于阳性对照组。此结果表明:化合物 A12 能够诱导 A549 细胞凋亡,从而抑制其增殖。

表 3 化合物 A12 对 A549 细胞凋亡影响结果
注:*< 0.05,与阴性对照组比较;**< 0.01,与阴性对照组比较。
Note:*< 0.05 vs. negative control group;**< 0.01 vs. negative control group.
3 讨论
肺癌作为恶性肿瘤,即使处于 I 期的肿瘤患者,其术后转移复发风险也高于其他肿瘤患者,且预后较差[13]。肿瘤治疗失败的原因主要是复发和发生重要脏器的转移,细胞的迁移现象是细胞在接收到迁移信号或感受到某些物质的浓度梯度后而产生的移动。因此,这就要求抗肿瘤药物不仅具有抑制肿瘤细胞增殖的作用,还能够有效阻遏其迁移至其他脏器,进而影响疾病的发生和进程,改善预后。DHFR 抑制剂作为近年来抗肿瘤药物的研究热点,具有较为广泛的抗肿瘤作用,其中 PMX 作为经典 DHFR 抑制剂的代表药物已被美国食品药品监督管理局(FDA)批准用于 MPM 的一线治疗及 NSCLC 的二线治疗,在我国于 2005 年被批准上市,适应证为 MPM。目前,临床上对于 NSCLC 的治疗还存在很多困难,没有理想的治疗方案,还需进一步的研究探索。并且,虽然国内已有企业能够生产 PMX,但其质量尚有待提高,均在纯度不高及杂质较多方面存在不足,对 PMX 采用的试行标准中规定其含量为 98.5%,总杂质≤ 1.0%,此标准也有进一步提高的可能[14]。本实验采用 PMX 原料药作为对照,结果表明其对 A549 细胞毒作用不显著(IC50> 200 μmol/L),提示需进一步提高纯度,减少杂质,且存在水溶液稳定性不佳等问题,影响其效果。
同时,有研究报道,PMX 临床治疗肺癌过程中,可与多种药物联用,但禁忌与二线和三线化疗药物配合使用[15],并且存在中性粒细胞减少等血液学毒性及黏膜炎、败血症、脓毒症等不良反应[16],之前进行过同类方案化疗的患者可能敏感性不佳,易产生耐药性等缺点,促使对培美曲塞合成方案及结构进行进一步优化。为增强其在一线治疗及维持治疗中的疗效及减少不良反应提供思路,本文选取新型 PMX 衍生物进行 MTT 实验及 transwell 细胞迁移实验,评价其对人肺癌细胞 A549 细胞增殖、迁移活力的影响,结果表明能够显著抑制 A549 的增殖及迁移能力(< 0.01),并且这种抑制作用具有浓度依赖性,此结果与之前结果一致[17]。同时进行划痕愈合实验,结果发现待测化合物组24 h 后划痕间距与 0 h 相比,缩短较少距离,愈合抑制率为74.10%,且优于阳性对照组,表明其能够有效阻滞 A549 细胞的划痕愈合,此结果与 transwell 细胞迁移实验结果一致,进一步证实此种 PMX 衍生物不仅能够抑制 A549 细胞的增殖,而且能够有效阻滞癌细胞迁移至其他组织。流式细胞实验结果表明,此类 PMX 衍生物发挥抑制 A549 细胞增殖作用与引起细胞凋亡有关。本次新型 PMX 衍生物体外实验结果表明其对肺癌 A549 细胞具有良好的抑制效果,且效果优于 PMX,为深入研究其机制及结构改造奠定基础,也为今后的临床应用提供可能。
[1] Kumar A, Zhang M, Zhu L, et al. High-throughput screening and sensitized bacteria identify an m. Tuberculosis dihydrofolate reductase inhibitor with whole cell activity. PLos One, 2012, 7(6):e39961.
[2] Thakkar SS, Thakor P, Doshi H, et al. 1,2,4-triazole and 1,3,4-oxadiazole analogues: Synthesis, MO studies, in silico molecular docking studies, antimalarial as DHFR inhibitor and antimicrobial activities. Bioorg Med Chem, 2017, 25(15):4064-4075.
[3] Assayag M, Rouvier P, Gauthier M, et al. Renal failure during chemotherapy: renal biopsy for assessing subacute nephrotoxicity of pemetrexed. BMC Cancer, 2017, 17(1):770-777.
[4] Waqar SN, Baggstrom MQ, Morgensztern D, et al. A phase I trial of temsirolimus and pemetrexed in patients with advanced non-small cell lung cancer. Chemotherapy, 2016, 61(3):144-147.
[5] Yousefi K, Hamedeyazdan S, Hodaei D, et al. An in vitro ethnopharmacological study on Prangos ferulacea: a wound healing agent. Bioimpacts, 2017, 7(2):75-82.
[6] Chen JX, Rong XZ, Fan GC, et al. Effects of different concentrationsof putrescine on proliferation, migration and apoptosis of human skin fibroblasts. J South Med Univ, 2015, 35(5):758-762. (in Chinese)陈健霞, 荣新洲, 樊桂成, 等. 不同浓度腐胺对人皮肤成纤维细胞增殖、迁移和凋亡的影响. 南方医科大学学报, 2015, 35(5):758-762.
[7] Yao Y, Zhang YW, Sun LG,et al. Juglanthraquinone C, a novel naturalcompound derived from Juglans mandshurica Maxim, induces S phase arrest and apoptosis in HepG2 cells. Apoptosis, 2012, 17(8):832-841.
[8] Zhang HY, Gao Y, Lai PX. Chemical composition, antioxidant, antimicrobialand cytotoxic activities of essential oil from premna microphylla turczaninow. Molecules, 2017, 22(3):381-391.
[9] Wang L, Qu J, Zhou L, et al. MicroRNA-373 inhibits cell proliferation and invasion via targeting BRF2 in human non-small cell lung cancer A549 cell line. Cancer Res Treat, 2017. [Epub ahead of print]
[10] Luo LY. Effect of hAIF-1 recombinant adenovirus on proliferation and migration of A549 cells. Nanjing: Nanjing Normal University, 2015. (in Chinese)罗丽芸. hAIF-1重组腺病毒对A549细胞增殖和迁移的影响. 南京: 南京师范大学, 2015.
[11] Gao S, Li X, Ding X, et al. Cepharanthine induces autophagy, apoptosis and cell cycle arrest in breast cancer cells. Cell Physiol Biochem, 2017, 41(4):1633-1648.
[12] Geng X, Zhang X, Zhou B, et al. Usnic acid induces cycle arrest, apoptosis, and autophagy in gastric cancer cells in vitro and in vivo. Med Sci Monit, 2018, 24:556-566.
[13] Kinch MS, Moore MB, Harpole DH Jr. Predictive value of the EphA2 receptor tyrosine kinase in lung cancer recurrence and survival. ClinCancer Res, 2003, 9(2):613-618.
[14] Chen JF, Cai HM, Jiang GZ. Recent studies on clinical application of anticancer agent pemetrexed. Prog Pharm Sci, 2009, 33(1):23-29. (in Chinese)陈锦飞, 蔡惠明, 蒋光祖. 抗肿瘤药培美曲塞的临床应用研究近况. 药学进展, 2009, 33(1):23-29.
[15] Deng YF. Anti-tumor drug pemetrexed in clinical application incompatibility. Chin J Clin Rational Drug Use, 2011, 4(18):59-60. (in Chinese)邓燕芬. 抗肿瘤药物培美曲塞在临床应用上的配伍禁忌. 临床合理用药杂志, 2011, 4(18):59-60.
[16] Hu XS, Jiao SC, Zhang SC, et al. Efficacy and toxicity of pemetrexed or gemcitabine combined with cisplatin in the treatment of patients with advanced non-small cell lung cancer. Chin J Lung Cancer, 2012, 15(10):569-575. (in Chinese)胡兴胜, 焦顺昌, 张树才, 等. 培美曲塞及吉西他滨分别联合顺铂治疗初治晚期非小细胞肺癌安全性和有效性的随机对照研究. 中国肺癌杂志, 2012, 15(10):569-575.
[17] Zhou X, Lin K, Ma X, et al. Design, synthesis, docking studies and biological evaluation of novel dihydro-1,3,5-triazines as human DHFR inhibitors. Eur J Med Chem, 2016, 125:1279-1288.
Study on the effects of new pemetrexed derivatives on the proliferation, migration and cell apoptosis of A549 cells
LIU Xiu, JIA Yu-ping, JIA Qing-wen, GUO Zhong-kun, WANG Ke-zhou, LU Mei-chao, LIU Sha, YUAN Dong-dong
Author Affiliations: School of Medicine and Life Science, University of Jinan & Shandong Academy of Medical Science, Jinan 250200, China (LIU Xiu, GUO Zhong-kun, WANG Ke-zhou); Shandong Academy of Pharmaceutical Sciences, Jinan 250101, China (JIA Yu-ping, JIA Qing-wen, LU Mei-chao, LIU Sha, YUAN Dong-dong); Shandong Laboratory Animal Center, Shandong Academy of Medical Science, Jinan 250002, China (GUO Zhong-kun, WANG Ke-zhou)
To detect the effects of new pemetrexed (PMX) derivatives on the proliferation, migration and cell apoptosis of A549 cells.
The cytotoxicity of 12 compounds to A549 cells was preliminarily screened by MTT method, and candidate compounds with high activity were selected for further research on the proliferation of A549 cells. Effects of candidate compounds on A549 cells migration were detected by transwell cell migration assay and the wound healing assay. Effects of candidate compounds on the cell apoptosis of A549 cells were detected by flow cytometry.
The results of preliminary screening of 9 compounds could inhibit the proliferation of A549 cells, with compound A12 the inhibitory effect was the most significant, IC50(1.26 ± 0.15) μmol/L, and the inhibition was concentration and time dependent: the IC50in the lowest at 72 h was (1.06 ± 0.24) μmol/L; Transwell cell migration assay and the wound healing assay showed that the migration ability of A12 could inhibit A549 cells, and the inhibition was concentration dependent; Flow cytometry results showed that A12 can significantly improve the early apoptosis rate of A549 cells (< 0.05), late apoptosis and necrosis rate (< 0.01) and total apoptosis rate (< 0.05).
The new PMX derivative, A12, could inhibit the proliferation and migration activity of A549 cells and induced apoptosis.
Cell proliferation; Cell migration inhibition; Apoptosis; Pemetrexed derivatives; A549 cells
WANG Ke-zhou, Email: wangkezhou_cn@163.com
10.3969/j.issn.1673-713X.2018.03.006
国家重点研发计划(2017YFD050160202);中央引导地方科技发展专项资金项目(CXLC161906);山东省自然科学基金(ZR2015YL036);山东省医学科学院医药卫生科技创新工程
王可洲,Email:wangkezhou_cn@163.com
2018-01-17
