高密度接种胶球藻C-169处理脱色酵母发酵废水条件优化
2018-06-11余宗苡闫文君魏东
余宗苡,闫文君,魏东
(华南理工大学食品科学与工程学院,广东广州 510640)
酵母作为世界上研究最多的微生物之一,被广泛应用于酿酒、食品、医药、饲料和化妆品等领域。废糖蜜是酵母工业的主要原料,包括甘蔗糖蜜和甜菜糖蜜。目前我国两种原料的使用率基本各占50%。酵母废水有机物浓度高,COD(化学需氧量)、BOD(生化需氧量)、SS(悬浮物)均较高,且废水呈酸性,直接排放会使土壤酸化板结,使土壤贫瘠化,危害植物生长繁殖[1]。由于酵母发酵过程不能把糖蜜中的有机物完全消耗,剩余的有机物以及酵母生长代谢产生的新的有机物进入酵母工业废水中,因此这类废水因含有类黑精、美拉德色素和多酚类等色素而呈深棕色,其色值还可能由于色素物质的再聚合而加深[2]。目前,国内外处理此类废水的方法包括物理处理法、生化处理法、深度处理法、生物与其他方法结合处理[3]。
微藻是一类光合效率很高的初级生产者,在生长过程中能够吸收废水中大量的氮、磷,以维持自身的生长与增殖需要,是最具潜力的生物质能源[4],利用微藻处理酵母废水可以将废水中丰富的无机微量元素进行资源化综合利用[5],迄今已经筛选出了许多高效净化水质的藻种[6]尤以绿藻居多[7]。大部分微藻都可以利用不同碳源进行异养或者混养培养生长,相对于自养生长,异养或者混养培养可获得较高的生物量[8]。研究表明小球藻采用分批及流加培养分别可获得 48 g/L、105 g/L的生物量,因此,可通过异养培养获得大量藻生物量来去除废水中的“营养物”,实现废水的资源化[9]。
胶球藻C-169是在极地环境中生存的一个代表物种,对外界环境具有很强的适应性,在CO2驱动下可提高生物量和油脂产率[10]。其细胞壁薄而容易酶解,在最佳条件下能积累大量的甘油三酯,用于微藻生物燃料的生产可极大降低提油成本,是一种极具潜力的能源微藻[11]。目前国内外对该藻种的基础生物学信息了解不多,局限于光自养培养,细胞密度低,对其能否通过异养发酵和混养培养实现高密度培养并无研究,是否能利用废水培养并积累油脂从而降低微藻油脂的生产成本报道很少。因此,探索胶球藻C-169营养方式、处理废水及积累油脂的能力是目前有待进行的研究课题,这些基础生物学信息将为胶球藻 C-169的工业化应用奠定基础。
1 材料与方法
1.1 材料与仪器
胶球藻(Coccomyxa subellipsoidea)NIES 2166(C-169)原种购于日本NIES藻种库;糖蜜酵母废水来自广东五洲药业有限公司;葡萄糖、硝酸钠、硫酸镁等均为分析纯;测COD、总氮、总磷的试剂购自美国HACH公司;AL104型电子天平和SevenEasy型pH计购自瑞士Mettler Toledo公司;Allegra25R型高速冷冻离心机购自美国 Beckman Coulter公司;DHG-9123A型电热恒温鼓风干燥箱购自上海一恒科学仪器有限公司;DHZ-DA型恒温摇床购自太仓实验设备厂;BFM-6BⅡ型高压灭菌锅购自英国 ASTELL公司;DRB200型数字式消解器和DR2700型便携式分光光度计购自美国HACH公司。
1.2 实验方法
1.2.1 胶球藻C-169的自养、异养、混养生长
从活化的Basal培养基[12]平板上挑取单藻落,接种到含10 g/L葡萄糖的液体basal培养基中。培养6 d后,在超净工作台中,取5 μL接种到不含糖的Basal固体培养基平板上,置于连续光照(光强 2000±300 lux)的培养箱中,27 ℃下培养7 d,观察自养生长情况;在超净工作台取5 μL接种到含10 g/L葡萄糖及10 g/L蔗糖的Basal固体培养基平板上置于连续光照(光强2000±300 lux)的培养箱中,27 ℃下培养7 d,观察混养生长情况;取5 μL接种到含10 g/L葡萄糖及10 g/L蔗糖的Basal固体培养基平板上置于黑暗的培养箱中,27 ℃下培养7 d,观察异养生长情况。
配制Basal培养基,分装到9个250 mL三角瓶中,装液量为100 mL,其中6瓶添加10 g/L葡萄糖。121 ℃蒸汽灭菌 15 min冷却至室温后,在超净台中以 5%(V/V)接种量完成接种后,取三瓶含有葡萄糖的三角瓶用锡纸包裹完全避光,培养瓶均置于光照强度为4000±300 lux、27 ℃、150 r/min 的摇床中培养 10 d。每隔24 h取样一次,每次取样2 mL,高速离心去上清。藻泥用去离子水洗涤3次,置于60 ℃烘箱48 h后测干重。
1.2.2 葡萄糖浓度对胶球藻C-169混养生长的影响
设置葡萄糖浓度梯度10、20、30、40、50、60 g/L,将培养瓶置于光照强度为4000±300 lux,27 ℃、150 r/min的摇床中混养培养10 d。每隔24 h取样一次,每次取样2 mL,12000 r/min高速离心,收集上清和藻泥。
1.2.3 浓缩种子液制备
在250 mL三角瓶中以10%(V/V)的接种量将预先培养的一级种子液接入100 mL Basal培养基中(添加20 g/L葡萄糖),置于恒温摇床27 ℃、150 r/min混养培养6 d。取6瓶种子液,分装到50 mL灭菌离心管中,6000 r/min高速离心3 min,去上清,用无菌去离子水悬浮藻细胞,重复离心洗涤3次后,用无菌去离子水悬浮藻细胞定容至80 mL,该浓缩藻液作为后期实验的种子液。
1.2.4 酵母废水脱色预处理
将冷冻的糖蜜酵母废水解冻至室温,使其混合均匀后,用10%的盐酸溶液调整其pH值至3.0。取200 mL酵母废水至500 mL烧杯中,按浓度为3 g/100 mL的剂量添加活性碳粉200#,置于磁力搅拌器上以300 r/min搅拌0.5 h后,分别用200、300、400目筛绢真空抽滤除去大部分活性炭,再分别用定性滤纸、0.45 μm水相滤膜真空抽滤除去残留的活性炭。
1.2.5 接种密度对脱色废水中胶球藻C-169的生长和废水净化效果的影响
取900 mL脱色废水,用4 mol/L的NaOH溶液调整其pH值至6.1,分装到9个灭菌250 mL三角瓶中,装液量为100 mL。在非灭菌的脱色废水中接种胶球藻C-169,接种量按1、2、4 mL加入浓缩的种子液,每个接种浓度设置三个平行。把培养瓶置于恒温摇床中培养,27 ℃、150 r/min下连续光照培养4 d,光强为4500±500 lux。培养起始和结束时各取样3 mL藻液,12000 r/min离心3 min,收集上清液用于脱色废水的水质分析。
1.2.6 脱色废水浓度对胶球藻C-169的生长和废水净化效果的影响
将脱色废水与去离子水分别按1:0、1:1、1:2、1:3比例混合,每个梯度设置三个平行,用4 mol/L NaOH溶液调整其pH值至6.1,分装到12个灭菌后的250 mL三角瓶中,装液量为100 mL。在非灭菌的脱色废水中接种胶球藻C-169,接种量按4 mL体积加入浓缩藻液。三角瓶置于恒温摇床中培养,在27 ℃、150 r/min下连续光照培养10 d,光强为4500±500 lux。每隔48 h取样3 mL,12000 r/min离心3 min,收集上清液进行脱色废水水质分析。
1.3 分析测试
1.3.1 葡萄糖浓度
葡萄糖浓度测定在 SBA-40D生物传感分析仪上进行,校正范围为0.5~1.0 g/L。测定前将样品稀释到矫正范围内,用针筒过滤器进行过滤(0.45 μm)。进样前先用浓度为1.0 g/L葡萄糖标液定标。进样时用微量进样器吸取25 μL样品从进样口注入反应池,由反应池搅拌系统均匀,待读数稳定后记录数据。每个样品经过多次测量取平均值,再乘以稀释倍数,得到样品的葡萄糖浓度。
1.3.2 生物量
采用烘干法测干重时,经离心、反复洗涤后的藻泥,放入60 ℃烘箱烘干至恒重。废水培养所得藻泥用去离子水悬浮,1200 r/min离心5 min,去除悬浮有细菌的上清液,重复5次后,上清液基本无色透明,然后转移至已称恒重的2 mL离心管中,12000 r/min离心3 min,去除上清后置于60 ℃烘箱烘至恒重,差量法得干重。
1.3.3 比生长速率
根据生物量干重变化制作生长曲线,比生长速率μ=(lnM2-lnM1)/t,其中M2和M1分别是两次测量的生物量干重浓度值;t为两次测量的时间间隔,单位为d。
1.3.4 酵母废水COD、TN、TP测定
使用HACH公司专用试剂盒,按照试剂盒操作步骤,样品稀释到测量范围,加入试剂后在不同温度下于消解器DRB200上进行消解,消解完全并冷却后,在DR2700分光光度计中测定。
1.4 数据分析
采用Microcal Origin V8.0 Software对数据进行处理和统计。
2 结果与讨论
2.1 不同营养模式下胶球藻C-169的生长特性

图1 胶球藻C-169在固体培养基上的异养、自养和混养生长Fig.1 Heterotrophic, mixotrophic and autotrophic growth of Coccomyxa subellipsoidea C-169 on solid medium

图2 胶球藻C-169在异养、混养和自养条件下的生长曲线Fig.2 Growth curves of Coccomyxa subellipsoidea C-169 under autotrophic, heterotrophic and mixotrophic conditions
胶球藻C-169在含10 g/L葡萄糖或含10 g/L蔗糖的Basal固体培养基平板上异养和混养生长状况如图1所示。从图中可以看出,胶球藻C-169除了能够利用无机碳进行光自养生长以外,还能够利用葡萄糖和蔗糖作为碳源,可以进行混养和异养生长。胶球藻C-169在自养、异养和混养(都含10 g/L葡萄糖)Basal液体培养基中的生长曲线见图 2。研究表明,混养培养下既能进行光合作用又能利用葡萄糖作为有机碳源进行细胞增殖,平均比生长速率和最大生物量干重显著大于异养和自养,最大生物量干重分别是异养和自养的1.86、7.79倍。
2.2 葡萄糖浓度对胶球藻C-169混养生长的影响

图3 胶球藻C-169在不同葡糖糖浓度下混养葡萄糖消耗曲线和生长曲线Fig.3 Consumption curves of glucose (a) and growth curves(b) of Coccomyxa subellipsoidea C-169 in mixotrophic culture medium with different glucose concentrations
胶球藻C-169在葡萄糖浓度梯度为10~60 g/L的Basal培养基中混养培养,细胞生长曲线和葡萄糖消耗情况如图3所示。由图3a可以看出,在不同葡萄糖浓度下,胶球藻C-169的生长为典型的S曲线。接种处于对数期的细胞,无明显延滞期。葡萄糖浓度为10 g/L时,胶球藻C-169在6 d后进入稳定期,葡萄糖在第6 d完全消耗(图3b)。
当葡萄糖在20~60 g/L时,胶球藻C-169在8 d后进入稳定期,但其对应时间点的葡萄糖尚有剩余。由此可知,当葡萄糖浓度为10~20 g/L时,葡萄糖短缺是混养胶球藻C-169的生长限制性因素。当葡萄糖浓度为20~60 g/L时,可能是某些代谢产物或者其他营养源(氮源、微量元素等)限制了C-169的继续生长。20 g/L葡萄糖浓度下的生物量较10 g/L葡萄糖浓度下的生物量有极显著的提高(p<0.01),30~40 g/L葡萄糖浓度下的生物量较20 g/L葡萄糖浓度下的生物量没有显著影响,50 g/L葡萄糖浓度以上的生物量较40 g/L葡萄糖浓度下的生物量有极显著的降低(p<0.01)。
有研究表明,在小球藻的培养基中磷的耗竭对脂质积累没有影响,但限制了细胞的生长;而氮的耗竭可以促进脂质的积累,从而有利于油脂的产生;当葡萄糖浓度小于100 g/L时,葡萄糖的抑制作用与渗透压胁迫相当,葡萄糖浓度高于100 g/L时的抑制作用会变得比渗透压胁迫强,在特定的高渗透压胁迫下可显著提高油脂积累[13]。
在本试验中,50 g/L以上葡萄糖浓度对胶球藻C-169的混养生长有一定的抑制作用。经显著性分析和培养基成本考虑可得,胶球藻C-169在20 g/L葡萄糖浓度Basal培养基中获得较高生物量浓度7.98 g/L,本研究的后期实验将以20 g/L葡萄糖添加量混养培养进行快速扩种。
2.3 接种密度对胶球藻C-169生长和废水净化效果的影响

图4 不同起始细胞浓度下胶球藻C-169在脱色废水中生长4 d时的情况Fig.4 Growth of Coccomyxa subellipsoidea C-169 in yeast wastewater under different initial cell concentrations for 4 d
接种起始细胞密分别为0.59 g/L、1.18 g/L和2.43 g/L。图4可以看出,接种起始细胞密为0.59 g/L时胶球藻C-169在脱色废水中无法持续生长,藻液颜色发白。这是因为脱色废水未经过灭菌处理,藻细胞密度低,用流式细胞仪测得其他微生物生长迅速,藻细胞逐渐减少最后死亡。接种起始细胞密为1.18 g/L、2.43 g/L时藻液呈绿色,微藻细胞密度大,形成优势群落,生长旺盛。
培养4 d后,对培养液进行水质分析,结果见表1。从表中可看出,接种量为4 mL时,COD、总氮、总磷去除率要显著高于接种量为2 mL时(p<0.01),废水净化程度与藻细胞浓度呈正相关,起始细胞密度越大,藻细胞生长速率越快,废水净化效果越好。研究表明,利用胶球藻C-169在藻菌共生条件下净化脱色废水时,接种密度在1 g/L以上的藻细胞能有较好的生长状态,且接种密度越高,废水净化效果越好。工业上用“活性藻”技术处理废水时,是把浓缩藻液接种到活性污泥中进行藻菌共生,可见微藻接种密度低不利于藻菌共生系统的运行。本文之后实验的接种量设置为4 mL浓缩藻液,接种密度可能会由于一级种子液浓度不同存在变化,但均在1 g/L以上。

表1 不同起始细胞密度下胶球藻C-169对酵母废水净化效果Table 1 Purification effect of yeast wastewater by Coccomyxa subellipsoidea C-169 under different initial cell densities
2.4 脱色废水浓度对胶球藻C-169生长和废水净化效果的影响
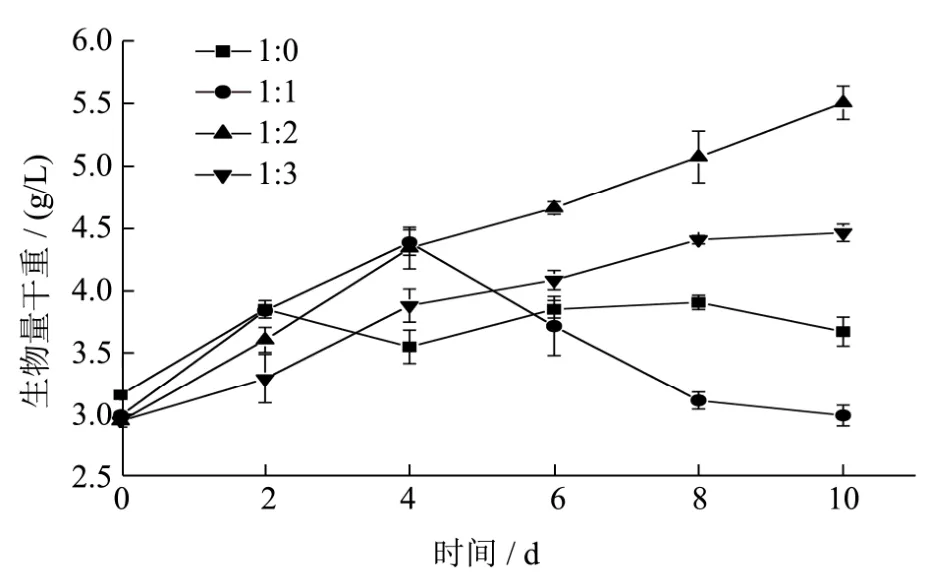
图5 不同脱色废水浓度下胶球藻C-169的生长曲线Fig.5 Growth curve of Coccomyxa subellipsoidea C-169 under different concentrations of decolorization wastewater
不同浓度脱色废水培养基的总氮、总磷含量见表2,胶球藻C-169在不同浓度脱色废水中的生长情况见图5。从图5可以看出,C-169在不稀释的脱色酵母废水中生长2 d后,藻细胞停止生长,进入稳定期,最大生物量干重为3.63 g/L。C-169在稀释一倍的脱色废水中快速生长4 d后,停止生长,生物量干重直线下降,原因可能是这种培养基更适合其他微生物的生长,导致藻细胞死亡。C-169在稀释两倍时,最高生物量浓度和产率都达到最高,分别为 5.28 g/L和 0.23 g/(L·d)。说明,废水稀释降低了其高负荷,增大了培养基透光率,相较于原脱色废水,更加有利于藻细胞进行光合作用。当稀释倍数为3时,其总氮含量与标准Basal培养基相比,氮源充足,其细胞生长速率低于稀释两倍时,可能是稀释过程降低了磷及其他营养元素的浓度,限制了C-169的生长。纪雁[14]利用味精废水培养普通小球藻,当稀释倍数为100时,获得最大生物质产率,稀释倍数过高和过低均不适合普通小球藻的生长。这与本研究稀释酵母废水培养胶球藻C-169的规律相同,且脱色酵母废水稀释两倍即达到最适稀释倍数,节约淡水,更适合利用微藻净化。

表2 不同浓度脱色酵母废水中总氮、总磷含量与标准培养基的比较Table 2 Comparison of total nitrogen and total phosphorus content in different concentrations of yeast fermentation wastewater with standard medium

表3 不同浓度脱色酵母废水培养胶球藻C-169净化脱色酵母废水的效果Table 3 Purification effect of yeast decolorization wastewater with different concentrations by Coccomyxa subellipsoidea C-169
比较不同浓度脱色酵母废水中胶球藻C-169对废 水的净化效果,其结果如表3所示。稀释三倍的脱色废水中培养胶球藻,COD去除率显著低于其他组(p≤0.05);稀释两倍时COD去除率与原脱色废水、稀释一倍的废水没有显著差异其总氮去除率分别是原脱色废水、稀释一倍废水、稀释三倍废水的2.76、1.99、1.08倍;稀释两倍时总磷去除率高达96.86%,氨氮去除率分别是原脱色酵母废水、稀释一倍废水、稀释三倍废水的4.69、3.69、1.29倍。氮、磷去除率的规律和胶球藻C-169生长规律一致,说明胶球藻C-169生长消耗废水中氮磷是去除废水总氮、总磷的主要原因。稀释两倍的脱色酵母废水,更适合胶球藻C-169的生长,细胞密度较高,能更多消耗培养基中的营养元素,提高去除率。
3 结论
本研究针对胶球藻C-169的生长特性以及其对酵母废水的处理净化能力进行了研究,结果表明胶球藻C-169具有利用葡萄糖和蔗糖作为碳源进行异养和混养生长的能力,且混养培养时采用葡萄糖浓度为 20 g/L的Basal培养基是胶球藻C-169快速扩种的最佳条件。胶球藻C-169能够在高浓度脱色酵母废水中,藻菌共生条件下生长,接种密度越大,对酵母废水的净化效果越佳。脱色酵母废水稀释两倍最适合胶球藻C-169的生长和酵母废水的净化。
[1]赵光楠,李晓琳,吴德东.酵母生产废水处理方法对比研究[J].林业科技情报,2016,48(3):59-64 ZHAO Guang-nan, LI Xiao-lin, WU De-dong. Comparative study on treatment methods of wastewater from yeast production [J]. Forestry Science and Technology Information,2016, 48(3): 59-64
[2]Liakos T I, Lazaridis N K. Melanoidins removal from simulated and real wastewaters by coagulation and electro-flotation [J]. Chemical Engineering Journal, 2014,242(15): 269-277
[3]Westlund P, Yargeau V. Investigation of the presence and endocrine activities of pesticides found in waste water effluent using yeast-based bioassays [J]. Science of the Total Environment, 2017, 607-608: 744
[4]Park J, Jin H F, Lim B R,et al.Ammonia removal from anaerobic digestion effluent of livestock waste using green alga scenedesmus sp [J]. Bioresource Technology, 2010,101(22): 8649-8657
[5]Mthakathi N T, Chen W, Yu JH, et al.Cytochrome P450 monooxygenase analysis in free-living and symbiotic microalgae Coccomyxa sp. C-169 and Chlorella sp. NC64A.In: International Symposium on Cytochrome P450 Biodiversity and Biotechnology, Event # 16scbb, July 22-26,2016, Vancouver, Canada, 2015: 233-239
[6]Lürling M. Phenotypic plasticity in the green algae Desmodesmus and Scenedesmus with special reference to the induction of defensive morphology [J]. Annales de Limnologie-International Journal of Limnology, 2003, 39(2):85-101
[7]Ruizmarin A, Mendozaespinosa L G, Stephenson T. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuous cultures treating real wastewater[J]. Bioresource Technology, 2010, 101(1): 58
[8]Hu J, Nagarajan D, Zhang Q, et al.Heterotrophic cultivation of microalgae for pigment production: A review [J].Biotechnology Advances, 2017
[9]廖福真,龙先进,黄浩,等.利用酵母有机废水高密度异养培养油脂微藻的研究[J].轻工科技,2017,1:79-81 LIAO Fu-zhen, LONG Xian-jin, HUANG Hao,et al.High density heterotrophic cultivation of lipid microalgae using yeast organic wastewater [J]. Light Industry Science and Technology, 2017, 1: 79-81
[10]Peng H, Wei D, Chen G, et al.Transcriptome analysis reveals global regulation in response to CO2supplementation in oleaginous microalga Coccomyxa subellipsoidea C-169 [J].Biotechnology for Biofuels, 2016, 9(1): 151
[11]Allen J W, Dirusso C C, Black P N. Triacylglycerol synthesis during nitrogen stress involves the prokaryotic lipid synthesis pathway and acyl chain remodeling in the microalgaeCoccomyxa subellipsoidea[J]. Algal Research,2015,(10):110-120
[12]Ogbonna J C, Masui H, Tanaka H. Sequential heterotrophic/autotrophic cultivation-An efficient method of producing Chlorella biomass for health food and animal feed[J]. Journal of Applied Phycology, 1997, 9(4): 359-366
[13]Wang T, Tian X, Liu T, et al.A two-stage fed-batch heterotrophic culture of Chlorella protothecoides that combined nitrogen depletion with hyperosmotic stress strategy enhanced lipid yield and productivity [J]. Process Biochemistry, 2017
[14]纪雁.利用味精废水培养普通小球藻以及养藻废水的生物强化处理[D].济南:山东大学,2014 JI Yan. Cultivation ofChlorella vulgariswith monosodium glutamate wastewater and treatment of the residule medium by bioaugmentation [D]. Jinan: Shandong University, 2014
