TLRs信号通路激活的MSCs外泌体对巨噬细胞极化的影响
2018-06-11冉凤英陈龙张斌强尚兵余飞陈炜陈琴华
冉凤英 陈龙 张斌强 尚兵 余飞 陈炜 陈琴华
巨噬细胞在组织损伤修复中扮演重要角色,按其免疫调节的功能可分为M1型和M2型[1-2]。M1型巨噬细胞高表达iNOS、TNF-α,分泌促炎因子IL-6、IL-1β,能够增强炎症反应;M2型巨噬细胞高表达 CD206、Arg-1,分泌抗炎因子 IL-10、CCL22,能够降低炎症反应,促进组织再生[3-4],两者在一定的条件下可发生表型转换。巨噬细胞的极化方向一定程度上影响了组织修复的进程,因此,在组织修复中巨噬细胞是极具潜力的临床治疗靶点。大量研究表明,巨噬细胞极化的调节通常通过细胞因子与其受体结合激活相关信号通路的方式进行调节,不同的细胞因子及组合引起巨噬细胞的极化方向不同。
近年来的研究发现,细胞囊泡系统及细胞外泌体亦是调节巨噬细胞极化的重要途径。这些研究中,间充质干细胞外泌体(mesenchymal stem cells derived exosomes,MSCs-Exo)由于其能够发挥和间充质干细胞(mesenchymal stem cells,MSCs)相似的生物学特性,日益得到重视。Németh等[5]的研究发现MSCs-Exo能使巨噬细胞极化为M2型,表明MSCs-Exo极有可能成为无细胞免疫疗法的重要组成部分。但是,MSCs免疫调节能力具有可塑性,激活MSCs上不同的Toll样受体(toll-like receptors,TLRs)导致MSCs产生不同的炎症调节因子,进而产生完全不同的炎症调节作用[6-7]。最近的研究提示,MSCs能够通过外泌体传递细胞因子调控炎症反应[8]。然而,不同TLRs信号刺激产生的外泌体对巨噬细胞极化的影响却未见报道。因此,本研究拟采用特异的TLRs激动剂Poly(i : c)和LPS激活MSCs细胞上相应的TLR3和TLR4,探讨不同TLRs信号通路激活的MSCs-Exo对巨噬细胞极化的影响。从而为基于MSCs-Exo无细胞免疫疗法的临床应用提供实验依据。
材料与方法
一、细胞、动物、主要试剂与仪器
SD雄性大鼠(150 ~ 250 g,湖北医药学院实验动物中心提供),L929细胞株购自上海中国科学院细胞库。胎牛血清(美国Biological Industries公司,04-002-1A);蛋白转运抑制剂、外泌体提取试剂Total Exosome Isolation Kit、cDNA反转录试剂盒(美国 Thermo Scientif i c公司,00-4975-93、4478359、K1621);Poiy(i : c)、LPS(美 国 Sigma 公 司,P1530、L2630);小鼠抗大鼠抗体 CD45、CD90、CD34(美 国 eBioscience公 司,14-0450、11-0900、12-0341)、CD44(美国 Santa Cruz公司,sc-9960)、CD29(美国 BioLegend公司,102205);兔抗大鼠CD206、iNOS(美国Santa Cruz公司,sc-34577、sc-650);羊抗大鼠 TNFα(美国 Santa Cruz公司,sc-1351);山羊抗大鼠Arg-1抗体(中国Abcam公司,ab60176);FITC标记的荧光二抗驴抗小鼠(中国antGene公司,ANT023)、驴抗兔(中国 antGene公司,ANT024)、驴抗山羊抗体(中国antGene公司,ANT025L);IL-4、IL-13(美国 Peprotech公司,200-04、400-16);SYBR Green PCR Kit(中国 TIANGEN公司,FP205-02);兔单克隆抗体 CD9、Hsp70(美国Abcam公司,EP1007Y、EPR2949);流式细胞仪(美 国 Becton Dickinson公 司,FACS Calibur);荧光定量PCR仪(美国Corbett Research公司,Rotor gene 6000);倒置相差显微镜(日本Olympus公司,CKX41);超速离心机(日本 Hitachi INC公司,CP100MX);透射电子显微镜(美国FEI公司,Tecnai G2 20 TWIN)。
二、实验方法
1.MSCs和MSCs-Exo的分离提取及鉴定:采用全骨髓法分离获取原代MSCs,取P4代细胞分别从细胞形态进行观察、流式鉴定表面标志物CD90、CD45、CD34、CD44、CD29、成骨成脂诱导实验鉴定其分化能力。待MSCs细胞密度长至70﹪ ~80﹪后,吸出培养基,PBS冲洗3遍,细胞分3组:(1)加无血清培养基 ;(2)加 Poly(i : c)1 μg/ml;(3)加LPS100 ng/ml于无血清培养基中培养。48 h后收集细胞上清液,1 500×g离心去除死细胞及细胞碎片,加外泌体提取试剂4 ℃过夜;10 000×g离心1 h,500 μl PBS重悬得外泌体。透射电镜下观察外泌体形态,取外泌体10 μl,用等体积平衡盐PBS溶液稀释,然后滴加于2 nm的载样铜网上,室温下静置3 min;滴加3﹪磷钨酸溶液室温负染5 min,室温干燥后,观察外泌体形态并拍照;采用BCA法和外泌体定量试剂盒测定所提外泌体的浓度;并使用Western bloting分析提取的外泌体标志性蛋白CD9、HSP70的表达情况。
2.TLRs信号通路激活的MSCs-Exo刺激巨噬细胞:取1只SD大鼠(150 ~ 250 g),无菌手术分离股骨、胫骨;1 ml注射器吸取2﹪FBS-RPMI-1640培养基反复冲洗骨髓腔并制成单细胞悬液,400×g离心去上清后,使用巨噬细胞培养基(含10﹪FBS、10﹪L929条件培养基的RPMI-1640),接种于6孔培养板中,置37 ℃、5﹪CO2条件下培养,2 d后首次换液,使用PBS洗去未贴壁细胞,并更换新鲜的巨噬细胞培养基,继续常规培养6 d得骨髓源M0型巨噬细胞。待细胞密度长至70﹪~ 80﹪后,细胞分6组,M0组(不经任何处理)、M1诱导组(加LPS 100 ng/ml)、M2 诱 导 组 (加 IL-4 20 ng/ml + IL-13 20 ng/ml)、MSCs-Exo 组(加 MSCs-Exo20 μg/ ml)、TLR3激活的MSCs-Exo组[加Poly(i : c)预处理的MSCs-Exo 20 μg/ml]、TLR4 激活的 MSCs-Exo 组(加LPS 预处理的 MSCs-Exo 20 μg/ml)48 h 后,分别收集各组中的巨噬细胞进行后续实验。
3.流式分析TLRs信号通路激活的MSCs-Exo对巨噬细胞表面标志物及细胞内因子表达的影响:取上述各组收集好的巨噬细胞分装于1.5 ml EP管中,流式分别检测表面标志CD206及细胞内因子iNOS、Arg-1、TNFα的表达。表面标志的测定方法:3﹪BSA-PBS重悬细胞,第1管为阴性对照,其余各管依次加入流式一抗,4 ℃避光40 min;每管加入1 ml 3﹪BSA-PBS,离心弃上清液,加入FITC标记的荧光二抗,室温避光20 min。PBS洗2遍,500 μl PBS重悬,上机检测。细胞内因子测定方法:巨噬细胞收集前6 h加入终浓度为2 µmol/L的蛋白转运酶抑制剂处理细胞以抑制细胞内因子的释放,使用4﹪多聚甲醛室温固定30 min;离心弃上清液,加1 ml 1×Permeabilization Buffer,离心弃上清液,加 100 μl 1×Permeabilization Buffer重悬细胞,按照抗体说明书方法加入胞内一抗及FITC 标记的荧光二抗,充分混匀后上机检测。
4.qPCR分析TLRs信号通路激活的MSCs-Exo对巨噬细胞炎症因子表达的影响:取上述收集好的各组巨噬细胞,酚氯仿法提取巨噬细胞总RNA。按照cDNA反转录试剂盒说明书反转录cDNA,然后进行 qPCR。扩增程序为:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃10 s,40个循环。实验均设3个复孔,qPCR实验数据用2-ΔΔCt法(Ct为荧光达到阈值时所需 PCR 的循环数),分析样本 CCL22、IL-1β、IL-6、IL-10的相对表达量。引物由上海生工生物技术有限公司合成,引物序列见表1。
三、统计学方法
采用SPSS l9.0统计软件,巨噬细胞免疫表型(CD206、Arg-1、TNF-α、iNOS)以及炎症因子(CCL22、IL-1β、IL-6、IL-10)表达水平以± s表示。MSCs-Exo、TLR4MSCs-Exo及 TLR3MSCs-Exo对M0型巨噬细胞极化影响组间比较采用独立t检验及单因素方差分析(多组间比较),以P< 0.05为差异有统计学意义。
结 果
一、MSCs和MSCs-Exo生物学特征及鉴定
倒置相差显微镜下观察MSCs成纤维样长梭形,细胞形态均一(图1a),MSCs成骨、成脂分化诱导后,油红O染色可见脂滴形成,茜素红S染色可见钙结节形成(图1b ~ c),这些结果表明培养的MSCs有多向分化潜能。流式细胞术分析P4代MSCs表面标志物,MSCs表达CD90(96.0﹪)、CD29(94.9﹪)、CD44(95.7﹪),不 表 达 CD34(4.50﹪)、CD45(4.62﹪)(图 2),符 合 公 认 的MSCs表型。透射电子显微镜下观察MSCs-Exo为圆形或椭圆形的双层膜结构,直径多为40 ~ 200 nm之间(图 3);Western blot显示提取的 MSCs-Exo其中表达外泌体标志性蛋白CD9、HSP70(图4)。
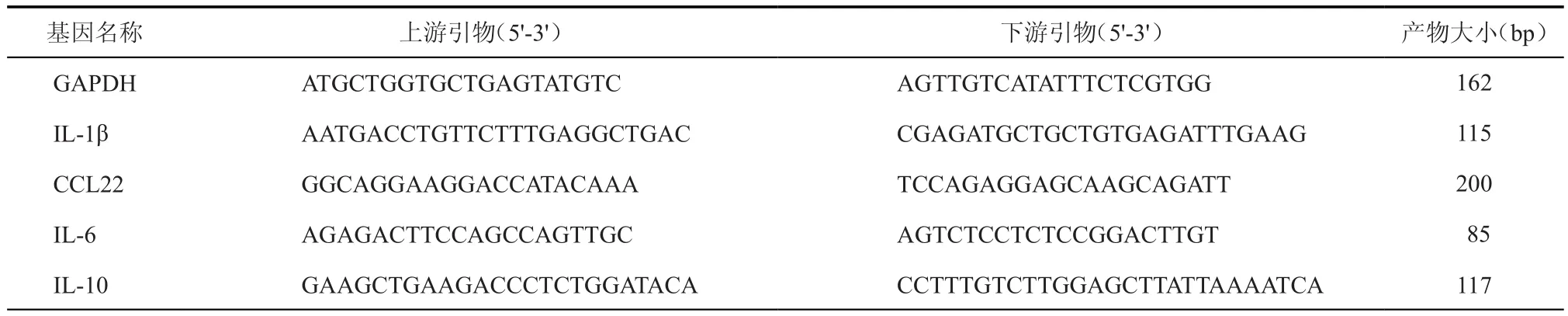
表1 引物序列
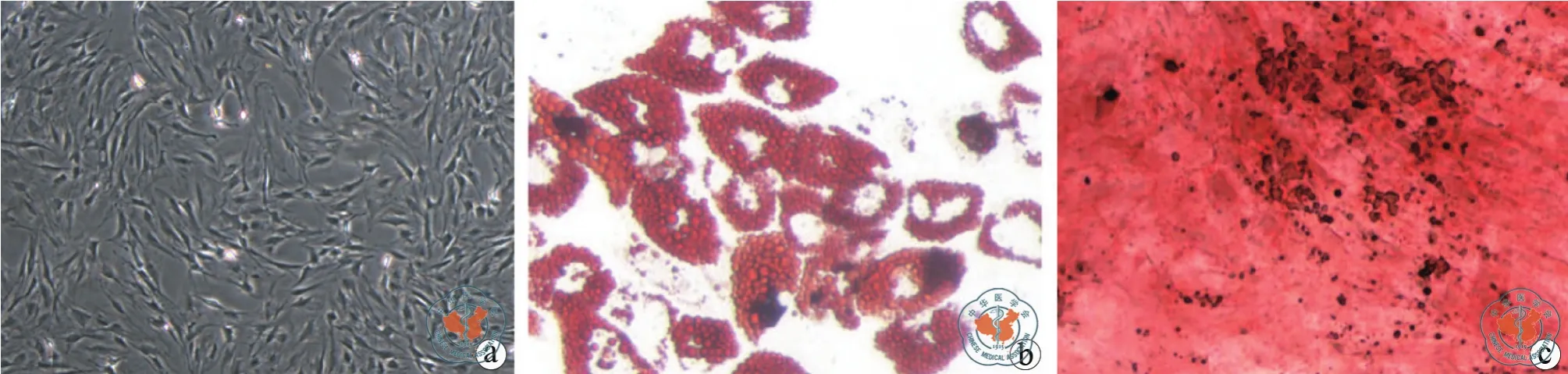
图1 倒置荧光显微镜下观察MSCs形态及成骨成脂诱导结果(油红O及茜素红S染色,×200)

图2 流式细胞术对MSCs表面标记物的鉴定结果
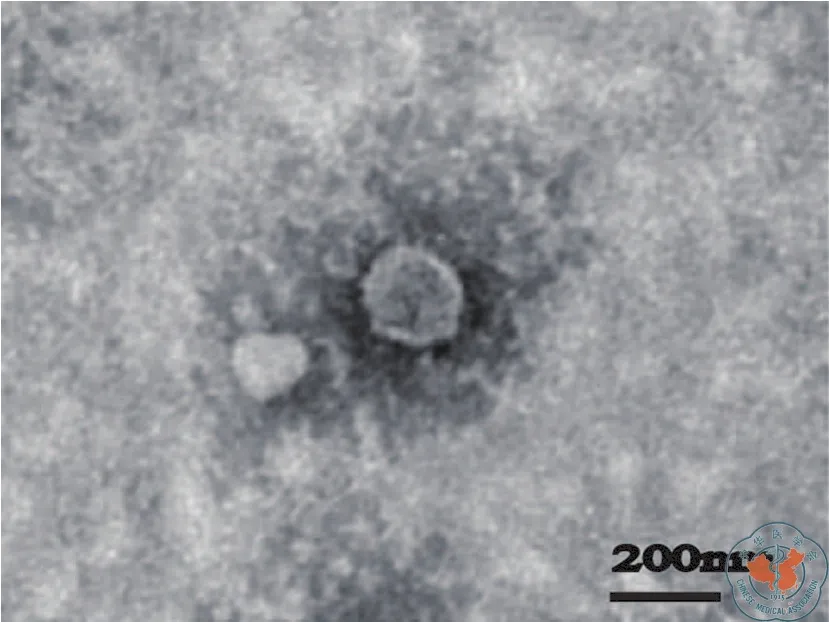
图3 透射电镜下MSCs-Exo的形态(200 nm,×30000)
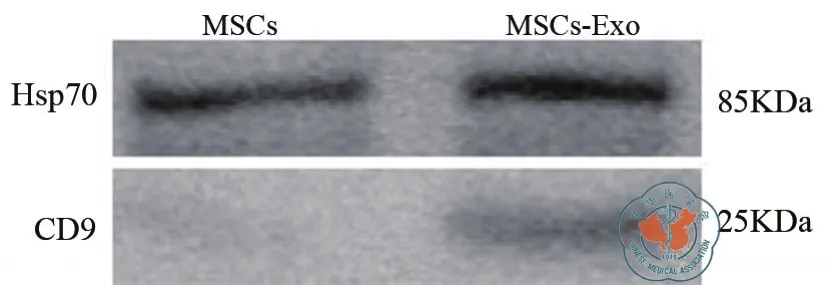
图4 Western blot鉴定MSCs-Exo
二、TLRs信号通路激活的MSCs- Exo促使M0型巨噬细胞向M2型极化
1.TLRs信号通路激活的MSCs-Exo对M0型巨噬细胞形态的影响:倒置相差显微镜观察不同处理组巨噬细胞形态。M0型圆形较多,细胞形态大小不一,伪足较短;M1型细胞出现伪足,形态均一;M2型细胞呈长梭形,或星形,伪足较多。观察MSCs-Exo及TLR3和TLR4信号通路激活的MSCs-Exo刺激的巨噬细胞呈长梭形,伪足较多,形态近似于M2型(图5)。
2.TLRs信号通路激活的MSCs-Exo使M0型巨噬细胞免疫表型发生改变:流式分析不同处理组巨噬细胞表型的变化,与对照组相比MSCs-Exo及TLR3和TLR4信号通路激活的MSCs-Exo刺激的巨噬细胞均高表达CD206、Arg-1、低表达TNF-α,差异具有统计学意义(P均< 0.05);而MSCs-Exo刺激的巨噬细胞低表达iNOS(P <0.001),差异具有统计学意义(P< 0.05),TLR3和 TLR4信号通路激活的MSCs-Exo刺激的巨噬细胞iNOS表达差异无统计学意义(表2)。结果表明,MSCs-Exo及TLR3和TLR4信号通路激活的MSCs-Exo均能使M0型巨噬细胞极化为M2型。
3.TLRs信号通路激活的MSCs-Exo对M0型巨噬细胞细胞因子表达水平的影响:qPCR分析不同处理组巨噬细胞mRNA相对表达量,与对照组比较MSCs-Exo及TLR3和TLR4信号通路激活的MSCs-Exo刺激的巨噬细胞CCL22、IL-10mRNA水平均升高,差异具有统计学意义(P均< 0.05);而IL-1β、IL-6mRNA水平均下降,差异具有统计学意义(P均< 0.05)(表3)。PCR结果与上述流式结果一致,更进一步说明MSCs-Exo及TLR3和TLR4信号通路激活的MSCs-Exo能促进M0型巨噬细胞向M2型巨噬细胞转换。
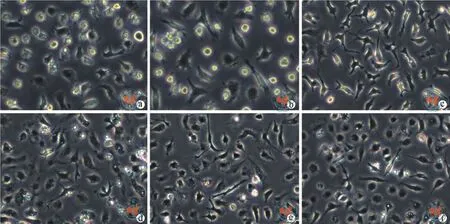
图5 倒置相差显微镜下观察巨噬细胞形态(×400)
表2 FCM分析各组巨噬细胞表面蛋白CD206、Arg-1、iNOS、TNF-α的表达(± s)
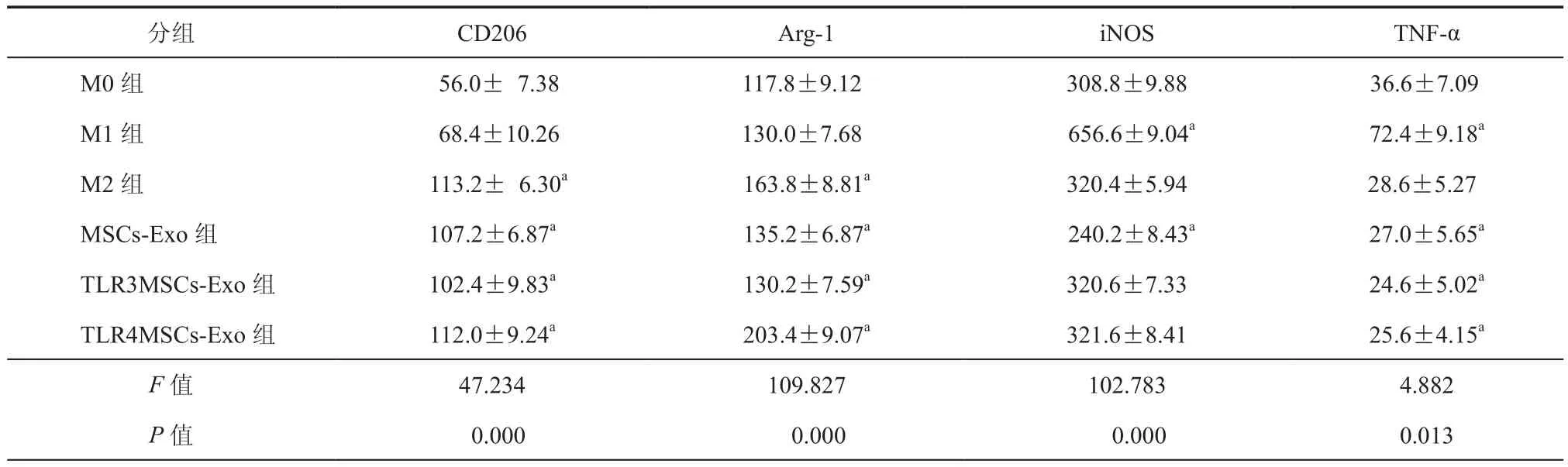
表2 FCM分析各组巨噬细胞表面蛋白CD206、Arg-1、iNOS、TNF-α的表达(± s)
注:实验至少重复3次,与M0组进行比较,aP < 0.05
分组 CD206 Arg-1 iNOS TNF-α M0 组 56.0± 7.38 117.8±9.12 308.8±9.88 36.6±7.09 M1 组 68.4±10.26 130.0±7.68 656.6±9.04a 72.4±9.18a M2 组 113.2± 6.30a 163.8±8.81a 320.4±5.94 28.6±5.27 MSCs-Exo 组 107.2±6.87a 135.2±6.87a 240.2±8.43a 27.0±5.65a TLR3MSCs-Exo 组 102.4±9.83a 130.2±7.59a 320.6±7.33 24.6±5.02a TLR4MSCs-Exo 组 112.0±9.24a 203.4±9.07a 321.6±8.41 25.6±4.15a F值 47.234 109.827 102.783 4.882 P值 0.000 0.000 0.000 0.013
表3 qPCR分析各组巨噬细胞炎症因子IL-10、CCL22、IL-1β、IL-6的表达( ± s)
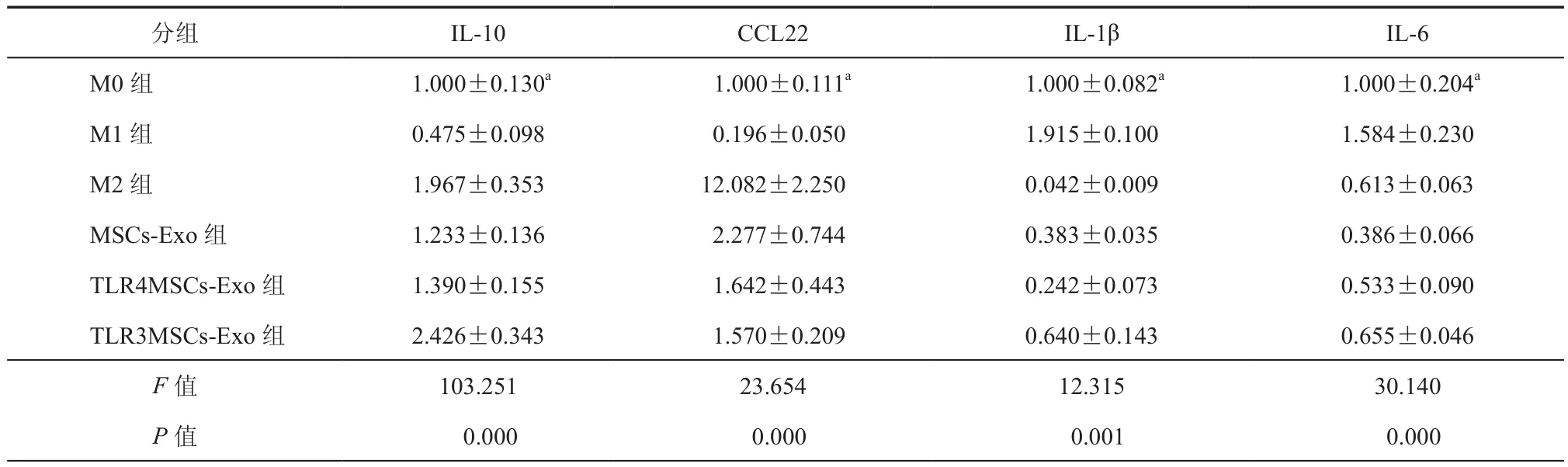
表3 qPCR分析各组巨噬细胞炎症因子IL-10、CCL22、IL-1β、IL-6的表达( ± s)
注:实验至少重复3次,与各实验组比较,aP < 0.05
分组 IL-10 CCL22 IL-1β IL-6 M0 组 1.000±0.130a 1.000±0.111a 1.000±0.082a 1.000±0.204a M1 组 0.475±0.098 0.196±0.050 1.915±0.100 1.584±0.230 M2 组 1.967±0.353 12.082±2.250 0.042±0.009 0.613±0.063 MSCs-Exo 组 1.233±0.136 2.277±0.744 0.383±0.035 0.386±0.066 TLR4MSCs-Exo 组 1.390±0.155 1.642±0.443 0.242±0.073 0.533±0.090 TLR3MSCs-Exo 组 2.426±0.343 1.570±0.209 0.640±0.143 0.655±0.046 F值 103.251 23.654 12.315 30.140 P值 0.000 0.000 0.001 0.000
讨 论
近年来,关于MSCs免疫调节功能方面的研究越来越多[9]。巨噬细胞是重要的天然免疫细胞,在炎症微环境中扮演着重要的作用[10]。MSCs对巨噬细胞极化的影响是近年来研究的重点,而最近的报道指出MSCs在调节巨噬细胞极化的过程中,外泌体发挥了重要的作用[4,11]。基于这样的背景,本研究将焦点放在了MSCs所分泌的外泌体上,探讨不同TLRs信号通路激活的MSCs-Exo对巨噬细胞极化的影响。
巨噬细胞参与机体炎症反应整个过程,并扮演着重要的作用,不同的炎症因子能使其向不同的表型极化[12]。本实验中使用含10﹪FBS、10﹪L929条件培养基的RPMI-1640成功培养获得M0型巨噬细胞,并依据参考文献[13-14]用LPS诱导巨噬细胞极化为M1型,IL-4和IL-13诱导巨噬细胞极化为M2型,诱导时间为48 h,作为本实验的对照组。研究结果中,经LPS刺激后巨噬细胞伪足增多,呈长梭形,且高表达 iNOS、TNF-α、IL-1β、IL-6,符合M1型巨噬细胞特征;经IL-4和IL-13刺激后巨噬细胞呈长梭形或星形,伪足较多,且高表达CD206、Arg- 1、CCL22、IL-10,符合 M2型巨噬细胞特征。以上结果表明本研究成功诱导获得M1型和M2型巨噬细胞。
大量研究表明MSCs-Exo能使巨噬细胞向M2型极化[4,11],实验中本研究提取了MSCs来源的外泌体,电镜下观察其为圆形双层膜结构,直径在40 ~200 nm之间,表达外泌体标志性蛋白CD9、HSP70;这些MSCs外泌体的基本生物学特性与文献报道一致[15-17],在本实验中也观察到由MSCs-Exo刺激的巨噬细胞呈现出M2型巨噬细胞的特征,如:流式分析CD206、Arg-1表达上升,iNOS、TNF-α表达下降;qPCR分析CCL22、IL-10表达上升,IL-1β、IL-6表达下降。
Waterman等[18]研究发现采用特定的TLRs激动剂poly(i : c)和LPS激活MSCs上相应的TLR3和TLR4受体后,将导致MSCs分泌不同的细胞因子,表现为促炎MSCs1型和抗炎MSCs2型。鉴于此,研究不同极化类型的MSCs对临床应用研究具有重要意义。因此,本研究推测不同TLRs信号通路激活的MSCs-Exo可能也会不同,在本实验中也证实了TLR3和TLR4信号通路激活的MSCs- Exo能影响巨噬细胞的极化。研究结果中,巨噬细胞经TLR3和TLR4信号通路激活的MSCs- Exo刺激 48 h后,CD206+、Arg-1+细胞数增高,TNF-α+细胞数减少;qPCR 分析(CCL22、IL- 10)和(IL- 1β、IL-6)mRNA表达水平也相应的升高和降低。结果说明TLR3和TLR4信号通路激活的MSCs-Exo均能使巨噬细胞极化为M2型。
综上所述,本研究初步证实了MSCs-Exo以及TLR3和TLR4信号通路激活的MSCs-Exo均能使巨噬细胞极化为M2型。这为MSCs-Exo的临床应用提供了体外理论支持,但TLR3和TLR4信号通路激活的MSCs-Exo对巨噬细胞极化的影响机制还需下一步继续研究。
1 Genin M, Clement F, Fattaccioli A, et al.M1 and M2 macrophages derived from THP-1 cells differentially modulate the response of cancer cells to etoposide[J].BMC Cancer, 2015,15(1):577.
2 Chistiakov DA, Bobryshev YV, Nikiforov NG, et al.Macrophage phenotypic plasticity in atherosclerosis: The associated features and the peculiarities of the expression of inf l ammatory genes[J].Int J Cardiol,2015, 184(1):436-445.
3 Edin S, Wikberg ML, Rutegard J, et al.Phenotypic skewing of macrophagesin vitroby secreted factors from colorectal cancer cells[J].PLoS One, 2013, 8(9):e74982.
4 Ti DD, Hao HJ, Tong C, et al.LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].J Transl Med, 2015,13:308.
5 Németh K, Leelahavanichkul A, Yuen PS, et al.Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production[J].Nat Med, 2009, 15(1):42-49.
6 Betancourt AM.New cell-based therapy paradigm: induction of bone marrow-derived multipotentmesenchymal stromal cells into proinflammatory MSC1, and Anti-inflammatory MSC2, phenotypes[J].Adv Biochem Eng Biotechnol, 2013, 130:163-197.
7 Wang Y, Chen XD, Cao W, et al.Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications[J].Nat Immunol, 2014, 15(11):1009-1016.
8 Kou X, Xu X, Chen C, et al.The Fas/Fap-1/Cav-1 complex regulates IL-1RA secretion in mesenchymal stem cells to accelerate wound healing[J].Sci Transl Med.2018, 10(432).
9 连真珍, 林绍强.骨髓间充质干细胞的特性及应用基础研究进展[J/CD].中华细胞与干细胞杂志(电子版), 2013, 3(1):22-26.
10 Arora S, Dev K, Agarwal B, et al.Macrophages:theirrole,activation and polarization in pulmonary diseases[J].Immunobiology, 2018, 223(4-5):383-396.
11 Zhao H, Shang QW, Pan ZZ, et al.Exosomes from Adipose-Derived stem cells attenuate adipose inflammation and obesity through polarizing M2 macrophages and beiging in white adipose tissue[J].Diabetes, 2018, 67(2):235-247.
12 Shiratori H, Feinweber C, Luckhardt S, et al.THP-1 and human peripheral blood mononuclear cell-derived macrophages differ in their capacity to polarizein vitro[J].MolImmunol, 2017, 88:58-68.
13 Lu LY, Loi F, Nathan K, et al.Pro-inflammatory M1 macrophages promote Osteogenesis by mesenchymal stem cells via the COX-2-prostaglandin E2 pathway[J].J Orthop Res, 2017, 35(11):2378-2385.
14 Wu KQ, Muratore CS, So EY, et al.M1 macrophage-induced endothelial-to-mesenchymal transition promotes infantile hemangioma regression[J].Am JPathol, 2017, 187(9):2102-2111.
15 Yu B, Zhang XM, Li XR.Exosomes derived from mesenchymal stem cells[J].Int J MolSci, 2014, 15(3):4142-4157.
16 冯啸, 陈良, 张琪, 等.人脐带间充质干细胞来源的外泌体减轻肝脏缺血再灌注损伤及机制的初步研究[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(04):224-230.
17 侯宇, 周霞, 蔡维乐, 等.骨髓间充质干细胞对巨噬细胞极化的影响[J].中华肝脏病杂志, 2017, 25(4):273-278.
18 Waterman RS, Tomchuck SL, Henkle SL, et al.A new mesenchymal stem cell (MSC) paradigm: polarization into a pro-inf l ammatory MSC1 or an immunosuppressive MSC2 phenotype[J].PLoS One, 2010,5(4):e10088.
