青藏高原土壤低温产蛋白酶菌株的筛选及酶学性质研究
2018-06-08权淑静王一雯解复红刘德海
权淑静,马 焕,王一雯,解复红,刘德海*
(1.河南省工业酶工程技术研究中心,河南 郑州 450008;2.河南省科学院生物研究所有限责任公司,河南 郑州 450008)
蛋白酶是催化肽键水解的一类酶,广泛存在于动物、植物和微生物中,执行许多不同的生理功能[1]。蛋白酶是应用最广泛的酶制剂之一,可用于食品加工、洗涤剂、医药诊断、酿造、皮革、蛋白水解以及纺织、化妆品等的生产和生物材料的提取上[2-5]。根据蛋白酶催化温度大致分为高温酶、常温酶和低温酶。低温蛋白酶最适催化温度在40℃以下,并且在20~30℃仍能保持较高酶活(50%以上)[6]。低温蛋白酶最适催化温度接近自然环境中的温度,对热敏感,与中高温蛋白酶相比具有催化效率高、节能、省时等特点,因此在食品、冷水洗涤、医用疫苗等行业更具优越性[7-9]。产低温蛋白酶菌株多筛选自天然低温环境中,由于生存环境温度较低,为了能更好地利用环境中的资源,经过长期的进化适应,它们分泌的胞外蛋白酶的最适酶活温度也较低[10]。自20世纪70年代以来,世界上已有许多实验室在从事低温蛋白酶的研究,目前,已从海水、嗜冷的鱼类和贝类以及高山、南北极泥土、天山等样品中分离到产低温蛋白酶菌株[11],主要有假单胞菌属(Pseudomorms)、黄杆菌属Flavobacterium)、交替单胞菌属(Alteromonas)等[12-14]。
“世界屋脊”青藏高原平均海拔4 000 m以上,大片地区年平均气温不足10℃,海拔高、气温低,生态条件独特而复杂,是研究地学、生物学、资源与环境等领域的天然实验室。作者于2012年采集沿川藏线和青藏线的青稞田、小麦田、马铃薯田土壤样品13份,并进行了菌株的分离保藏。对分离菌株进行产酶活性的评估,发现分离到的菌株能产生多种胞外酶,比如有的菌株产生淀粉酶[15]。该研究在低温条件下对高原菌株功能性蛋白酶进行了筛选,以期寻找低温蛋白酶生产菌株,为高原菌资源利用提供科学依据,为今后工业应用和进一步开展分子生物学方面的研究及低温蛋白酶产品的应用与开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
通过对来源于青藏高原土壤样品进行微生物菌种的分离、培养与筛选,获得产蛋白酶菌株,活性最高的一株筛选自拉萨郊区小麦根际土壤,命名为LS20-2。
1.1.2 培养基
1.0%脱脂奶粉平板分离培养基:(1)脱脂奶粉1 g,蒸馏水50 mL,115 ℃蒸汽灭菌15 min;(2)蛋白胨1.0 g,酵母粉0.5 g,NaCl 1.0 g,琼脂1.5 g,蒸馏水50 mL,121 ℃蒸汽灭菌25 min。将两瓶溶液混匀后倒平板。
液体发酵培养基:酪蛋白1.0 g,酵母粉0.4 g,葡萄糖1.0g,K2HPO40.1 g,Mg2SO40.02 g,蒸馏水100 mL,pH自然,115℃蒸汽灭菌20 min。
斜面保藏培养基:LB培养基。
1.1.3 主要试剂
DNA提取试剂盒:美国Promega公司;2×EsTaqMaster Mix:北京康为世纪生物科技有限公司;通用引物27F、1492R:深圳华大基因科技有限责任公司;Trans2K Marker:北京全式金生物技术有限公司;脱脂奶粉:美国BD公司;福林酚试剂:美国Sigma-Aldrich公司;蛋白胨、酵母粉:英国Oxid公司;其他试剂为国产分析纯。
1.2 仪器与设备
Multifuge X1R离心机:德国Thermo公司;Thermoblock PCR扩增仪:德国Biometra公司;System蛋白质双向电泳系统:美国BIO-RAD公司;QYC-2012C恒温摇床:上海福玛实验设备有限公司;722紫外可见光分光光度计:北京普析通用仪器有限公司。
1.3 实验方法
1.3.1 低温条件下产蛋白酶菌株的筛选
菌株初筛:采于青藏高原的土样用梯度稀释法分离菌株并保藏于-80℃。将保存的高原菌种接种于LB平板,20℃活化培养48 h,用灭菌牙签挑取单菌落点接于脱脂奶粉平板中,在4~20℃之间低温培养,挑选可以在低温条件下生长并产生水解圈的菌落,选取透明圈直径与菌落直径比值大的菌株作为初筛的产蛋白酶菌株。
菌株复筛:将低温下能产蛋白酶的菌株接种于液体发酵培养基中,20℃发酵72~96 h后离心,取上清,测定发酵液中蛋白酶活性,选取活性最高的菌株。
粗酶液的制备:将发酵液8 000 r/min离心10 min,取上清液。
蛋白酶酶活测定方法:参照GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》方法。底物和酶液分别在40℃条件下预热2 min,取0.5 mL稀释到合适倍数的酶液,与0.5 mL底物在40℃条件下准确反应10 min,立即加入1 mL 10%三氯乙酸终止反应。40℃条件下继续保温10min后离心,取0.5mL上清液加入0.4mol/L碳酸钠2.5 mL,混匀加入0.5 mL福林酚试剂,混匀后在40℃保温20 min。对照管终止反应后再加底物。以水代替滤液做空白调仪器零点,用分光光度计测定波长680 nm处样品与对照管OD680nm值,通过线性回归方程求出生成酪氨酸浓度。标准曲线用不同浓度的酪氨酸来制定。
蛋白酶活力单位(U/mL)定义:每1 mL酶液在一定温度与pH条件下1 min水解酪蛋白产生1 μg酪氨酸的酶量。
相对酶活[16]:相对酶活是以同组实验中活性最高点的值为100%,其余实验点的值与该点的值之比,通常以百分数表示。
1.3.2 菌株的鉴定
参照《常见细菌系统鉴定手册》进行菌株形态观察、菌体特征描述[17]。菌株的16S rDNA序列分析,具体步骤如下:
(1)基因组DNA提取:按细菌DNA提取试剂盒操作手册进行。
(2)聚合酶链式反应(polymerase chain reaction,PCR)扩增:扩增体系为50 μL,包括无菌双蒸水19 μL,正向和反向引物各2 μL,模板DNA2 μL,2×EsTaqMasterMix25 μL。PCR扩增引物:27F(5'-AGAGTTTGATCCTGGCTCA-3)';1492R(5'-GGTTACCTTGTTACGACTT-3)'。反应条件:每个反应30个循环,每个循环包括94℃变性30 s,56℃退火30 s,72℃延伸1.5 min;最后72℃延伸10 min,首次循环在95℃条件下预变性2 min。
(3)琼脂糖切胶纯化
用DNA胶回收试剂盒回收1 500 bp左右的目的片段,电泳检测纯化后DNA纯度和含量。
(4)目的片断的TA克隆和筛选
以pGEMR-T为载体进行TA连接,连接体系为10 μL,包括2×Rapid Ligation Buffer 5 μL,pGEMR-T Vector 1 μL,PCRproduct3μL,T4DNA Ligase 1 μL。于42℃条件下转化到E.coliDH5α菌株。最后涂布于含有氨苄青霉素的LB平板中。通过蓝白斑筛选阳性克隆。
(5)质粒DNA提取和菌落PCR鉴定
质粒提取按照OMEGA公司的质粒提取试剂盒操作步骤进行。菌落PCR以SP6(5'-ATTTAGGTGACACTATAG-3)'、T7(5'-TAATACGACTCACTATAGGG-3)'为引物。
(6)DNA测序
将PCR扩增产物经琼脂糖凝胶电泳检测后,送华大基因测序。通过GenBank数据做相似性分析。
1.3.3 粗酶液酶学性质初步研究
酶反应最适温度:将离心后的粗酶液稀释至合适倍数,在不同温度下与底物进行反应,温度梯度设置为0、10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃,测定酶活,确定反应最适温度。
酶的热稳定性:将稀释适当倍数的粗酶液分别在0、10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃保温1 h,40℃条件下测定剩余酶活。
酶反应最适pH:用不同pH的缓冲液分别配制pH为3.0、5.0、7.0、9.0、11.0的1%酪蛋白溶液作为底物,用相应pH的缓冲液稀释酶液测定酶活。
酶反应pH稳定性:将酶液用相应pH的缓冲液稀释至适当倍数,在4℃下放置20 h,40℃条件下测定剩余酶活。
各种金属离子和化合物对酶活的影响:在反应体系中分别加入乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、Mg2+、Ca2+、Na+、Zn2+、Fe2+、K+、Cu2+、Co2+、Mn2+、Tween-20、Tween-80、Triten X-100,使反应体系中离子浓度达到2 μmol/mL,测定酶活。
2 结果与分析
2.1 低温条件下产蛋白酶菌株筛选
复筛过程中粗酶液酶活>50 U/mL的菌株见表1,由表1可知,菌株LS20-2的酶活最高,达到202.2 U/mL,且发酵过程中有特殊香味,因此确定菌株LS20-2为出发菌株,进行下一步的菌株鉴定及酶学性质研究。
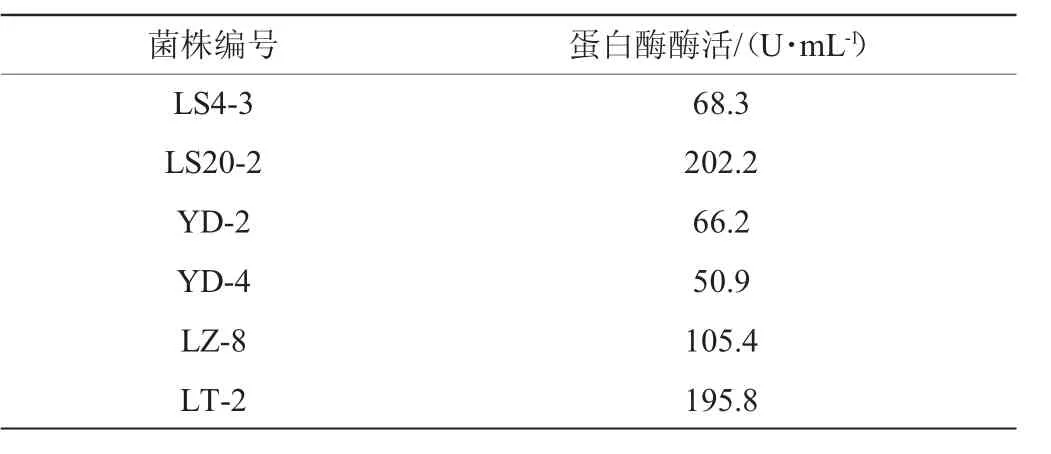
表1 低温下产蛋白酶菌株筛选结果Table 1 Screening results of protease-producing strain atlow temperature
2.2 菌种鉴定
2.2.1 生理生化特征
菌株LS20-2为革兰氏染色,结果为革兰氏阳性菌。参照《常见细菌系统鉴定手册》,对菌株LS20-2进行生理生化鉴定试验,结果如表2所示。由表2可知,菌株LS20-2能水解酪蛋白、明胶、淀粉,使硝酸盐还原。
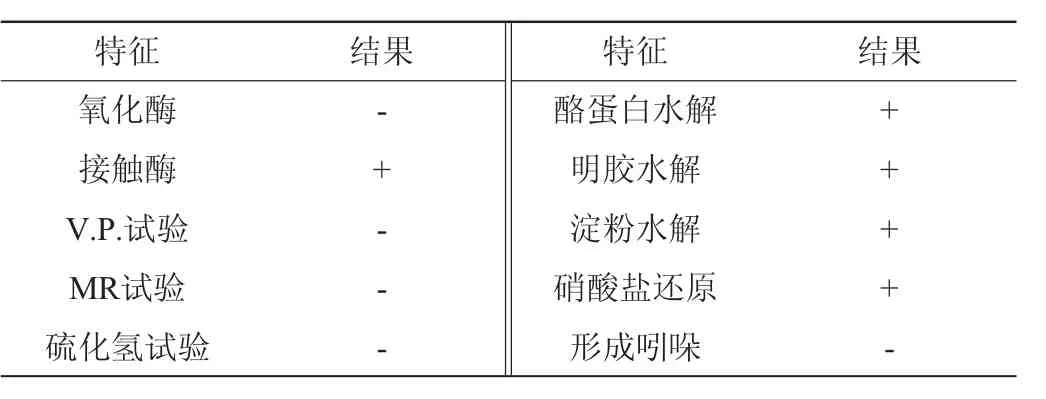
表2 菌株LS20-2生理生化鉴定结果Table 2 Physiological and biochemical identification results of strain LS20-2
2.2.2 分子生物学鉴定
以菌株LS20-2基因组DNA为模板进行克隆测序。经PCR扩增后,结果见图1。由图1可知,该菌株16S rDNA片段长约1 500 bp,根据所得到序列在ezbiocloud网站上进行序列比对分析,选择相关的参考菌株序列,进行聚类分析,构建系统发育树,结果见图2。
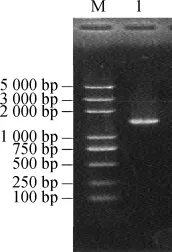
图1 菌株LS20-2 16S rDNA PCR扩增结果Fig.1 PCR amplification results of 16S rRNA of strain LS20-2
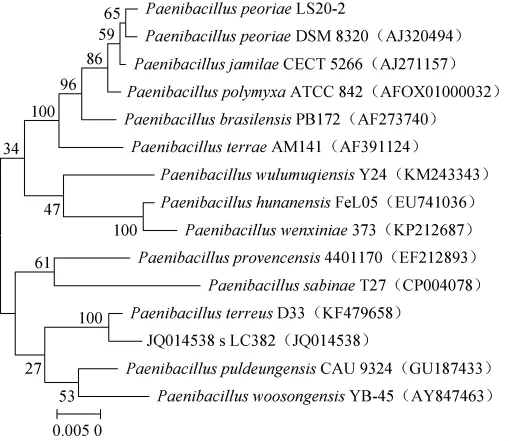
图2 菌株LS20-2 16S rDNA序列系统发育树Fig.2 Phylogenetic tree of strain LS20-2 based on 16S rRNA sequences
由图2可知,菌株LS20-2与Paenibacillus peoriaeDSM 8320在同一分支,序列相似性为99.66%。综合菌株的形态特征、生理生化特性、16S rDNA序列以及系统进化树的结果,可以将分离菌株LS20-2鉴定为皮氏类芽孢杆菌(Paenibacillus peoriae)。
2.3 菌株LS20-2产蛋白酶性质研究
2.3.1 温度对酶活力影响及酶的热稳定性研究
分别在不同温度梯度进行酶促反应,测定蛋白酶的活力。以活性最大值为100%,温度对蛋白酶相对酶活的影响结果如图3所示。由图3可知,该蛋白酶最适反应温度为40℃,0~40℃时,酶活随温度的升高而稳步上升,温度高于50℃后,酶活迅速降低,60℃时仅有最高酶活的30.7%。
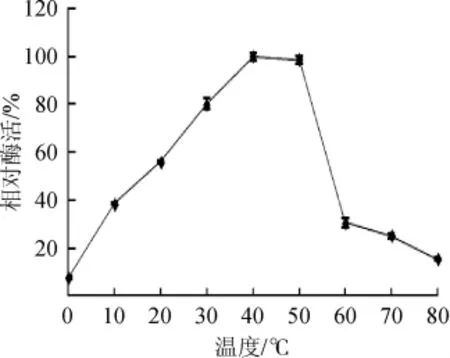
图3 温度对酶活力的影响Fig.3 Effect of temperature on enzyme activity
将上述制备的稀释酶液分别在不同温度梯度下水浴保温1 h,放入冰水混合物中,与未被保温处理的酶活力相比较,测定蛋白酶剩余活力。菌株LS20-2所产蛋白酶的热稳定性如图4所示,蛋白酶在0~40℃内活力稳定,高于50℃后迅速失活,50℃保温1 h后仅剩原活性的26.1%,80℃处理1 h后,活性仅为原活性的5.6%。
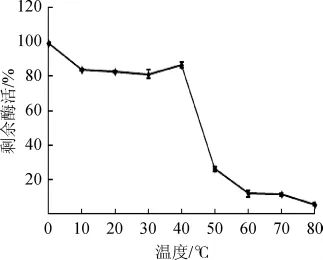
图4 温度对酶的稳定性影响Fig.4 Effect of temperature on enzyme stability
2.3.2 pH对酶活力的影响及pH稳定性研究
配制pH 3.0(柠檬酸-柠檬酸钠)、pH 5.0(柠檬酸-柠檬酸钠)、pH 7.0(磷酸氢二钠-磷酸二氢钠)、pH 9.0(甘氨酸-氢氧化钠)、pH 11.0(碳酸钠-氢氧化钠)缓冲液,分别用缓冲液配不同pH的1%酪蛋白溶液作为底物,测定蛋白酶酶活。
pH对蛋白酶相对酶活的影响结果见图5。由图5可知,在酸性条件下,蛋白酶的相对活性仅为2.6%~8.1%,当pH>5.0以后,酶活迅速升高,pH 7.0时酶活达到最高值,说明酶最适反应pH为7.0;在pH7.0~9.0蛋白酶表现出较高活力,反应pH>9.0后缓慢下降,当反应pH至11.0时还有47.7%酶活。
将酶液用不同pH的缓冲液稀释,4℃保存20 h后,测定剩余酶活力,结果见图6。由图6可知,酶液在pH5.0~7.0条件下保持稳定,处理后仍保持98%以上酶活,属于中性蛋白酶。
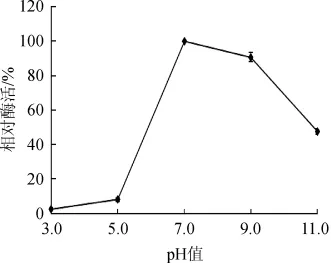
图5 pH值对酶活力的影响Fig.5 Effect of pH on enzyme activity
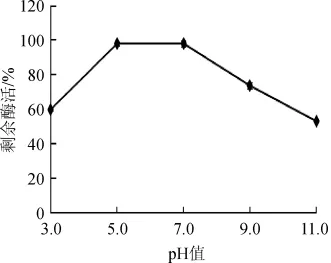
图6 pH值对酶的稳定性影响Fig.6 Effect of pH on enzyme stability
2.3.3 各种金属离子和化合物对酶活的影响
在酶反应最佳温度和最佳pH条件下,于反应体系中加入不同抑制剂,使反应体系中离子浓度达到2 μmol/mL,以未加抑制剂的酶活力为对照100%,不同金属离子对酶解液相对酶活的影响结果见图7。由图7可知,各种金属离子对酶活的影响存在差异,Mn2+、Tween-80、Tween-20对酶活有明显的激活作用,相对酶活分别达到134.6%、127.1%和115.4%;Zn2+、Fe2+、Triten X-100对酶活有抑制作用,其中以Zn2+的抑制作用最强,相对酶活降至78%,Mg2+、EDTA、Na+、Ca2+、K+、Cu2+、Co2+对酶活影响不大。
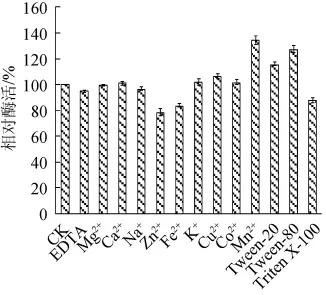
图7 金属离子对酶活力的影响Fig.7 Effect of metal ion on enzyme activity
3 结论
本研究从拉萨郊区小麦根际土壤中筛选出的产蛋白酶菌株LS20-2,经初步鉴定为皮氏类芽孢杆菌(Paenibacillus peoriae)。通过对发酵液进行酶学性质初步研究,结果表明:该蛋白酶的最适反应pH为7.0,最适温度为40℃。在pH 5.0~7.0,温度0~40 ℃时酶活稳定,金属离子Fe2+、Zn2+及Triten X-100能抑制蛋白酶活性,金属离子Mn2+及表面活性剂Tween-20、Tween-80能提高蛋白酶活性。
[1]刘海军,乐超银,邵 伟,等.一株高产蛋白酶芽孢杆菌的鉴定[J].中国酿造,2009,28(9):18-20.
[2]RAO M B,TANKSALE A M,GHATGE M S,et al.Molecular and biotechnological aspects of microbial proteases[J].Microbiol Mol Biol Rev,1998,62(3):597-635.
[3]YANG J K,SHIH I L,TZENG Y M,et al.Production and purification of protease fromBacillus subtilisthat can deproteinize crustacean wastes[J].Enzyme Microb Technol,2000,26(5-6):406-413.
[4]VARELA H,FERRARI M D,BELOBRAJDIC L,et al.Skin unhairing proteases ofBacillus subtilis:production and partial characterization[J].Biotechnol Lett,1997,19(8):755-758.
[5]高兆建,陈尚龙,巫有华,等.产低温弹性蛋白酶菌株的筛选及酶学特性分析[J].食品与生物技术学报,2012,3(10):1106-1111.
[6]JOSHI S,SATYANARAYANA T.Biotechnology of cold-active proteases[J].Biology,2013,2(2):755-783.
[7]莫清珊,张会图,田 耀,等.低温蛋白酶产生菌的筛选及其酶学性质的初步研究[J].天津科技大学学报,2015,30(3):19-23.
[8]KASANA R C.Proteases from psychrotrophs:An overview[J].Crit Rev Microbiol,2010,36(2):134-145.
[9]MAEGESIN R,DIEPLINGER H,HOFMANN J,et al.A cold-active extracellular metalloprotease fromPedobacter cryoconitis:production and properties[J].Res Microbiol,2005,156(4):499-505.
[10]陈秀兰,张玉忠,高培基,等.渤海湾浅表海水中产低温蛋白酶适冷菌的筛选[J].海洋科学,2000,24(9):42-45.
[11]倪永清,顾燕玲,史学伟,等.天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育[J].微生物学报,2013,53(2):164-172.
[12]SINGH S K,SINGH S K,TRIPATHI V R,et al.A novel psychrotrophic,solvent tolerantPseudomonas putidaSKG-1 and solvent stability of its psychrothermoalkalistable protease[J].Process Biochem,2014,46(7):1430-1435.
[13]陈明霞,李和阳,陈维维,等.68株北极产蛋白酶菌株的筛选、鉴定以及部分酶学性质[J].微生物学报,2013,53(7):702-709.
[14]XIONG H,SONG L,XU Y,et al.Characterization of proteolytic bacteria from the Aleutian deep-sea and their protease[J].J Ind Microbiol Biot,2007,34(1):63-71.
[15]权淑静,马 焕,刘德海,等.青藏高原土壤产α-淀粉酶菌株的分离、鉴定及产酶特性研究[J].河南科学,2015,33(3):384-388.
[16]马 焕,权淑静,刘德海,等.产木聚糖酶菌株的筛选、鉴定及其酶学性质研究[J].中国酿造,2016,35(12):123-128.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-390.
