灰树花多糖结构特点及其生物活性研究进展
2018-06-08张宗启吴天祥刘力萍
张宗启,吴天祥,2*,刘力萍
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 明德学院,贵州 贵阳 550025)
灰树花(Grifola frondosa)是一种珍贵的药食两用真菌,隶属于担子菌门、层菌纲、非褶菌目、多孔菌科、树花菌属,又名贝叶多孔菌、千佛菌、莲花菌、栗子蘑等,日本称之为“舞茸”(Maitake),美国称之为“林鸡”(hen of the woods)[1-2]。在我国主要分布于云南、四川、河北、黑龙江、吉林、广西、西藏、福建等地。野生灰树花主要产于海拔800~1 400 m的阔叶林下,喜好温暖的气候和潮湿的土壤,其形态可分为菌丝体和子实体两大部分,其中菌丝体作为灰树花深层发酵的产物,颜色为乳白色,形态呈大小均匀的球形;而作为可食部分的子实体是一种富含蛋白质、维生素E和多种矿质元素的营养食品[3]。
此外,灰树花也是一味具有保健功能的中药。我国传统医学认为,灰树花甘凉、无毒,具有清除暑热、补脾益气的功效。在药用上,具有许多医疗和保健功能。经常食用子实体,对治疗高血压、肥胖症有一定疗效。其中,灰树花最大的药用价值是由灰树花菌丝体、子实体与发酵液中分离的一类富含β-(1→6)、β-(1→3)糖苷键的真菌多糖,即灰树花多糖(Grifola frondosapolysaccharide,GFP)。类似于绝大多数的真菌多糖(如灵芝多糖,虫草多糖等),灰树花多糖也具有中药生物活性,如抗肿瘤[4-5]、抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)[6]、调节机体免疫力[7]、抗氧化[8]和清除自由基[9]等。但多糖结构复杂,链键结构共分为α型和β型两种,其中β构型是多糖拥有生物学活性的主体部分[10]。
目前关于灰树花多糖的研究,大多数以灰树花多糖产量及多糖的生物学活性为出发点,探寻优化多糖产量培养基、添加外源物诱导多糖产量、分离纯化所得多糖和多糖的抗氧化、抗肿瘤等活性,对灰树花多糖分子结构同生物学活性之间的关联研究较少。所以本文以灰树花多糖一级结构为出发点,旨在探讨灰树花多糖的结构特征与生物学活性之间的关系。1多糖结构及特征
多糖是一种多聚物,有同型多糖和异型多糖两大类之分。一些生物学活性与其自身的结构、糖苷键的连接方式、分子质量、聚合度以及直链的分支度有关。通常情况下,研究多糖的物理化学及结构特征主要包括多糖分子质量、糖苷键的类型、糖苷键的位置、单糖组成等方面[11-12]。研究基本化学结构的方法通常有红外光谱(infrared spectroscopy,IR)、气相色谱(gas chromatography,GC)、高效液相色谱(high performance liquid chromatography,HPLC)、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)、高碘酸氧化、Smith降解和甲基化分析等[13]。表1列举了20种灰树花多糖,包含多糖分子质量、单糖组成、化学结构和生物学活性等。
1.1 多糖分子质量(纯度)
多糖的性质在一定程度上由多糖分子质量大小决定,即多糖分子质量的测定为多糖的性质奠定了基础。多糖分子质量有不同的鉴定手段,如高效液相色谱法、高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)、黏度法、渗透压和蒸汽压法等。实验室鉴定多糖分子质量通常使用高效液相色谱法和高效凝胶渗透色谱法[32]。MA X L等[22]通过高效液相色谱法测得灰树花多糖GFP-A的分子质量为8.5×105Da。ZHAO C等[23]应用高效凝胶渗透色谱法对灰树花深层发酵多糖GFP1进行检测,结果为4.1×104Da。此外,张媛媛等[33]通过高效液相色谱法测得灰树花子实体多糖GFD-1的分子质量为3.0×104Da。由此可以得出,不同种类、不同实验条件下的灰树花多糖分子质量不同,但范围近似于104~106Da之间。
1.2 多糖的单糖组成
单糖组成是研究多糖结构的一个重要指标,通常研究多糖的单糖组成,先通过酸解、衍生化处理使糖苷键断裂,再采用纸层析、薄层层析及气相色谱法测定等。近些年,高效液相色谱法也运用于单糖和低聚糖的分析,可实现不需衍生化直接上样使其操作简便且有较高的分辨率[34]。在目前的研究中,因为多糖的来源不同,灰树花多糖中单糖的组成存在差异。YANG B K等[28]在分离分析灰树花发酵菌丝体多糖EX-GF,得到了3种多糖:EX-GF-Fr.I、EX-GF-Fr.II、EX-GF-Fr.III。其单糖组成如表1所示。LI Q等[20]在分离纯化灰树花富硒粗多糖时,得到多糖Se-GFP-22,通过气相色谱分析得,该多糖含甘露糖、葡萄糖和半乳糖三种单糖,比例为3.3∶23.3∶1.0。由此得出,不同种类、不同的实验手段下灰树花多糖的单糖组成和比例也不尽相同。
此外,多糖的分子质量和单糖组成一定程度上决定多糖溶液的黏稠度。通常情况下,分子质量低、单糖组成在三种之内的多糖溶液颜色较浅且不黏稠,反之,分子质量大、单糖组成种类较多的多糖溶液颜色较深且黏稠呈凝胶状。一般按多糖黏稠度来划分,黏稠度最大的是灰树花子实体多糖,其次是灰树花菌丝体多糖,最后是灰树花深层发酵多糖。
1.3 化学结构
同多糖的分子质量和单糖组成两指标相比而言,多糖一级结构的测定较为困难,除了实验步骤繁琐之外,对多糖的纯度也有很高的要求。目前,主要通过有机波谱的方法最大程度上解析多糖结构。ZHAO C等[23]对分离纯化后具有抗病毒活性的灰树花多糖GFP1进行傅里叶-红外光谱(Fourier transform infrared spectrometer,FT-IR)和核磁共振一维氢谱分析,结果发现多糖GFP1主要由β-(1→6)-D-葡聚糖组成的主链,支链主要由α-(1→3)-D-葡聚糖组成,整个多糖分子结构有较高的延展性。此外,WANG Y等[18]通过傅里叶-红外光谱、完全酸水解、Smith降解、甲基化分析、核磁共振一维碳谱、氢谱和二维易核位移相关谱对灰树花多糖GFPBW2进行结构分析,结果表明,此多糖主要由β-(1→3)-D-葡聚糖和β-(1→4)-D-葡聚糖为主链,支链是通过C-6号位上的O-6与β-D-葡聚糖相连,具体结构式见图1。

表1 不同的灰树花多糖分子质量、结构及生物学活性Table 1 Molecular mass,structure and bioactivities of different kinds of polysaccharides fromG.frondosa
续表
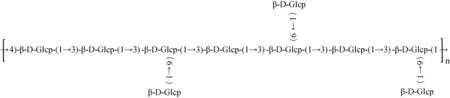
图1 灰树花多糖GFPBW2重复单元结构Fig.1 Structure of the GFPBW2 repeating unit ofG.frondosapolysaccharides
2 多糖的生物活性
自20世纪80年代开始,许多科学家对灰树花多糖的生物活性进行了大量药理作用实验与临床试验,结果表明,灰树花多糖具有抗氧化、免疫调节、抗肿瘤及促进胶原蛋白合成等作用。
2.1 抗氧化活性
自然界中诸多生物,如动植物、细菌及真菌等,自身本就分泌较强的抗氧化物质,其中就包括多糖。基于抗氧化的各种测定方法与活性指标,抗氧化活性一直是作为中药真菌多糖营养保健和治疗效果机理的重点研究对象[35]。目前,国内外有大量研究表明灰树花多糖具有抗氧化活性。CHEN G T等[36]在灰树花多糖GFP抗氧化的研究中,通过分离纯化得到GFP-1、GFP-2和GFP-3这3种多糖,研究3种多糖对3种自由基清除率、还原力、亚铁离子螯合能力及大鼠肝脏脂肪氧化的抑制率四个方面的影响,结果表明,3种多糖均有抗氧化能力,其中GFP-2较GFP-1和GFP-3的抗氧化活性最强。同样,LEE B C等[37]发现灰树花菌丝体多糖G-2、G-3、P-1、P-3有显著的生物活性,其中G-2、G-3有较强的抗氧化活性,P-3还能够促进纤维原细胞的增殖,显著增加了胶原质的纤维合成,合成率达80%,所以,此结论一方面论证了灰树花多糖具有强抗氧化能力的同时,另一方面还证实了多糖具有显著提高成纤维细胞增殖的能力。
2.2 免疫调节活性
一直以来,免疫调节活性被视作多糖重要的生物活性功能,其主要作为生物调节剂和免疫调节剂使用。MENGM等[38]研究了灰树花子实体多糖GFP在小鼠腹腔巨噬细胞RAW264.7的增殖活性,结果发现GFP在一定范围内可以显著促进RAW264.7的增殖且显著增强细胞免疫刺激活性,如细胞因子和趋化因子的形成等。NORIKO K等[39]研究灰树花多糖的免疫调节活性,提取到灰树花D-组分,把此组分多糖作用于正常的荷瘤小鼠,观察到其能影响小鼠的正常免疫系统,包括巨噬细胞、树突状细胞、自然杀伤(natural killer,NK)细胞等。NK细胞能直接攻击细菌和病毒感染后的细胞,并产生γ-干扰素,进而调节正常和特定的免疫系统,将多糖连续3 d注射小鼠后,对巨噬细胞、树突状细胞、NK细胞进行分析,结果显示灰树花多糖组分能活化NK细胞,刺激机体的免疫力。韩丽荣等[40]在研究中发现,灰树花多糖A组分免疫活性时发现,A-组分能够提高RAW264.7细胞分泌NO的能力,并提升了肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-1β和干扰素-γ(interferon-γ,IFN-γ)等细胞因子的分泌以及细胞中iNOS的mRNA的表达水平,CD3+T淋巴细胞在一定程度上反映了细胞免疫的整体水平。
2.3 抗肿瘤活性
多糖的抗肿瘤活性往往与分子质量大小、水溶解度大小及结构的分支程度有关。通常分子质量越大,水溶解度越高,则多糖抗肿瘤活性就越高。多糖通过不同的机制对肿瘤细胞有抑制作用,目前被接收抗肿瘤的机制主要概括如下四类:(1)口服多糖预防肿瘤发生;(2)改善对肿瘤的免疫反应;(3)诱导肿瘤细胞凋亡;(4)预防肿瘤细胞在体内扩散和迁移[41]。王艳停[42]研究灰树花多糖(GFP)抑制人结肠癌细胞HT-29情况发现,在一定浓度范围内GFD可明显抑制HT-29的细胞增殖,从蛋白水平检测发现,GFD可造成HT-29细胞内胞内磷脂酰肌醇3-激酶(phosphatidylinositol-3 kinase,PI3K)蛋白表达下调,促分裂原活化蛋白激酶蛋白表达上调,引起线粒体上的B淋巴细胞瘤-2-基因(B-cell lymphoma-2,Bcl-2)表达下降、Bax蛋白表达上升,使诱导细胞凋亡因子Caspase-8蛋白表达上调,进而促进人体结肠癌细胞HT-29细胞发生凋亡。MAO G H等[24]在提取水溶性灰树花多糖GP11后,研究其对肝癌肿瘤细胞的抑制能力时发现,当GP11剂量在108mg/kg时肝癌细胞抑制能力最高,最高可达56.16%。LIN E S等[43]在研究中也发现,从所筛选出的灰树花TFRI1073菌株中提取到的灰树花胞外多糖,能对肺癌(A549细胞)和乳腺癌(MDA-MD-231细胞)癌细胞株起明显的抑制作用。
2.4 其他生物活性
除了上述3种生物活性外,灰树花多糖还具有降血糖、抗乙型肝炎病毒(hepatitis B virus,HBV)等活性功能。周富川等[44]研究发现,灰树花多糖GFP-2能促进PI3k/Akt(磷脂酰肌醇3-激酶)胰岛素信号通路关键蛋白的活性,促使GSK-3(糖原合成酶激酶3)表达量的下降,从而使糖原合成的代谢增强,改善胰岛素抵抗功效,最终实现降低血糖的功能。MA X等[45]在建立人肝癌细胞HepG2模型发现,灰树花多糖可以增强HepG2细胞对葡萄糖的摄取,激活细胞膜中的胰岛素受体蛋白,增加磷酸化-AktSer473的产生,从而缓解胰岛素抵抗作用。赵霏等[46]以重组的HBV DNA全基因组和抗G418质粒转染人肝癌细胞株HepG2建立的细胞株HepG2.2.15细胞为模型,对灰树花多糖的药理作用研究表明,灰树花多糖(maitake polysaccharide,MP)虽然对HepG2.2.15细胞增殖影响较小,但对乙肝表面抗原(HBeAg)的分泌和HBV DNA的复制有较强的抑制作用,因此灰树花多糖可以作为一种有效低毒的抗HBV药物,为临床应用提供理论支持。
3 多糖分子质量、结构特点及生物学活性的关联
不同品种、处理手段及实验方法所得多糖的分子质量、结构和生物学活性是不相同的。多糖不同的生物活性取决于其结构参数,如分子质量、水溶性、取代基团、取代位置、取代程度、单糖种类及糖苷键位置等分子构造紧密相关。近年来,关于多糖结构与功能的关系研究较少。就灰树花而言,其多糖结构与生物学活性之间没有明确的研究来分析它们之间的关联性,根据目前研究,有些关联可推断如下:
(1)众所周知,多糖的分子质量与其生物学活性密切相关,较高的分子质量可以更好的维持多糖的空间构像,进而一定程度上影响多糖的生物活性。CUI F J等[26]在分离纯化灰树花多糖GFG-3后得到多糖GFG-3a、GFG-3b和GFG-3c,其中GFG-3a纯度最高、分子质量也最高。在抗肿瘤细胞活性的研究中发现,GFG-3与GFG-3a对小鼠肉瘤细胞S180和人体肝癌细胞Bel7402抑制率明显较强,且GFG-3a抑制效果略高于GFG-3。此外,对于多糖提取而言,不同的多糖提取条件会直接影响多糖分子质量的大小。OHNO N等[47]通过研究不同方法对灰树花子实体多糖的提取发现,热水提法、冷碱提法和热碱提法所得β-(1→3)-D-葡聚糖的分子质量不同,分别为5.6×106Da、7.5×105Da和1.2×106Da。此外,SUCH等[48]通过对多糖温度调控时发现,不同的提取温度(如70℃、100℃和121℃)会显著的影响(1→3)-D-葡聚糖和(1→6)-D-葡聚糖的含量,进而影响多糖分子质量和水溶性多糖的生物活性。
(2)多糖可分为三大类:中性多糖、酸性多糖和碱性多糖(壳聚糖)。其中酸性多糖是由糖醛酸组成的复杂的酸性碳水化合物,而糖醛酸可以改变碳水化合物相关的物理化学性质和溶解性,从而影响多糖的抗氧化活性等。简而言之,富含糖醛酸的多糖有更高的抗氧化活性[49]。CHEN Y等[50]研究灵芝子实体多糖时,分别对灵芝多糖组分PSG-1及PSG-2进行体外抗氧化活性实验,结果表明含糖醛酸含量多的PSG-2表现出较强的抗氧化性。
(3)有研究报道,多糖的结构:如以β-(1→3)连接方式为主链的多糖对抑制肿瘤的活性较强,主要是因为它能够通过激活巨噬细胞活性的功能,增加了免疫细胞的活性,产生和释放TNF-a激活补体系统等途径,形成天然和获得性免疫系统对肿瘤细胞的免疫应答[51];除此之外,β-(1→6)-D-葡聚糖同样是构成多糖具有免疫调节和抗肿瘤活性的物质[52]。在已对灰树花生物学活性的报道中,OHNO N等[52]研究证明β-(1→4)-葡聚糖不参与灰树花多糖的抗肿瘤活性,且得到具有抗肿瘤活性的β-(1→3)-D-葡聚糖,此葡聚糖具有螺旋和天然两种构型;另有研究证明[53]β-(1→3)-D-葡聚糖在灰树花子实体中呈现一种具有高自由度的天然状态。此外,MASUDA Y等[31]在对灰树花抗肿瘤研究中发现,灰树花多糖组分MZF结构中主链含有β-(1→3)-D-葡聚糖和β-(1→6)-D-葡聚糖,具有较强的抗肿瘤活性。所以基于灰树花多糖结构方面的研究对多糖抗肿瘤机制的揭示是非常重要的。
(4)一系列化学修饰,如硫酸化、磷酸化、羧甲基化、乙酰化和硒化等,能显著提高多糖的生物活性。其中硫酸化中硫酸根基团能使端基碳的氢原子活泼,增加多糖聚合电解质和亲核性、增加与金属铁的接触,从而增强清除力;羧甲基化和乙酰化能将多糖支链上的羟基被羧甲基和乙酰基取代,使多糖结构伸展,提高多糖在水中的溶解度;而硒化多糖具有有机硒和多糖双重的药理作用,能产生更强的活性[54-55]。ZHAND W N等[56]在对灰树花培养液中分离得到胞外多糖(exopolysaccharides,EPS),通过羧甲基化和硒化修饰,得到羧甲基胞外多糖(carboxymethyl-EPS,CM-EPS)和富硒胞外多糖(Se-EPS),通过比较三种多糖的抗氧化和抗肿瘤活性发现,CM-EPS和Se-EPS的抗氧化能力明显优于EPS,且同EPS相比,Se-EPS能显著抑制Hela细胞的增殖,结果得出,羧甲基化和硒化对提高灰树花胞外多糖的抗氧化和抗肿瘤活性有很大的影响。MAO G H[57]在研究富硒多糖生物活性时发现,灰树花硒多糖Se-GP对于DPPH自由基、ABTS自由基和氢自由基的清除能力均高于多糖GP,且同浓度情况下,Se-GP对氢自由基的清除率最高。
4 结论和展望
目前,随着基因组学、转录组学和蛋白质组学这三大组学的快速发展,“糖组学”这个概念,作为一种新的研究领域被更多的研究者所探究,这也将为灰树花多糖的开发利用提供宝贵的研究前景。根据自身所具有的活性功能,灰树花多糖已被数家食品行业、保健品行业和医药行业所研究为有效保健品。此外,对多糖分子结构而言,由于灰树花多糖的分子质量及结构的复杂多样性,多糖的结构特点同生物学活性之间并未建立系统有效的关系,需要研究者们进一步研究总结二者的相关性。如果能进一步的解析灰树花多糖的结构特点及其生物活性作用机制,那么灰树花多糖将作为一种高效的生长调节剂在食品工业、医疗行业等工业领域得到更广泛的应用。总而言之,灰树花多糖会因自身价格低廉、毒副作用低、药源性广等特点,在医疗行业上继续用来进行动物体内实验与临床研究,从而进一步说明此大分子化合物对人类医药行业的贡献性。
[1]贺宗毅,吴天祥,徐晓宝.中药天麻成分对灰树花胞外多糖合成及相关关键酶的影响[J].食品科学,2013,34(11):199-202.
[2]WU C Y,WU T X.Effect of the main ingredients ofRhizoma gastrodiaeon mycelial biomass and exopolysaccharide productions by submerged culture ofGrifola frondosa[J].Int J Food Scid Technol,2015,50(8):1726-1730.
[3]朱俊杰,吴天祥,吴彩云,等.对羟基苯甲醇对灰树花产胞外多糖的影响及其发酵动力学[J].食品科学,2016,37(19):123-127.
[4]SUZUKI I,HASHIMOTO K,OIKAWA S,et al.Antitumor and immunomodulating activities of a beta-glucan obtained from liquid-culturedG.frondosa[J].Chem Pharm Bull,1989,37(2):410-413.
[5]GARY D,HONG L,ANDREW S.A phase I/II trial of a polysaccharide extract fromGrifola frondosa(Maitake mushroom)in breast cancer patients:immunologicaleffects[J].J Cancer Res Clin Oncol,2003,135(9):1215-1221.
[6]HIROAKI N,NORIKO K,DOUGLAS S,et al.Effect of Maitake(Grifola frondosa)glucan in HIV-infected patients[J].Mycoscience,2000,41(4):293-295.
[7]NORIKO K,TADAHIRO K,HIROAKI N.Stimulation of the natural immune system in normal mice by polysaccharide from maitake mushroom[J].Mycoscience,2003,44(3):257-261.
[8]LIN E S.Production of exopolysaccharides by submerged mycelial culture ofGrifola frondosaTFRI1073 and their antioxidant and antiproliferative activities[J].World J Microbiol Biotechnol,2011,27(3):555-561.
[9]LEE B C,BAE J T,PYO H B,et al.Biological activities of the polysaccharides produced from submerged culture of the edible basidiomyceteGrifola frondosa[J].Enzyme Microb Technol,2003,32(5):574-581.
[10]钟 敏,吴天祥,聂文强,等.灰树花菌丝体β-葡聚糖提取工艺优化[J].中国酿造,2017,36(8):90-94.
[11]NIE S P,XIE M Y.A review on the isolation and structure of tea polysaccharides and their bioactivities[J].Food Hydrocolloid,2011,25(2):144-149.
[12]YANG L Q,ZHANG L M.Chemical structural and chain conformation-al characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohyd Polym,2009,76(3):349-361.
[13]WANG Y J,LIU X Q,ZHANG J Z,et al.Structural characterization andin vitroantitumor activity of polysaccharides fromZizyphus jujubacv.Muzao[J].RSC Adv,2015,5(11):7860-7867.
[14]OHNO N,SUZUKI I,SATO K,et al.Antitumor activity and structural characterization of glucans extracted from cultured fruit bodies ofGrifola frondosa[J].Chem Pharm Bull,1984,32(3):1142-1151
[15]NANBA H,HAMAGUCHI A,KURODA H.The chemical structure of an antitumor polysaccharide in fruit bodies ofGrifola frondosa(Maitake)[J].Chem Pharm Bull,1987,35(3):1162-1168.
[16]ZHOU C,WU A Z,TANG Q,et al.Isolation and purification of GFLP,a high-molecule polysaccharide fromGrifola frondosafruit bodies,and its effect on immune cells[J].Acta Edul Fungi,2013,20:39-42.
[17]FANG J P,WANG Y,LV X F,et al.Structure of a β-glucan fromGrifola frondosaand its antitumor effect by activating Dectin-1/Syk/NF-B signaling[J].Glycoconjugate J,2012,29:365-377.
[18]WANG Y,FANG J,NI X,et al.Inducement of cytokine release by GFPBW2 a novel polysaccharide from fruit bodies ofGrifola frondosa,through dectin-1 in macrophages[J].J Agric Food Chem,2013,61(47):11400-11409.
[19]ZHAO T,FAN Y N,MAO G H,et al.Purification,characterization and antioxidant activities of enzymolysis polysaccharide fromGrifola frondosa[J].Iran J Pharm Res,2017,16(1):347-356.
[20]LI Q,WANG W,ZHU Y,et al.Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enrichedGrifola frondosa[J].Carbohyd Polym,2017,161:42-52.
[21]MAO G H,REN Y,L I Q,et al.Anti-tumor and immunomodulatory activity of selenium(Se)-polysaccharide from Se-enrichedGrifola frondosa[J].Int J Biol Macromol,2016,82:607-613.
[22]MA X L,MENG M,HAN L,et al.Structural characterization and immunomodulatory activity ofGrifola frondosapolysaccharide via toll-like receptor 4-mitogen-activated protein kinases-nuclear factor KB pathways[J].Food Funct,2016,7(6):2763-2772.
[23]ZHAO C,GAO L Y,WANG C Y,et al.Structural characterization and antiviral activity of a novel heteropolysaccharide isolated fromGrifola frondosaagainst enterovirus 71[J].Carbohyd Polym,2016,144:382-389.
[24]MAO G H,REN Y,FEND W W,et al.Antitumor and immunomodulatory activity of a water-soluble polysaccharide fromGrifola frondosa[J].Carbohyd Polym,2015,134:406-412.
[25]MA X L,MENG M,HAN L R,et al.Immunomodulatory activity of macromolecular polysaccharide isolated fromGrifola frondosa[J].Chin J Nat Med,2015,13(12):0906-0914.
[26]CUI F J,ZAN X Y,LI Y H,et al.Purification and partial characterization of a novel anti-tumor glycoprotein from cultured mycelia ofGrifola frondosa[J].Int J Biol Macromol,2013,62(11):684-690.
[27]CUI F J,TAO W Y,XU Z H,et al.Structural analysis of anti-tumor heteropolysaccharide GFPS1b from the cultured mycelia ofGrifola frondosaGF9801[J].Bioresource Technol,2007,98(2):395-401.
[28]YANG B K,GU Y A,JEONG Y T,et al.Chemical characteristics and immuno-modulating activities of exobiopolymers produced byGrifolafrondosaduring submerged fermentation process[J].Int J Biol Macromol,2007,41(3):227-233.
[29]WANG Y,SHEN X,LIAO W,et al.Aheteropolysaccharide,L-fuco-D-manno-1,6-α-D-galactan extracted fromGrifola frondosaand antiangiogenic activity of its sulfated derivative[J].Carbohyd Polym,2014,101(1):631-641.
[30]XU H,LIU J,SHEN Z,et al.Analysis of chemical composition,structure ofGrifola frondosapolysaccharides and its effect on skin TNF-β levels,lgG content,T lymphocytes rate and caspase-3 mRNA[J].Carbohyd Polym,2010,82(3):687-691.
[31]MASUDA Y,MATSUMOTO A,TOIDA T,et al.Characterization and antitumor effect of a novel polysaccharide fromGrifola frondosa[J].J Agric Food Chem,2009,57:10143-10149.
[32]ZHAO L Y,DONG Y H,CHEN G T,et al.Extraction,purification,characterization and antitumor activity of polysaccharides fromGanoderma lucidum[J].Carbohyd Polym,2010,80(3):783-789.
[33]张媛媛,孟 梦,王明飞,等.灰树花多糖的分离纯化及体外抗肝癌作用研究[J].食品研究与开发,2016,37(15):1-5.
[34]陈阳阳.石耳子实体多糖的分离纯化、结构解析及生物活性研究[D].南京:南京农业大学,2015.
[35]SCHLESIER K,HARWAT M,BOHM V,et al.Assessment of antioxidant activity by using differentin vitromethods[J].Free Radical Res,2002,36(2):177-187.
[36]CHEN G T,MA X M,LIU S T,et al.Isolation,purification and antioxidant activities of polysaccharides fromGrifola frondosa[J].Carbohyd Polym,2012,89(1):61-66.
[37]LEE B C,BAE J T,PYO H B,et al.Biological activities of the polysaccharides produced from submerged culture of the edible basidiomyceteGrifola frondosa[J].Enzyme Microb Tech,2003,32(5):574-581.
[38]MENG M,CHENG D,HAN L R,et al.Isolation,purification,structural analysis and immunostimulatory activity of water soluble polysaccharides fromGrifola frondosafruiting body[J].Carbohyd Polym,2017,157:1134-1143.
[39]NORIKO K,TADAHIRO K,HIROAKI N.Stimulation of the natural immune system in normal mice by polysaccharide from maitake mushroom[J].Mycoscience,2003,44(3):257-261.
[40]韩丽荣,程 代,王莉蕊,等.灰树花胞外多糖的结构及免疫调节活性[J].生物工程学报,2016,32(8):1-9.
[41]REN L,PERERA C,HEMAR Y.Antitumor activity of mushroom polysaccharides:A review[J].Food Funct,2012,3(11):1118-1130.
[42]王艳停.灰树花多糖对HT-29细胞的抗癌作用及机制研究[D].天津:天津科技大学,2017.
[43]LIN E S.Production of exopolysaccharides by submerged mycelial culture ofGrifola frondosaTFRI1073 and their antioxidant and antiproliferative activities[J].World J Microbiol Biotechnol,2011,27(3):555-561.
[44]周富川.灰树花多糖降血糖活性及作用机理的研究[D].天津:天津科技大学,2012.
[45]MA X,ZHOU F,CHEN Y,et al.A polysaccharide fromGrifola frondosarelieves insulin resistance of HepG2 cell by Akt-GSK-3 pathway[J].Glycoconjugate J,2014,31(5):355-363.
[46]赵 霏,宋 雷,郭培燕,等.灰树花多糖抑制乙型肝炎病毒活性的研究[J].食品与生物技术学报,2017,36(6):667-671.
[47]OHNO N,SUZUKI I,SATO K,et al.Purification and structural characterization of an antitumor β-1,3-glucan isolated from hot water extract of the fruit body of culturedGrifola frondosa[J].Chem Pharml Bull,2008,33(10):4522-4527.
[48]SU C H,LAI M N,NG L T.Effects of different extraction temperatures on the physicochemical properties of bioactive poly-saccharides fromGrifola frondosa[J].Food Chem,2017,220:400-405.
[49]JIN M L,ZHAO K,HUANG Q S,et al.Isolation,structure and bioactivities of the polysaccharides fromAngelica sinensis(Oliv.)Diels:A review[J].Carbohyd Polym,2012,89(3):713-722.
[50]CHEN Y,XIE M Y,NIE S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoderma atrum[J].Food Chem,2008,107(1):231-241.
[51]WASSER S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Appl Microbiol Biotechnol,2002,60(3):258-274.
[52]OHNO N,ADACHI Y,SUZUKI I,et al.Two different conformations of antitumor glucans obtained fromGrifola frondosa[J].Chem Pharm Bull,1986,34(6):2555-2560.
[53]OHNO N,OHSAWA M,SATO K,et al.Conformation of grifolan in the fruit body ofGrifola frondosaassessed by carbon-13 cross polarization-magic angle spinning nuclear magnetic resonance spectroscopy[J].Chem Pharm Bull,1987,35(6):2585-2588.
[54]孟思彤,徐艳芝,王振月.多糖的化学修饰对其生物活性影响研究进展[J].天然产物研究和开发,2014,26:1901-1905.
[55]LI Q,WANG W,ZHU Y,et al.Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enrichedGrifola frondosa[J].Carbohyd Polym,2017,161:42-52.
[56]ZHAND W N,LU Y M,ZHANG Y P,et al.Antioxidant and antitumour activities of exopolysaccharide from liquid-culturedGrifola frondosaby chemical modification[J].Int J Food Sci Technol,2016,51(4):1055-1061.
[57]MAO G H,ZOU Y,FENG W W,et al.Extraction,preliminary characterization and antioxidant activity of Se-enriched Maitake polysaccharide[J].Carbohyd Polym,2014,101(1):213-219.
