埋线预处理对ZDF大鼠缺血再灌注损伤的保护作用及机制研究
2018-06-08王一茗杨晓月张新昕
王一茗,杨晓月,张新昕
急性心肌梗死(AMI)是全球范围内死亡及致残的主要原因之一[1]。对缺血心肌进行及时有效的再灌注,减少缺血带来的损伤及缩小梗死面积是临床治疗目标。然而,再灌注过程中可能引发缺血再灌注损伤(IRI),细胞凋亡是IRI过程中的重要环节[2]。有研究显示,缺血预处理(IP)及其他预处理手段可发挥内源性保护作用,从而减轻由缺血再灌注对心肌造成的损伤[3-4]。YAN等[5]指出,IP与自噬有许多共同特征,自噬在IP减轻再灌注损伤且保护心肌方面具有重要作用。而细胞凋亡又与自噬关系密切,且存在交互效应,两者具有多个共同的调控元件,如Bcl-2、Bax、Caspase-3等。同时,多项研究均证实,针灸预处理可减轻缺血再灌注对心肌造成的损伤,对心肌具有保护作用[6-9]。本研究探讨中医学经典外治法穴位埋线对IRI后ZDF大鼠心肌细胞凋亡及自噬的影响。
1 材料与方法
1.1 实验动物 2015年1月—2016年5月,选取SPF级雄性ZDF大鼠24只,8周龄,体质量220~230 g,购于北京维通利华实验动物技术有限公司〔许可证号:SCXK(京)2012-0001〕。本研究获得江苏大学附属医院生物医学研究伦理委员会批准。
1.2 主要试剂及仪器 Tween-20、十二烷基硫酸钠(SDS)粉末(biotopped试剂公司),Western专用脱脂奶粉(美国BD公司),甲叉双丙烯酰胺(美国Sigma公司),Western blotting、BeyoECL Plus及IP裂解液(上海碧云天生物技术有限公司),Bcl-2、Bax及Caspase-3试剂盒(Abcam公司),过氧化氢酶(CAT)及一氧化氮(NO)酶联免疫吸附试剂盒(上海慧颖生物科技公司)。冷冻离心机(德国适马股份有限公司),SDS电泳仪和转膜仪、垂直凝胶电泳槽、凝胶成像系统(美国Bio-rad公司),脱色摇床(沃德生物医学仪器公司),全自动图像分析系统(上海TANON科技有限公司)。
1.3 分组 采用随机数字表法,将ZDF大鼠分为4组,各6只。空白组常规饲养,不做任何处理。缺血再灌注组饲养7 d后缺血30 min,再灌注60 min。缺血预处理组饲养7 d后缺血5 min,再灌注5 min,反复3次后,缺血30 min,再灌注60 min。埋线预处理组第1天对内关、膻中、心俞穴进行埋线,7 d后缺血30 min,再灌注60 min。
1.4 缺血再灌注方法 ZDF大鼠腹腔注射10%水合氯醛(0.4 ml/100 g)麻醉,仰卧并固定于手术台上,剪毛、气管插管,连接小动物呼吸机。开胸暴露心脏,剪开心包,冠状动脉左心室前降支位于左心耳下缘约0.15 cm处,绕左室支穿线,线两端穿聚乙烯小管形成闭环,术中连续观测心电图Ⅱ导联变化,以ST段明显抬高为心肌缺血成功标志,松开闭环后ST段下降1/2以上为明显再灌注成功。
1.5 穴位埋线方法 埋线预处理组选择内关、膻中、心俞穴进行埋线预处理。内关穴位于前肢内侧,离腕关节约3 mm,尺桡骨缝间,左右各一,直刺1 mm;膻中穴位于双乳之间,前正中线上,平第4、5肋间,斜刺1.5 mm;心俞穴位于第5胸椎下,两旁各一,直刺6 mm。
1.6 检测指标
1.6.1 血清CAT、NO ZDF大鼠再灌注60 min,用含有乙二胺四乙酸(EDTA)抗凝剂的采血管采血2 ml,以3 000 r/min离心10 min(离心半径为10 cm),收集分离血清后静置于-20 ℃冰箱,酶联免疫吸附法测定CAT、NO水平。
1.6.2 心肌组织蛋白Bcl-2、Bax及Caspase-3 动物模型制备成功后取心脏,置于4%多聚甲醛与0.25%戊二醛固定液中,-80 ℃冰箱保存。取各组心肌组织,加入3倍体积的组织裂解液,冰水浴中充分研磨成组织匀浆,放置10 min。4 ℃条件下以15 000×g离心10 min;加入蛋白上样液,沸水煮5 min。BCA法测定蛋白浓度。加等量2×SDS上样缓冲液,95 ℃变性5 min。每孔加40 μg胞浆蛋白,经12% SDS-聚丙烯酰胺(PAGE)分离,4 ℃下100 V恒压转膜。室温下,用5%脱脂奶粉封膜2 h,加入兔抗鼠抗体(1∶500)或内参GAPDH(1∶800)一抗,于4 ℃孵育过夜;洗膜后与辣根过氧化物酶标记的羊抗兔IgG(1∶5 000)室温孵育1 h;漂洗后ECL发光,常规显影。用Gelpro 4.0凝胶光密度分析软件进行分析,结果以目的条带灰度/内参条带灰度比值表示Bcl-2、Bax及Caspase-3的相对表达量。
1.6.3 自噬体和线粒体超微结构 顺肌纤维走向,取左心室前壁心肌,切成1 mm×1 mm×1 mm大小。再经2.5%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水。经包埋,半薄切片,光学固定,超薄切片、铜网承载,醋酸铀及枸橼酸铅双重染色,透射电镜观察。
1.7 统计学方法 采用SPSS 19.0软件进行统计学分析,计量资料以(x ±s)表示,多组间比较采用单因素方差分析,多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血清CAT及NO水平 各组ZDF大鼠血清CAT、NO水平比较,差异均有统计学意义(P<0.05);其中,缺血再灌注组血清CAT、NO水平低于空白组,缺血预处理组、埋线预处理组血清CAT、NO水平高于空白组、缺血再灌注组,差异均有统计学意义(P<0.05,见表1)。
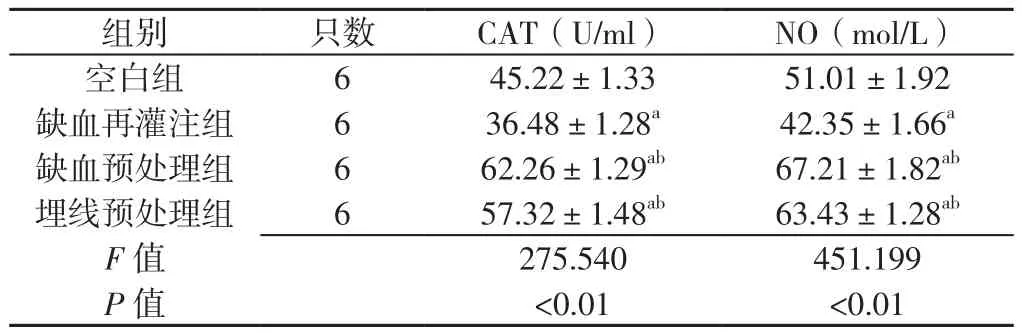
表1 各组ZDF大鼠血清CAT及NO水平比较(x±s)Table 1 Comparison of levels of CAT and NO among four groups of ZDF rats
2.2 心肌组织蛋白Bcl-2、Bax及Caspase-3相对表达量 各组ZDF大鼠心肌组织蛋白Bcl-2、Bax及Caspase-3相对表达量比较,差异均有统计学意义(P<0.05);其中,缺血再灌注组、缺血预处理组、埋线预处理组Bcl-2、Bax及Caspase-3相对表达量均高于空白组,缺血预处理组、埋线预处理组Bcl-2、Caspase-3相对表达量高于缺血再灌注组,Bax相对表达量低于缺血再灌注组,差异均有统计学意义(P<0.05,见表2)。
2.3 自噬体和线粒体超微结构 电镜下,空白组中未见自噬体,线粒体和心肌细胞形态、结构均未见异常;缺血再灌注组可见少量的自噬泡,线粒体肿胀明显,嵴突紊乱、断裂或消失,心肌细胞明显水肿,肌丝断裂溶解,肌小节明暗带模糊不清,细胞器减少、结构破坏,胞浆内形成许多大小不等的空腔及空泡,细胞膜破裂,且细胞内容物泄漏;与缺血再灌注组相比,缺血预处理组及埋线预处理组自噬泡数量明显增多,心肌细胞超微结构损伤较轻(见图1)。
3 讨论
在细胞发育、蛋白合成及分化过程中,凋亡与自噬均发挥十分重要的作用[10]。细胞凋亡促使细胞发生程序性死亡,过度的细胞凋亡影响组织的正常功能恢复;而自噬常有利于细胞的存活,过度的自噬却会造成细胞死亡[11]。研究认为,凋亡和自噬存在关系密切的交互效应,或表现为凋亡和自噬共同促使细胞死亡,或表现为自噬通过抑制凋亡而使细胞继续存活[12-13]。
表2 各组ZDF大鼠心肌组织蛋白Bcl-2、Bax及Caspase-3相对表达量比较(±s)Table 2 Comparison of the relative expression levels of Bcl-2,Bax and Caspase-3 in myocardial tissue among four groups of ZDF rats
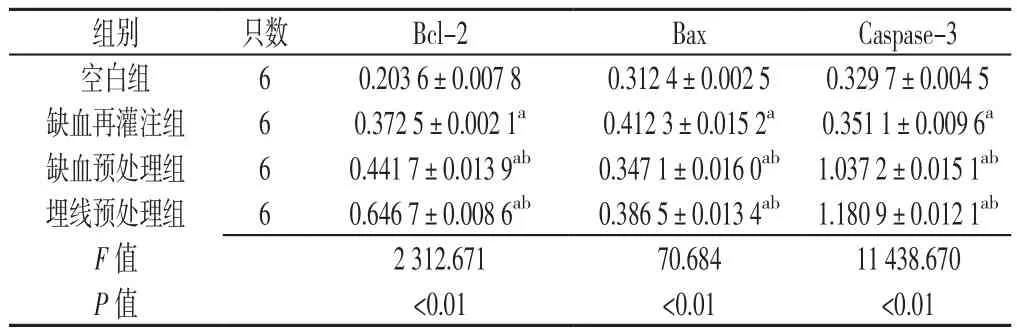
表2 各组ZDF大鼠心肌组织蛋白Bcl-2、Bax及Caspase-3相对表达量比较(±s)Table 2 Comparison of the relative expression levels of Bcl-2,Bax and Caspase-3 in myocardial tissue among four groups of ZDF rats
注:与空白组比较,aP<0.05;与缺血再灌注组比较,bP<0.05
组别 只数 Bcl-2 Bax Caspase-3空白组 6 0.203 6±0.007 8 0.312 4±0.002 5 0.329 7±0.004 5缺血再灌注组 6 0.372 5±0.002 1a 0.412 3±0.015 2a 0.351 1±0.009 6a缺血预处理组 6 0.441 7±0.013 9ab 0.347 1±0.016 0ab 1.037 2±0.015 1ab埋线预处理组 6 0.646 7±0.008 6ab 0.386 5±0.013 4ab 1.180 9±0.012 1ab F值 2 312.671 70.684 11 438.670 P 值 <0.01 <0.01 <0.01

图1 各组心肌组织电镜观察结果(醋酸铀及枸橼酸铅双重染色,×8 200)Figure 1 Electron microscopic results of the myocardial tissue of the four groups
心肌IRI的机制仍有待进一步研究。大量实验指出,氧自由基、钙超载、细胞凋亡等均可能直接参与再灌注损伤[14-16]。经典的IP对IRI心肌具有保护作用已得到证实,其中预处理对心肌细胞凋亡与自噬的调控也经过了验证。但IP方法不易操作,有学者通过实验,在心肌再灌注开始时应用其他手段或药物来模拟预处理机制,取得了相似的保护心肌作用[17-18]。
Bcl-2、Bax及Caspase-3作为凋亡与自噬在信号调控中具有共同的调控元件,之间既相互独立又紧密联系。Bcl-2与Bax是最具有代表性的凋亡蛋白,细胞凋亡通过心肌IRI被激活,Bcl-2可与Bax形成复合物,从而抑制凋亡,是抗凋亡蛋白[19]。而当Bax增加时,Bcl-2与Bax形成的复合物减少,Bcl-2抑制凋亡作用减弱,Bax在诱导凋亡信号刺激下,聚集到线粒体膜上诱导凋亡,属于促凋亡蛋白[20]。Caspase-3与Bax相似,是Caspase家族中重要的凋亡执行分子,具有促凋亡作用[21]。本实验结果显示,心肌缺血再灌注期间,缺血预处理组及埋线预处理组Bcl-2、Caspase-3相对表达量高于缺血再灌注组,Bax相对表达量低于缺血再灌注组,提示缺血预处理组和埋线预处理组可能通过调控自噬对细胞凋亡发挥抑制作用;埋线预处理可减轻由缺血再灌注对ZDF大鼠心肌造成的损伤,从而起到保护心肌的作用。
通过电镜观察自噬泡,仍是当前判定自噬的黄金标准[22-24]。本研究选择与临床更为接近的,患有2型糖尿病及高脂血症的ZDF大鼠,复制心肌IRI模型。电镜下发现,与空白组比较,其他各组ZDF大鼠心肌组织均有不同程度梗死及梗死后缺血坏死,提示IRI模型制备成功;与缺血再灌注组相比,缺血预处理组及埋线预处理组自噬泡数量增多,心肌细胞超微结构损伤减轻;埋线预处理组与缺血预处理组IRI明显减轻,且两组具有相似的心肌保护作用。
本研究根据临床经验及经典操作,采用的穴位配伍具有一定的实用性和可操作性。内关、膻中、心俞穴是治疗心胸疾患的常用腧穴,临床常穴对组合运用。内关穴是心包经之络穴,又是八脉交会穴之一,与相表里的心经相通,并通阴维脉。膻中穴为心包之募穴,心包为心之外围,替心行令,代心受邪。同时,气会膻中,膻中穴又是八会穴之一。心俞穴为心经背俞穴,采用经典的前后配穴法之俞募配穴,可调畅气机、宽胸理气。作为经典外治法的穴位埋线,方法简单方便,弥补了针刺、艾灸治疗结束后疗效衰减的不足,其发挥作用持久且稳定,在治疗慢性疾病方面更具优势。
值得指出的是,本研究显示,埋线预处理与针灸预处理效果近似,均可提高ZDF大鼠血清CAT、NO水平,对缺血心肌具有保护作用,与既往研究结果一致[25]。埋线预处理对自噬的激活,主要通过促进Bcl-2和抑制Bax,而对于Caspase-3,除可激活自噬外,还可激活其他的细胞内反应,如蛋白的合成以及细胞代谢等。因而,埋线预处理对心肌的保护作用还可能是通过除自噬外的其他途径。对于埋线预处理治疗心肌缺血的作用机制,有待于进一步深入研究,为临床应用提供依据和佐证。
本文无利益冲突。
[1]HAUSENLOY D J,YELLON D M.Myocardial ischemia-reperfusion injury:a neglected therapeutic target[J].J Clin Invest,2013,123(1):92-100.DOI:10.1172/JCI62874.
[2]刘丽凤,王禹.细胞程序性死亡与心肌再灌注损伤的研究进展[J].中华老年心脑血管病杂志,2015,17(5):549-550.DOI:10.3969/j.issn.1009-0126.2015.05.032.LIU L F,WANG Y.Progress of the study of programmed cell death and myocardial reperfusion injury[J].Chinese Journal of Senile Cardio Cerebral Vascular Disease,2015,17(5):549-550.DOI:10.3969/j.issn.1009-0126.2015.05.032.
[3]FUDICKAR A,KUNATH S,VOSS D,et al.Effect of ischemic and pharmacological preconditioning of lower limb muscle tissue on tissue oxygenation measured by near- infrared spectroscopy-a pilot study[J].BMC Anesthesiology,2014,14(54):1471-2253.DOI:10.1186/1471-2253-14-54.
[4]潘伟,贾俊海.缺血预处理对糖尿病大鼠心肌缺血再灌注损伤的影响[J].中国全科医学,2009,12(8):649-650,654.PAN W,JIA J H.Effect of ischemic preconditioning on myocardial ischemic/reperfusion injury in diabetic rats[J].Chinese General Practice,2009,12(8):649-650,654.
[5]YAN W J,DONG H L,XIONG L Z.The protective roles of autophagy in ischemic preconditioning[J].Acta Pharmacol Sin,2013,34(5):636-643.DOI:10.1038/aps.2013.18.
[6]沈菁,王超,张佳丽,等.电针内关穴对心肌缺血再灌注损伤家兔SOD与线粒体膜电位的影响[J].湖南中医药大学学 报,2015,35(7):47-49.DOI:10.3969/j.issn.1674-070X.2015.07.016.SHEN J,WANG C,ZHANG J L,et al.Effect of electroacupuncture at Neiguan point on SOD and mitochondrial membrane potential in rabbits with myocardial ischemiareperfusion injury[J].Journal of Hunan University of Chinese Medicine,2015,35(7):47-49.DOI:10.3969/j.issn.1674-070X.2015.07.016.
[7]GAO J,ZHAO Y,WANG Y,et al.Anti-arrhythmic effect of acupuncture pretreatment in the rats subjected to simulative global ischemia and reperfusion—involvement of intracellular Ca2+and connexin 43[J].BMC Complementary Altern Med,2015,15:5.DOI:10.1186/s12906-015-0521-y.
[8]HUANG Y,LU S F,HU C J,et al.Electro-acupuncture at Neiguan pretreatment alters genome-wide gene expressions and protects rat myocardium against ischemia-reperfusion[J].Molecules,2014,19(10):16158-16178.DOI:10.3390/molecules191016158.
[9]王一茗,孙忠人.艾灸预处理对心肌缺血高脂血症大鼠心肌RyR2 mRNA的影响[J].中华中医药杂志,2011,26(5):1164-1167.WANG Y M,SUN Z R.Effect of moxibustion preconditioning on RyR2 mRNA in myocardial ischemia and hyperlipidemia rats[J].Chinese Journal of Traditional Chinese Medicine and Pharmacy,2011,26(5):1164-1167.
[10]HARA T,NAKAMURA K,MATSUI M,et al.Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J].Nature,2006,441(7095):885-889.DOI:10.1038/nature04724.
[11]王玲,张盼盼,王红阳,等.线粒体自噬对间歇低氧早期大鼠认知功能影响的初探[J].中华结核和呼吸杂志,2014,37(11):840-844.DOI:10.3760/cma.j.issn.1001-0939.2014.11.011.WANG L,ZHANG P P,WANG H Y,et al.The effect of mitochondrial autophagy on cognitive function in rats at the early stage of intermittent hypoxia[J].Chinese Journal of Tuberculosis and Respiratory Medicine,2014,37(11):840-844.DOI:10.3760/cma.j.issn.1001-0939.2014.11.011.
[12]HANADA T,NODA N N,SATOMI Y,et al.The Atg12-Atg5 conjugate has a novel E3- like activity for protein lipidation in autophagy[J].J Biol Chem,2007,282(52):37298-37302.DOI:10.1074/jbc.C700195200.
[13]PANKIV S,CLAUSEN T H,LAMARK T,et al.p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].J Biol Chem,2007,282(33):24131-24145.DOI:10.1074/jbc.M702824200.
[14]CHEN K,LI G,GENG F,et al.Berberine reduces ischemia/reperfusion-induced myocardial apoptosis via activating AMPK and PI3K-Akt signaling in diabetic rats[J].Apoptosis,2014,19(6):946-957.DOI:10.1007/s10495-014-0977-0.
[15]MA H J,LI Q,GUAN Y,et al.Chronic intermittent hypobaric hypoxia ameliorates ischemia/reperfusion-induced calcium overload in heart via Na+/Ca2+exchanger in developing rats[J].Cell Physiol Biochem,2014,34(2):313-324.DOI:10.1159/000363001.
[16]CHOUCHANI E T,PELL V R,JAMES A M,et al.A unifying mechanism for mitochondrial superoxide production during ischemia-reperfusion injury[J].Cell Metab,2016,23(2):254-263.DOI:10.1016/j.cmet.2015.12.009.
[17]TIAN Y,LI H,LIU P,et al.Captopril pretreatment produces an additive cardioprotection to isoflurane preconditioning in attenuating myocardial ischemia reperfusion injury in rabbits and in humans[J].Mediators Inflamm,2015:819232.DOI:10.1155/2015/819232.
[18]YANG F,YIN C,XI L,et al.Hydroxychloroquine pretreatment reduces myocardial ischemia-reperfusion injury:role of cardiac extracellular-signal-regulated kinase 5 and autophagy[J].Circulation,2015,132(Suppl 3):A10246.
[19]JAIN M V,PACZULLA A M,KLONISCH T,et al.Interconnections between apoptotic,autophagic and necrotic pathways:implications for cancer therapy development[J].J Cell Mol Med,2013,17(1):12-29.DOI:10.1111/jcmm.12001.
[20]LALIER L,CARTRON P F.Bax activation and mitochondrial insertion during apoptosis[J].Apoptosis,2007,12(5):887-896.DOI:10.1007/s10495-007-0749-1.
[21]SOHN E J,LI H,REIDY K,et al.EWS/FLI1 oncogene activates caspase 3 transcription and triggers apoptosis in vivo[J].Cancer Res,2010,70(3):1154-1163.DOI:10.1158/0008-5472.
[22]RABINOWITZ J D,WHITE E.Autophagy and metabolism[J].Science,2010,330(6009):1344-1348.DOI:10.1126/science.1193497.
[23]NICKLIN P,BERGMAN P,ZHANG B,et al.Bidirectional transport of amino acids regulates mTOR and autophagy[J].Cell,2009,136(3):521-534.DOI:10.1016/j.cell.2008.11.044.
[24]WU Y T,TAN H L,HUANG Q,et al.Activation of the PI3KAkt-mTOR signaling pathway promotes necrotic cell death via suppression of autophagy[J].Autophagy,2009,5(6):824-834.DOI:10.4161/auto.9099.
[25]唐关敏,翟昌林,宋国杰,等.针灸预处理对大鼠心肌梗死心肌S100A1蛋白表达的影响[J].中华中医药学刊,2015(1):107-109.DOI:10.13193/j.issn.1673-7717.2015.01.033.TANG G M,ZHAI C L,SONG G J,et al.Effects of acupuncture pretreatment on the expression of myocardial S100A1 protein in myocardial infarction rats[J].Chinese Archives of Traditional Chinese Medicine,2015(1):107-109.DOI:10.13193/j.issn.1673-7717.2015.01.033.
