外泌体对过表达GATA-4小鼠骨髓间充质干细胞向心肌细胞分化能力促进作用的研究
2018-06-08贺继刚韩金秀李贝贝李宏远严丹任靖宇
贺继刚,韩金秀,李贝贝,李宏远,严丹,任靖宇*
本研究背景:
冠心病位居世界人口死亡原因首位。目前国内外对冠心病的治疗主要分为:外科治疗、内科治疗及细胞治疗。细胞治疗中应用最为成熟的是骨髓间充质干细胞(BMSCs),虽然已有大量文献证实BMSCs可以改善心肌梗死后心功能。但干细胞临床应用尚不成熟,而GATA-4是调控心脏基因表达的重要转录因子。目前已经证明过表达GATA-4的BMSCs可以通过促进BMSCs向心肌细胞分化,从而有效改善心肌梗死后心功能。然而转染基因干细胞的致瘤性使干细胞的临床应用前景遥遥无期。有什么可以让细胞修复的优势凸显,而同时又可以规避其风险呢?本研究将目光聚焦于细胞分泌的外泌体。外泌体是从细胞上产生的鳞片状脱落的囊泡,具有多种生物学功能,可以使细胞在不需要直接接触下完成细胞间生物信号的传导,其在细胞保护、免疫、疾病诊断等方面成为目前研究的热点。基于此,本研究采用过表达GATA-4的小鼠BMSCs分泌的外泌体,证明其可以充分有效促进BMSCs向心肌细胞分化。
冠心病引起的心肌梗死(即心肌损伤)已成为目前世界范围内的头号“杀手”。据世界卫生组织(WHO)统计:2000—2012年冠心病位居世界人口死亡原因首位[1-2]。目前干细胞治疗成为研究热点,尤其是骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),虽然已有大量文献证实BMSCs可以改善心肌梗死后心功能[3]。但亦有更多的学者提出,干细胞应用临床尚不成熟,主要原因在于BMSCs安全性一直受到广泛怀疑[4]。本课题组前期研究已经证明过表达GATA-4可以有效促进BMSCs向心肌细胞分化[5]。在此研究基础上,本课题组将目光进一步聚焦于细胞分泌的外泌体。外泌体具有多种生物学功能,可以使细胞在不需要直接接触下完成细胞间生物信号转导。本研究利用慢病毒携带GATA-4转染小鼠BMSCs并提取分泌的外泌体,通过与BMSCs共培养后采用免疫荧光、反转录聚合酶链式反应(qPCR)证明过表达GATA-4的小鼠BMSCs分泌的外泌体可以有效促进BMSCs向心肌细胞分化。
1 材料与方法
1.1 实验动物 2016年1—6月选取健康4周龄SPF级C57BL/6小鼠10只,均为雄性,体质量20~25 g,由成都达硕实验动物有限公司提供,动物许可证号为SCXK(川)2015-030。
1.2 主要试剂和仪器 C57BL/6小鼠BMSCs完全培养基(低糖培养基,含10%胎牛血清)购自美国Cyagen Biosciences公司,肌钙蛋白T(cTnT)、α肌动蛋白(α-actin)、肌间线蛋白(Desmin)购自英国Abcam公司,Connexin 43购自美国Proteintech Group公司,CD29、CD44、CD11b、干细胞抗原 1(Sca-1)抗体购自美国BioLegend公司,ExoQuick-TC购自美国System Biosciences公司,CD11bMicroBeads购于美国Miltenyi公司,荧光共聚焦显微镜购自日本Nikon90i。
1.3 小鼠BMSCs的分离、培养及鉴定 取C57BL/6小鼠,脱颈处死,75%乙醇溶液浸泡15 min,取出股骨和胫骨,再以75%乙醇溶液浸泡1~2 min,置于0.9%氯化钠溶液中,两端剪断暴露骨髓腔。用1 ml注射器将0.9%氯化钠溶液冲出骨髓,收集致无菌离心管中,以1 500×g离心10 min后,以含10%胎牛血清的C57BL/6小鼠BMSCs完全培养基重悬细胞制备细胞悬液,以2×106/cm2密度接种至25 cm2塑料培养瓶,置于37 ℃、5% CO2培养箱中培养。并标记为原代(passage 0,P0)。胰酶消化传代至第3代时采用CD11b的磁珠负选,去除造血干祖细胞。继续传代至第7代。取生长至第7代的BMSCs,待细胞融合达80%~90%时,制备单细胞悬液,采用流式细胞检测CD29、CD44、CD11b、SCA-1〔PE-CD29单抗 5 μl按 1∶20 稀释至 100 μl、PE-CD11b单 抗 5 μl按 1∶40 稀 释 至 100 μl、PE/Cy5-CD445 μl按1∶20稀释至100 μl、异硫氰酸荧光素(FITC) antimouse SCA-1 5 μl按 1∶20 稀释至 100 μl〕。
1.4 慢病毒载体及基因开启技术构建过表达GATA-4-BMSCs 将已构建成功的GATA-4基因插入慢病毒包装质粒GV308中,构建GV308-GATA-4重组慢病毒包装质粒。将构建成功的GV308-GATA-4重组慢病毒包装质粒转染入小鼠BMSCs并加入基因开启剂多西环素(DOX)。转染成功后利用qPCR方法检测转染72 h过表达GATA-4组及阴性对照组GATA-4 mRNA表达水平,具体过程参考文献[5]。
1.5 外泌体提取及检测 按照ExoQuick-TC说明书提取外泌体:收集培养基,3 000×g离心15 min,以去除细胞及细胞碎片;并将上清液转移至无菌管中,加入适当体积的ExoQuick-TC 外泌体沉淀液(见说明书)。反复颠倒或轻弹试管使其混匀。冷藏(4 ℃)过夜。保温培养过程中无需旋转试管。 以1 500×g离心30 min ExoQuick-TC体液混合液。外泌体沉淀位于试管底部,呈浅褐色或白色。吸出上清液,1 500×g离心5 min以沉降残余的ExoQuick-TC溶液。小心地吸干所有液体,不破坏已沉淀的外泌体。并利用电镜检测提取外泌体形态。
1.6 免疫荧光定性检测各组cTnT、α-actin、Connexin 43、Desmin表 达 将GATA-4-BMSCs-外 泌 体 与BMSCs共同培养(A组),空载体-BMSCs-外泌体与BMSCs共同培养(B组),BMSCs-外泌体与BMSCs共同培养(C组),BMSCs单独培养(D组)及小鼠心肌细胞单独培养(E组)72 h,将共同培养及单独培养完成的细胞,加合适浓度的一抗(cTnT 20 μg/ml,α-actin 50 μg/ml,Connexin 43 30 μg/ml,Desmin 0.6 μg/ml)。再加入合适浓度的荧光标记二抗(0.5 mg/ml,稀释比例1∶1 000),采用荧光共聚焦显微镜检测细胞cTnT、α-actin、Connexin 43、Desmin表达情况。
1.7 qPCR法定量检测各组cTnT、α-actin、Connexin 43、Desmin表 达 将GATA-4-BMSCs-外 泌 体 与BMSCs共同培养(A组),空载体-BMSCs-外泌体与BMSCs共同培养(B组),BMSCs-外泌体与BMSCs共同培养(C组),BMSCs单独培养(D组)及小鼠心肌细胞单独培养(E组)72 h,应用beacon designer 7.90设 计qPCR引 物,cTnT上 游 引 物:5′-AATGAAGACCAACTGAGA-3′,下游引物:5′-TATTTCTGCTGCTTGAAC-3′;α-actin上游引物:5′-GAGTAATGGTTGGAATGG-3′,下游引物:5′-GTTCTATCGGATACTTCAG-3′;Connexin 43上游引物:5′-TCAAGAAGTTCAAGTATGG-3′,下游引物:5′-ATGCTGATGATGTAGGTT-3′;Desmin上游引物:5′-CGTGACAACCTGATAGAC-3′,下游引物:5′-TTCTCTGCTTCTTCTCTTAG-3′。PCR反应条件:95 ℃预变性 10 min;95 ℃变性 15 s,60 ℃退火 30 s,95 ℃延伸15 s,共40~45个循环。完成总RNA提取,反转录为cDNA,完成目的基因扩增。收集信息,做Ct值分析(计算与统计分析软件 LERTPA-V 1.0)。实验重复3次。
1.8 统计学方法 采用SPSS 15.0软件进行统计学分析。计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠BMSCs流式细胞仪鉴定结果 小鼠BMSCs CD29表达率为98.0%、CD44表达率为100.0%、CD11b表达率为0.1%、Sca-1表达率为99.5%。
2.2 转染72 h后GATA-4 mRNA表达水平 转染72 h后,过表达GATA-4组GATA-4 mRNA表达水平为(78.17±1.32),阴性对照组GATA-4 mRNA表达水平为(0.57±0.34),过表达GATA-4组GATA-4 mRNA表达水平较阴性对照组明显升高,差异有统计学意义(t=2.576,P<0.05)。
2.3 外泌体 外泌体电镜图片显示,大小介于40~100 nm颗粒成团聚集,为BMSCs分泌出的外泌体(见图1,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。

图1 ExoQuick-TC法提取外泌体电镜图片(×5 000)Figure 1 Exosomes extracted by ExoQuick-TC
2.4 免疫荧光定性检测各组cTnT、α-actin、Connexin 43、Desmin表 达 A组 GATA-4-BMSCs-外 泌 体 与BMSCs共同培养72 h可见细胞核被DAPI染为蓝色,表达出绿色的cTnT、α-actin、Connexin 43、Desmin;B、C、D组可见细胞核被DAPI染为蓝色,没有表达出绿色的cTnT、α-actin、Connexin 43、Desmin;E组可见细胞核被DAPI染为蓝色,表达出绿色的cTnT、α-actin、Connexin 43、Desmin(见图2)。
2.5 qPCR法定量检测各组cTnT、α-actin、Connexin 43、Desmin表达 5组cTnT、α-actin、Connexin 43、Desmin表达水平比较,差异均有统计学意义(P<0.05);其中E组cTnT、α-actin、Connexin 43、Desmin表达水平较A组升高,差异均有统计学意义(P<0.05);A组和E组cTnT、α-actin、Connexin 43、Desmin表达水平较B组、C组和D组升高,差异均有统计学意义(P<0.05,见表1)。
3 讨论
2003年美国食品药品监督管理局(FDA)率先批准BMSCs用于心肌梗死的治疗。多年来,科学界一直研究采用无细胞方法治疗心肌梗死。前期为了使BMSCs更好地向心肌细胞分化,本课题组采用慢病毒转染BMSCs使其可以过表达 GATA-4[5]。
GATA-4在心脏发育的早期起重要作用,抑制其表达,可以阻断P19畸胎瘤细胞向心肌细胞分化,强表达则增强心肌细胞分化[6]。

图2 免疫荧光定性检测各组cTnT、α-actin、Connexin 43、Desmin表达(×400)Figure 2 Expressions of cTnT,α-actin,Connexin 43 and Desmin in groups A,B,C,D and E stained by immunofluorescence
表 1 各组 cTnT、α-actin、Connexin 43、Desmin表达水平比较(s,n=3)Table 1 Comparison of expressions of cTnT,α-actin,Connexin 43 and Desmin in groups A,B,C,D and E
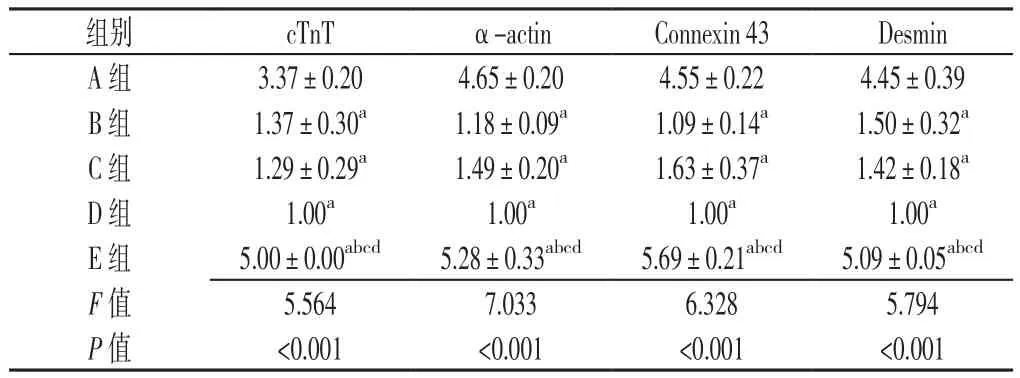
表 1 各组 cTnT、α-actin、Connexin 43、Desmin表达水平比较(s,n=3)Table 1 Comparison of expressions of cTnT,α-actin,Connexin 43 and Desmin in groups A,B,C,D and E
注:cTnT=肌钙蛋白T,α-actin=α肌动蛋白,Desmin=肌间线蛋白;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;与D组比较,dP<0.05
组别 cTnT α-actin Connexin 43 Desmin A 组 3.37±0.20 4.65±0.20 4.55±0.22 4.45±0.39 B 组 1.37±0.30a 1.18±0.09a 1.09±0.14a 1.50±0.32a C 组 1.29±0.29a 1.49±0.20a 1.63±0.37a 1.42±0.18a D组 1.00a 1.00a 1.00a 1.00a E 组 5.00±0.00abcd 5.28±0.33abcd 5.69±0.21abcd 5.09±0.05abcd F值 5.564 7.033 6.328 5.794 P 值 <0.001 <0.001 <0.001 <0.001
外泌体是小的膜性囊泡,从20世纪90年代起受到极大关注[7-8]。外泌体于1981年首先提出,是从细胞上产生的鳞片状脱落的囊泡,具有胞外酶的活性[9]。外泌体可能扮演细胞与细胞之间的信号作用,可以远距离运输并将所携带物质释放入细胞影响受体细胞的处理过程。例如,RNA从一个细胞穿梭到另一个细胞,被称为“外泌体载体RNA”,能够影响受体细胞的蛋白质产生[10-11]。外泌体不但有免疫调节作用,还有减轻心肌缺血/再灌注损伤的效果。TIMMERS等[12]报道,为了更好地理解外泌体的心肌保护作用,将间充质干细胞(mesenchymal stem cells,MSCs)培养基采用滤膜将其内部成分系统性的分为各个等级大小,表明具有心肌保护成分为>1 000 kPa。即心肌保护是由直径为50~100 nm的囊泡所介导的[12]。MSCs营养改善心肌缺血已有大量研究,据TANG等[13]报道MSCs进入缺血心脏,可以减少组织反应,增加血管生成及减少细胞的凋亡,相比用MSCs转化,其旁分泌可以更好地解释这些效果。迄今为止,总是将MSCs的旁分泌局限于细胞因子、化学因子及介导于细胞间信号的生长因子。而外泌体的出现从根本上改变了当前对MSCs旁分泌的理解。
本实验正是在上述研究基础上采用GATA-4-BMSCs-外泌体与BMSCs共同培养,空载体-BMSCs-外泌体与BMSCs共同培养,BMSCs-外泌体与BMSCs共同培养,BMSCs单独培养及小鼠心肌细胞单独培养72 h后,采用免疫荧光检测心肌特异性抗原cTnT、α-actin、Connexin 43、Desmin表达。并进一步利用qPCR的方法,定量检测上述心肌特异性抗原的表达。发现GATA-4-BMSCs-外泌体与BMSCs共同培养cTnT、α-actin、Connexin 43、Desmin表达水平低于小鼠心肌细胞单独培养,但较其他增多。证实过表达GATA-4-BMSCs分泌的外泌体可以有效促进BMSCs向心肌细胞分化。
综上所述,过表达GATA-4的BMSCs分泌的外泌体可以更为有效地促进BMSCs向心肌细胞分化。
本文无利益冲突。
[1]SHAH N,SOON K,WONG C,et al.Screening for asymptomatic coronary heart disease in the young 'at risk' population:who and how?[J].IJC Heart & Vasculature,2015,6(1):60-65.
[2]TOKCAER-KESKIN Z,AKAR A R,AYALOGLU-BUTUN F,et al.Timing of induction of cardiomyocyte differentiation for in vitro cultured mesenchymal stem cells:a perspective for emergencies[J].Can J Physiol Pharmacol,2011,87:143-150.DOI:10.1139/Y08-111.
[3]HE J,TENG X,YU Y,et al.Injection of Sca-1+/CD45+/CD31+mouse bone mesenchymal stromal-like cells improves cardiac function in a mouse myocardial infarct model[J].Differentiation,2013,86(1/2):57-64.DOI:10.1016/j.diff.2013.07.002.
[4]BROWN C O 3rd,CHI X,GARCIA-GRAS E,et al.The cardiac determination factor,Nkx2-5,is activated by mutual cofactors GATA-4 and Smad1/4 via a novel upstream enhancer[J].J Biol Chem,2012,279(11):10659-10669.DOI:10.1074/jbc.M301648200.
[5]贺继刚,李洪荣,桂龙升,等.慢病毒载体及基因开启技术构建过表达GATA-4骨髓间充质干细胞[J].临床心血管病杂志,2016,32(4):384-387.HE J G,LI H R,GUI L S,et al.Lentiviral vectors and gene open constructed overexpression GATA-4 in bone marrow mesenchymal stem cells[J].Journal of Clinical Cardiology,2016,32(4):384-387.
[6]HARVEY R P,LAI D,ELLIOTT D,et al.Homeodomain factor Nkx2-5 in heart development and disease[J].Cold Spring Harb Symp Quant Biol,2012,67:107-114.
[7]LÄSSER C,ELDH M,LÖTVALL J.Isolation and characterization of RNA-containing exosomes[J].J Vis Exp,2012,9(59):e3037.DOI:10.3791/3037.
[8]MASLANIK T,TANNURA K,MAHAFFEY L,et al.Commensal bacteria and MAMPs are necessary for stress-induced increases in IL-1β and IL-18 but Not IL-6,IL-10 or MCP-1[J].PLoS One,2012,7(12):e50636.DOI:10.1371/journal.pone.0050636.
[9]BENINSON L A,BROWN P N,LOUGHRIDGE A B,et al.Acute stressor exposure modifies plasma exosome-associated heat shock protein 72(HSP72) and microRNA(miR-142-5p and miR-203)[J].PLoS One,2014,9(9):e108748.DOI:10.1371/journal.pone.0108748.
[10]WANG K,ZHANG S,WEBER J,et al.Export of microRNAs and microRNA-protective protein by mammalian cells[J].Nucleic Acids Res,2010,38(20):7248-7259.DOI:10.1093/nar/gkq601.
[11]BENINSON L A,FLESHNER M.Exosomes:an emerging factor in stress-induced immunomodulation[J].Semin Immunol,2014,26(5):394-401.DOI:10.1016/j.smim.2013.12.001.
[12]TIMMERS L,LIM S K,ARSLAN F,et al.Reduction of myocardial infarct size by human mesenchymal stem cell conditioned medium[J].Stem Cell Res,2007,1(2):129-137.DOI:10.1016/j.scr.2008.02.002.
[13]TANG Y L,ZHAO Q,QIN X,et al.Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].Ann Thorac Surg,2005,80(1):229-236 ;discussion 236-237.DOI:10.1016/j.athoracsur.2005.02.072.
