川芎嗪对体外培养的胎鼠神经干细胞增殖和分化的影响*
2018-06-08陈士金史钰芳
陈士金,陈 冬,史钰芳,刘 军,韩 嵩,李 伟
(1.湖北宜昌市第二人民医院心血管内科,宜昌443000;2.武警辽宁省总队训练基地卫生队,沈阳110034)
神经干细胞(neural stem cells,NSCs)是一类具有自我更新和多向分化潜能的细胞,可以分化为神经元、星形胶质细胞以及少突胶质细胞等神经细胞[1]。脑卒中后,局灶缺血可在一定程度上激活神经发生,但激活的NSCs的数量以及向神经元分化率较低,远远达不到神经修复的目的。因此,通过药物增强神经发生成为治疗脑卒中的途径之一。
近年研究显示,许多中药单体能增加神经干细胞数量并诱导其向神经细胞定向分化[2]。中药提取物川芎嗪(tetramethylpyrazine,TMP)为活血化瘀药,药理作用广泛,其神经保护作用备受关注[3],临床上广泛用于心脑血管疾病,尤其是脑卒中的防治。有研究显示,TMP可以显著增加脑卒中患侧大脑神经元阳性细胞数,具有显著的神经保护作用[4]。TMP的神经保护作用是否与内源性神经发生有关,以及TMP促神经分化的分子机制尚不清楚。研究TMP与神经发生的关系及其影响NSCs分化的分子机制,可为筛选有效中药单体干细胞诱导剂及临床神经损伤治疗提供理论依据。本文观察TMP对NSCs增殖与分化的影响,初步探讨TMP使NSCs定向分化的机制,以期为NSCs临床治疗提供理论依据。
1 材料与方法
1.1 实验动物
采用孕14 d SD雌性大鼠,购自北京军事医学科学院动物实验中心,许可证号:SCXK-(军)2012-0004。
1.2 主要试剂与仪器
DMEM/F12(1∶1)培养基(Gibco公司);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、B27添加剂以及表皮生长因子(epidermal growth factor,EGF)均购自 Invitrogen公司;神经元特异性烯醇化酶(neuron-specific enolase,NSE)、抗巢蛋白(nestin)抗体和抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体均购自Abcam公司;荧光标记二抗(Invitrogen公司);内参抗体β-actin、辣根过氧化物酶标记的二抗、β-巯基乙醇、胰蛋白酶以及二甲亚砜均购自碧云天生物技术公司;PVDF膜(Millpore公司);TMP购自哈尔滨三联药业有限公司。
1.3 大鼠NSCs体外分离培养
孕14 d的SD雌性大鼠,乙醚吸入麻醉后,浸入75%酒精消毒,打开腹腔取出胎鼠。用弯镊拉开胎鼠脑区视野,小心暴露并取出大脑皮层,PBS缓冲液洗2次,剔除脑表面的软膜及血管,置于装有DMEM/F12(1∶1)基础培养液的无菌培养皿中,所有操作均在冰上进行。用眼科剪将大脑皮层剪碎,反复吹打过200目筛网,制备单细胞悬液,离心后加入胰蛋白酶液(终浓度0.25%)进行消化,吹打制备细胞悬液。接种密度为2×106cells/ml,加入完全培养基(DMEM/F12、20 ng/ml bFGF、20 ng/ml EGF、2%B27),置37℃、5%CO2、饱和湿度的细胞培养箱中培养,3~4 d后半量换液。NSCs培养12 h呈单个悬浮圆形细胞;培养3 d后可见部分悬浮生长的细胞球;培养7 d后细胞球逐渐增大,形成约上百个细胞组成的细胞球。
1.4 大鼠NSCs克隆球的免疫荧光鉴定
NSCs培养5~7 d,形成大量神经克隆球,选取第三代细胞,接种于多聚赖氨酸预处理的盖玻片上,置于37℃、5%CO2细胞培养箱中培养。次日,0.01 mol/L PBS缓冲液冲洗盖玻片3次,滴加4%甲醛固定30min。然后进行Nestin免疫荧光染色。详细步骤如下:0.01 mol/L PBS缓冲液洗片 3次,每次 5 min;滴加 0.5%Triton X-100破膜 15~20 min,0.01 mol/L PBS缓冲液洗片 3次,每次 5 min;滴加 5%BSA封闭 20 min,0.01 mol/L PBS缓冲液冲洗片 3次,每次5min;滴加抗 Nestin抗体(1:400),置4℃冰箱中孵育过夜;次日,0.01 mol/L PBS缓冲液洗片 3次,每次5min;滴加荧光标记的二抗,37℃温箱避光孵育 1.5 h,0.01mol/L PBS洗片 3次,每次 5min;4,6-联脒-2-苯基吲哚(DAPI)染色 10 min,0.01 mol/L PBS缓冲液洗片3次,每次5 min;抗荧光淬灭封片剂封片,倒置荧光显微镜观察并采集图像。
1.5 实验分组及处理
实验分为4组,对照组、β-巯基乙醇阳性对照组、TMP组和TMP+EGTA组。对照组给予等体积的TMP溶液溶剂,β-巯基乙醇组加入终浓度为1 mmol/Lβ-巯基乙醇的培养液;TMP组加入终浓度为2.4mg/ml的 TMP诱导液;TMP+EGTA组加入终浓度为5mmol/LEGTA(细胞外Ca2+螯合剂)的TMP诱导液。
1.6 BrdU法检测川芎嗪对NSCs增殖的影响
将NSCs以密度2×105cells/ml接种于多聚赖氨酸包被的6孔板中,待细胞贴壁后,各组给予不同处理,然后在细胞培养液中加入BrdU(终浓度10μmol/L),连续观察12 h。弃去全部培养液,4%多聚甲醛室温下固定30 min,行免疫荧光染色。在显微镜下(10×10),各组随机计数5个视野下的BrdU阳性细胞数,BrdU阳性细胞率=(5个视野)阳性细胞总数/(5个视野)活细胞总数×100%。
1.7 MTT法检测川芎嗪对NSCs增殖的影响
培养的NSCs经胰酶消化后,以2×105cells/ml密度接种于96孔板,每孔100μl培养48 h后,各组给予不同处理后再培养24 h。每孔加入0.5%MTT溶液100μl,37℃孵育4 h。每孔加入二甲亚砜,37℃温箱孵育12 h,用酶标仪检测560 nm波长处各孔吸光度值。
1.8 蛋白免疫印迹法检测川芎嗪对NSCs分化的影响
取第3代培养的NSCs,胰酶消化并制备单细胞悬液,以3×105cells/ml的密度接种于培养板上。细胞融合度达80%后,各组继续培养12 h。取对数生长期的NSCs,加入RIPA裂解液后超声裂解,离心收集上清。BCA法测定蛋白质浓度,在上清中加入Loading buffer后变性。于浓度12%的SDS-PAGE凝胶中电泳,每组上样量15μg。电泳后将蛋白转印于硝酸纤维素膜上,2%脱脂奶粉封闭60 min,加一抗(抗NSE抗体,1∶800稀释)于4℃孵育过夜。次日,加HRP标记的二抗室温摇床孵育2 h。滴加ECL发光液在凝胶成像系统中显影。以GAPDH作为内参。
1.9 统计学处理
计量资料数据以均值±标准差()表示,应用SPSS 16.0统计软件,组间比较采用单因素方差分析。
2 结果
2.1 NSCs的形态学观察
培养2 d后,可见部分悬浮生长的NSCs形成“神经克隆球”(图1A);3 d后克隆球增多增大,细胞形态规则,呈椭圆形,胞体透亮,折光性强(图1B,C)。

Fig.1 Neural stem cells isolated from cerebral cortex of rat embryos,cultured in DMEM/F12 containing 20 ng/mlbFGF,20 ng/ml EGF and 2%B27
2.2 NSCs的免疫荧光鉴定
原代培养的NSCs呈椭圆形,胞体透亮,周边结构致密,界线清晰。传代细胞克隆球,行神经干特异性抗原巢蛋白(Nestin)检测,结果显示培养的NSCs特异性标记物Nestin阳性(图2,见彩图页Ⅳ)。
2.3 川芎嗪对NSCs增殖的影响
取第3代NSCs,细胞培养液加入BrdU(终浓度10μmol/L),连续观察12 h,结果显示在浓度2.4mg/ml TMP诱导液的作用下,NSCs增殖的数量明显增加(表1)。同样取第3代培养的NSCs,MTT法检测TMP对NSCs增殖的影响,结果显示在浓度2.4 mg/ml TMP诱导液的作用下,NSCs增殖的数量明显增加(表1)。与对照组和β-巯基乙醇组相比差异具有统计学意义。
2.4 川芎嗪对NSCs的分化的影响
2.4.1 川芎嗪对NSCs向神经元分化的影响 取第3代NSCs作蛋白免疫印迹检测。结果显示,在2.4 mg/ml TMP诱导液作用下,有一小部分NSCs分化为神经元(0.4707±0.2100),与对照组(0.0565±0.0205)相比,在含 5 mmol/L EGTA(细胞外 Ca2+螯合剂)的TMP诱导液培养12 h后,神经元分化率明显提高(0.8608±0.7085,图 3)。
Tab.1 Effect of tetramethylpyrazine on NSCs proliferation(,n=3)

Tab.1 Effect of tetramethylpyrazine on NSCs proliferation(,n=3)
BME:β-mercaptoethanol;TMP:Tetramethylphrazine;EGTA:Ethylene glycol tetraacetic acid**P<0.01 vs control group;##P<0.01 vs BME group
Group BrdU MTT Control group 0.81±0.09 0.80±0.15 BME group 1.31±0.96## 1.18±0.87##TMP group 1.93±0.23** 1.62±0.14**TMP+EGTA group 1.97±0.53 1.69±0.12
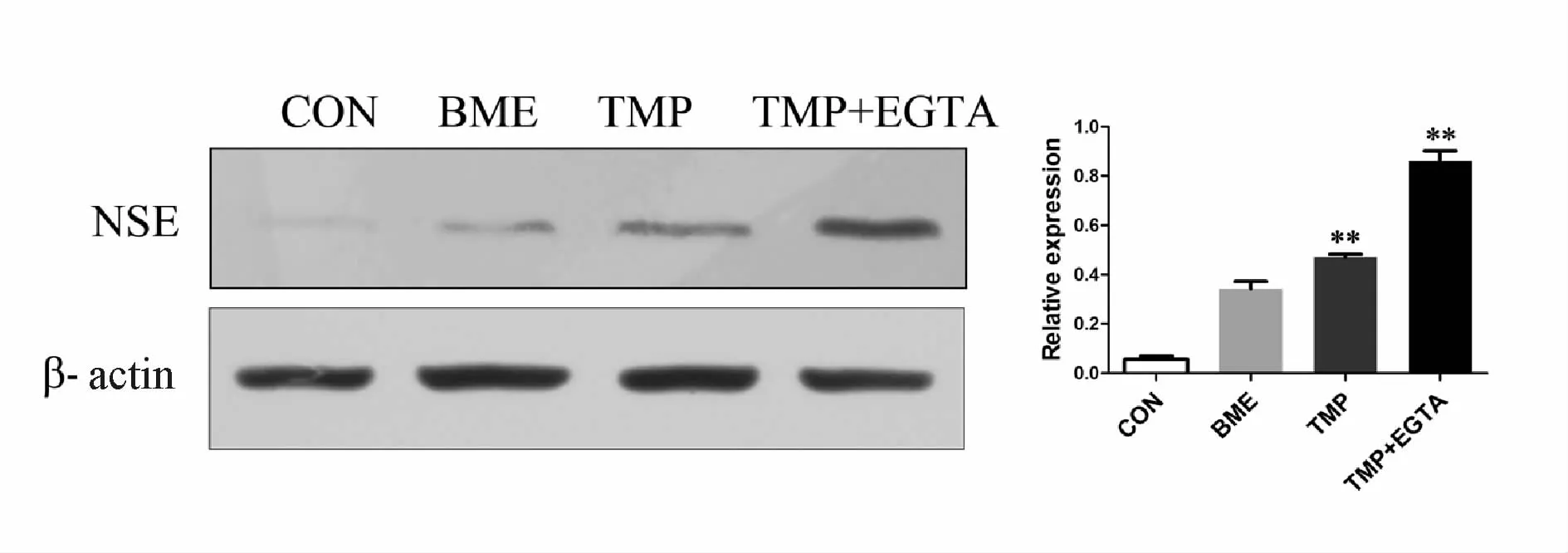
Fig.3 The result ofWestern blot showed that compared with the other three groups,neuronal differentiation rate of tetramethylpyrazine+EGTA group was the highest
2.4.2 川芎嗪对NSCs向星型胶质细胞分化的影响
取第3代NSCs作蛋白免疫印迹检测。结果显示,与对照组(0.8459±0.0858)相比,在 2.4 mg/ml TMP诱导液作用下,仅部分NSCs分化为星型胶质细胞(0.4647±0.0637),而用含 5 mmol/L EGTA的 TMP诱导液培养12 h后,向星形胶质细胞分化比率明显降低(0.1368±0.0264,图 4)。
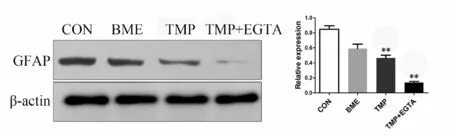
Fig.4 The result ofWestern blot showed that compared with the other three groups,astrocytes differentiation rate of TMP+EGTA group was the lowest
3 讨论
中枢神经系统损伤后的修复与再生一直是神经科学领域研究的热点。近年来,采用干细胞疗法进行神经损伤修复越来越受到重视。NSCs具有向神经细胞分化的潜能,是干细胞疗法重要的种子细胞[5]。有研究显示,成年哺乳类动物中枢神经系统内存在神经发生。目前认为,侧脑室室下区(subventricular zone,SVZ)和海马齿状回颗粒下层(subgranular zone,SGZ)是脑内主要的 NSCs池[6],啮齿类动物局灶性脑缺血的大脑SVZ、SGZ区和梗塞周围区出现新生的神经细胞。Tanaka[7]等向脑缺血沙鼠模型的海马齿状回内注射增强型绿色荧光蛋白,以标记处于分裂期的神经细胞,结果发现脑缺血早期新生神经细胞主要存在于颗粒细胞层下区,脑缺血30 d时新生细胞大多数最终迁移至颗粒细胞层,分化为成熟神经元。这表明,机体自身具有通过激活神经发生进行神经修复的功能。但这种修复能力是有限的,还不足以有效恢复神经功能。因此,最大限度促进脑缺血后内源性NSCs的增殖和分化,以替代丢失和损伤的神经元,对促进脑缺血损伤神经功能的恢复具有重要作用。
体外诱导NSCs增殖并向神经细胞分化的最终目的在于应用,以前研究工作主要以化学制剂如β-巯基乙醇等作为诱导剂,诱导生成的神经元样细胞体外存活时间短且不能用于人体。中药因其来源广、副作用小等优点,对NSCs生长及分化无毒。因此,利用中药有效成分作为干细胞分化的诱导因子具有独特的优势和应用潜力。有报道,采用中药或其有效成分联合干细胞移植,如补阳还五汤和人参皂苷Rg1联合骨髓间充质干细胞移植,治疗脑缺血有显著效果[8]。还有文献报道,黄芩苷能促进间充质干细胞向神经细胞分化。因此,以中药有效成分作为干细胞定向分化的诱导因子,具有明显的优势和应用潜力。
TMP化学名为四甲基吡嗪,是从中药提取物川芎的生物碱中分离得到的有效单体,具有活血化瘀、抗炎、抗氧化、抗凋亡以及改善微循环等作用。目前,临床上广泛用于闭塞性脑血管疾病如脑供血不全及脑栓塞等疾病的治疗,其确切作用途径尚不清楚。有研究显示,TMP可以降低缺血/再灌注大鼠血脑屏障的通透性[9],TMP还可以促进缺血大鼠内源性NSCs增殖。Xiao等[10]采用脑缺血模型大鼠,发现脑缺血可诱导大脑SVZ区BrdU阳性细胞增多,TMP处理可使SVZ区BrdU阳性细胞数增多,尤其缺血后7 d BrdU阳性细胞数增多达到顶峰。还有研究显示,TMP可诱导鼠骨髓间充质干细胞分化为神经元样细胞。但TMP在NSCs分化过程中是否起作用及其机制尚不清楚。本研究以NSCs为研究对象,以TMP作为NSCs定向分化的诱导剂,从分子水平初步探讨TMP对NSCs向神经细胞定向分化的影响,以期为筛选更加有效的诱导NSCs向神经细胞分化的中药单体诱导剂,TPM联合NSCs治疗缺血性脑血管病提供实验依据。本研究BrdU法和MTT法结果均显示,TMP诱导后 NSCs增殖的数量明显增多。Western blot结果也显示,TMP诱导后可见神经元特异性蛋白NSE表达。因此,TMP不仅可促进NSCs增殖,而且还能促进其分化为神经元。
TMP是一种新型的钙离子拮抗剂[11],具有改善学习记忆障碍、促使骨髓重建造血等功能。Ca2+信号是细胞转导生物学信号的重要方式之一,细胞外Ca2+水平变化是实现细胞Ca2+信号转导的关键因素[12]。神经细胞的生长、分化与Ca2+信号有密切关系[13,14]。EGTA是一种细胞外 Ca2+螯合剂,本研究使用EGTA阻断细胞外Ca2+通道后,与TMP诱导组比较,细胞NSE蛋白的表达水平显著增高,提示细胞外Ca2+的减少可促进TMP诱导NSCs向神经细胞分化,Ca2+信号在TMP诱导NSCs向神经细胞定向分化过程中起重要作用。
研究NSCs定向分化的最终目的是将诱导生成的“神经细胞”用于体内神经细胞替代治疗。但诱导生成的细胞是否具有神经细胞的功能尚缺少神经电生理学方面的证据,而且多数诱导生成的神经元样细胞体外存活时间短,妨碍了神经细胞移植的有效性。因此,对诱导生成的神经元样细胞的体外培养环境还需要更深入的探索。
[1] MicciMA,Boone DR,Parsley MA,etal.Developmentofa novel imaging system for cell therapy in the brain[J].Stem Cell Res Ther,2015,6:131.
[2] 刘丰熙,牛 凯,吴志刚,等.既济汤对脑缺血/再灌注诱导的血管性痴呆小鼠认知功能和脑内氧化应激的影响[J].中国应用生理学杂志,2015,31(2):170-173.
[3] Chang CY,Kao TK,Chen WY,et al.Tetramethylpyrazine inhibits neutrophil activation following permanent cerebral ischemia in rats[J].Biochem Biophys Res Commun,2015,463(3):421-427.
[4] Zhang Z,Zhang G,Sun Y,et al.Tetramethylpyrazine nitrone,a multifunctional neuroprotective agent for ischemic stroke therapy[J].Sci Rep,2016,6:37148.
[5] Grochmal J,Midha R.Recentadvances in stem cell-mediated peripheral nerve repair[J].CellsTissuesOrgans,2014,200(1):13-22.
[6] Fuentealba LC,Obernier K,Alvarez-Buylla A.Adult neural stem cells bridge their niche[J].Cell Stem Cell,2012,10(6):698-708.
[7] Tanaka R,Yamashiro K,Mochizuki H,et al.Neurogenesis after transient global ischemia in the adult hippocampus visualized by improved retroviral vector[J].Stroke,2004,35(6):1454-1459.
[8] Yang J,Gao F,Zhang Y,et al.Buyang Huanwu Decoction(BYHWD)enhances angiogenic effect ofmesenchymal stem cellby upregulating VEGF expression after focal cerebral ischemia[J].JMol Neurosci,2015,56(4):898-906.
[9] Tan F,Fu W,Cheng N,et al.Ligustrazine reduces bloodbrain barrier permeability in a ratmodel of focal cerebral ischemia and reperfusion[J].Exp Ther Med,2015,9(5):1757-1762.
[10]Xiao X,Liu Y,Qi C,et al.Neuroprotection and enhanced neurogenesis by tetramethylpyrazine in adult ratbrain after focal ischemia[J].Neurol Res,2010,32(5):547-555.
[11]Li N,Zhu Y,Deng X,et al.Protective effects and mechanism of tetramethylpyrazine against lens opacification induced by sodium selenite in rats[J].Exp Eye Res,2011,93(1):98-102.
[12]崔艳领,刘 甜,孙 晗,等.川芎嗪对模拟失重大鼠颈动脉平滑肌Ca2+敏感性的影响[J].中国应用生理学杂志,2016,32(4):361-364.
[13]Guo QH,Yang HJ,Wang SD.Olanzapine inhibits the proliferation and induces the differentiation ofglioma stem-like cells throughmodulating the Wnt signaling pathway in vitro[J].Eur Rev Med Pharmacol Sci,2015,19(23):4455.
[14]Yu B,Ma H,Du Z,et al.Involvement of calmodulin and actin in directed differentiation of rat corticalneural stem cells into neurons[J].Int JMolMed,2011,28(5):739-744.
