自噬抑制剂氯喹对急性酒精诱导小鼠肝损伤的影响*
2018-06-08桑文华曾美纯范小芳龚永生张海邻张宏宇孔晓霞
桑文华,曾美纯,陈 莎,陈 然,范小芳,龚永生,张海邻,张宏宇,孔晓霞Δ
(1.温州医科大学基础医学院低氧医学研究所,2.温州医科大学第二附属医院,3.温州医科大学药学院,浙江温州325035)
酗酒已成为肝脏疾病致死的主要原因之一[1]。一次饮酒过量或长期大量饮酒均可造成不同程度的肝损害,严重威胁人类健康[2]。饮酒相关的健康问题如酒精肝已成为我国的一大社会问题。酒精肝的致病因素单一,但其发生机制非常复杂,目前尚未完全清楚。有研究指出,炎症是酒精肝形成过程中的重要阶段,所以抑制炎症可能是治疗酒精肝的一种有效的策略[3]。
细胞自噬是广泛存在于真核细胞内的一种溶酶体依赖的降解产物再利用过程,是维持细胞能量平衡必不可少的途径[4]。迄今为止已证实,自噬与衰老、免疫、细胞死亡和分化有关,在退行性疾病和癌症等恶性疾病的发展中也有重要意义[5,6]。一般而言,在疾病发生发展过程中,一方面,自噬作为一种适应性机制,在疾病发展的早期清除了受损的细胞器和蛋白,产生的营养物质和能量用于恢复组织的稳态;另一方面,过度激活的自噬过程导致的细胞死亡即自噬性细胞死亡,则加速疾病的发展和恶化[7-9]。细胞自噬的分子机制十分复杂。有研究表明,抑制自噬可增加体外培养大鼠肝细胞中的TG水平,增强自噬可减少肝脏脂肪的过度积聚[10],但自噬在急性酒精中毒中的具体作用及机制尚不清楚。本研究通过使用氯喹抑制自噬,在动物模型中观察自噬在急性酒精中毒中的作用及对炎症的影响,为临床应用诱导自噬药治疗酒精中毒提供根据。
1 材料与方法
1.1 材料
抗 nuclear factorκB(NF-κB)p65、LC3、Lamin A和β-actin单克隆抗体购自Abcam公司。油红O及HE染色相关试剂购自Sigma公司;甘油三酯(TG)试剂盒、ALT、AST试剂盒购自北京普利莱基因有限公司;TNF-α、IL-6试剂盒购自北京华英生物技术研究。
1.2 动物模型构建
取20~25 g雄性C57BL/6小鼠,购自温州医科大学实验动物中心。21只小鼠适应性饲养(普通饲料)1周后随机分为3组(n=7):对照组,酒精组,氯喹干预组。根据文献[11],酒精组按 4.5 g/kg剂量给予33%(V/V)酒精灌胃一次,每两只给药间隔20 min。对照组给予等体积饮用水。氯喹干预组腹腔注射氯喹60mg/kg,30min后酒精灌胃,剂量同酒精组[12]。酒精处理后18 h实验结束,乙醚麻醉小鼠,眶后静脉丛取血分离血清,-80℃保存;剖腹取肝脏,称重后取部分置液氮中冻存,其余部分以4%多聚甲醛固定。
1.3 肝组织病理学检查和血清生化指标检测
肝组织石蜡切片,行常规HE染色。小鼠肝组织冰冻切片,行常规油红O染色。光镜下观察油红O及HE切片,评估肝脏脂肪变性情况。利用组织TG试剂盒,酶法测定肝组织TG含量。按照试剂盒说明书操作,采用全自动生化分析仪测定血清AST、ALT活性。
1.4 炎症因子检测
以酶联免疫吸附测定法(ELISA)检测血清中炎症因子TNF-α、IL-6水平,实验按说明书完成。
1.5 免疫荧光染色
肝组织石蜡切片经常规烤片,脱蜡。微波炉高火加热柠檬酸抗原修复液1 min,将组织切片浸入,再次高火加热1min,取出切片,PBS洗涤3次。5%BSA室温封闭20 min,加入特异性抗 LC3抗体(1∶100稀释),4°C孵育过夜。次日,PBST洗 3次,加入荧光素标记的相应二抗(1∶500稀释),室温孵育30 min,PBST洗 3次,加入 DAPI(1∶500稀释)孵育 10 min,封片,共聚焦显微镜拍照。实验重复3次。
1.6 Western blot检测
将肝组织剪碎置匀浆器中匀浆,裂解30 min后,将裂解液移至 1.5 ml离心管中,4℃、12 000 r/min离心 15 min。取上清置-20℃保存。应用 BIORAD法测定蛋白含量。取50μg组织蛋白做SDSPAGE电泳,将蛋白样本转移至PVDF膜上。取出膜后用5%脱脂奶粉封闭1 h,PBST洗3次,分别加入特异性抗 NF-κB p65、抗 TNF-α和抗 IL-6抗体,4°C孵育过夜。次日,PBST洗3次,加入髓过氧化物酶标记的相应二抗,置脱色摇床上摇1 h,PBST洗3次。Bio-Rad凝胶成像系统拍照分析,以β-actin为内参蛋白。实验重复3次。
1.7 统计学处理
所有数据均用均数±标准差()表示,采用SPSS 15.0软件处理。多组间的比较采用单因素方差分析,组间差异比较采用q检验。
2 结果
2.1 氯喹对急性酒精诱导的肝脏脂肪变性的影响
HE染色结果显示:对照组肝组织形态结构正常,未见脂肪空泡;酒精组小鼠肝组织有明显的脂肪空泡产生,提示酒精引起脂肪堆积;与酒精组相比,氯喹作用后,肝组织充满大量大小不一的脂肪空泡(图1A)。油红O染色结果显示:对照组小鼠肝组织中未见明显的红色脂滴;酒精组小鼠可见中等量的红色脂滴,呈小颗粒状,进一步证实酒精引起脂肪变性;与酒精组相比,氯喹组小鼠肝组织可见大量红色脂滴,呈较大颗粒状(图1B,图1见彩图页Ⅱ)。
2.2 氯喹对肝组织TG含量及血清AST和ALT活性的影响
酒精组肝组织TG含量、血清AST与ALT活性均显著高于对照组(P<0.05,P<0.01),氯喹 +酒精组上述指标均分别明显高于酒精组(P<0.05,表1)。
2.3 氯喹对肝组织中LC3蛋白表达的影响
自噬相关蛋白LC3是自噬过程中的关键蛋白之一,是自噬体形成双层膜结构的主要组成部分,已广泛用于衡量细胞自噬激活水平。肝组织LC3免疫荧光染色结果表明:对照组肝组织LC3蛋白荧光表达很弱,平均荧光强度为(58.63±4.58)%。与对照组相比,酒精组LC3蛋白的荧光表达显著增加,平均荧光强度为(134.15±6.76)%,提示酒精增加了肝细胞的自噬水平;而氯喹干预组LC3蛋白的荧光表达进一步增加,平均荧光强度为(241.94±8.17)%(图 2A)。Western blot蛋白检测结果表明:对照组 LC3-Ⅱ蛋白为 0.89±0.32,LC3-Ⅱ/LC3-I比值为1.02±0.14。与对照组比较,酒精组 LC3-Ⅱ蛋白表达增加至 1.63±0.17(P<0.05),LC3-Ⅱ/LC3-I比值增加至 1.89±0.26(P<0.05);与酒精组相比,氯喹干预组 LC3-Ⅱ蛋白的表达增至 1.98±0.32(P<0.05),LC3-Ⅱ/LC3-I比值增至 3.26±0.11(P<0.05,图 2B、2C,图 2见彩图页Ⅱ),这表明自噬抑制剂氯喹明显增加酒精诱导的自噬标志性蛋白LC3Ⅱ的表达,提示细胞自噬体与溶酶体融合和降解过程被显著抑制。
Tab.1 The changes in TG amount of hepatic tissue and serum AST and ALT activities in each group(,n=7)

Tab.1 The changes in TG amount of hepatic tissue and serum AST and ALT activities in each group(,n=7)
TG:Triglyceride;AST:Serum aspartate aminotransferase;ALT:Alanine aminotransferase*P<0.05;**P<0.01 vs control group;#P<0.05 vs ethanol group
Group TG(mg/g) AST(U/L) ALT(U/L)Control 34.5±4.1 82.4±18.2 67.3±15.7 Ethanol 68.2±3.9*200.3±16.8**145.6±8.1**CQ+Ethanol 87.5±2.6# 284.1±33.8# 201.8±17.3#
2.4 氯喹对肝组织中炎性因子表达的影响
Western blot检测结果表明:与对照组NF-κB p65表达(1.08±0.21)%相比,酒精组 NF-κB p65的表达显著增加至(1.96%±0.23)%(P<0.05);氯喹干预组 NF-κB p65的表达进一步增加至(3.43% ±0.45)% (P<0.05)。ELISA检测结果表明:与对照组小鼠血清 TNF-α水平(68.66±12.47)pg/ml相比,酒精组血清 TNF-α显著增加至(408.14±39.61)pg/ml(P<0.01);氯喹干预组血清 TNF-α进一步增加至(652.27±28.39)pg/ml(P<0.05)。与正常组小鼠血清 IL-6水平(44.34±6.39)pg/ml相比,酒精组血清 IL-6水平显著增加至(171.68±22.34)pg/ml(P<0.01);与酒精组相比,氯喹干预组血清 IL-6水平显著增加至(251.32±10.83)pg/ml(P<0.05,表2)。
3 讨论
适度饮酒有益于人体健康,但过量饮酒可使肝细胞的脂肪代谢紊乱,造成肝内脂肪积聚,逐渐形成酒精性脂肪肝,导致组织细胞缺氧,严重损害机体健康[13]。有研究表明,线粒体损伤、ROS生成、炎症反应和脂肪变性等是促成酒精性肝损害过程的重要因素[14,15],因此,清除这些损害物质可起到保护作用。炎症反应是酒精性肝损伤发展的中心环节,有研究表明,NF-κB作为重要的促炎转录因子参与酒精诱导的肝损伤[16]。长期摄入酒精明显增加肝组织中NF-κB p65的磷酸化水平,促进促炎因子 TNF-α和IL-1β的释放[17]。因此,抑制炎症反应在酒精性肝损伤防治中具有重要意义。自噬是细胞通过溶酶体降解途径调控的细胞器和蛋白循环过程,由双层膜结构包裹的自噬体或自噬空泡的大量堆积是自噬激活的主要特征[18]。目前研究表明,急性酒精暴露明显增加自噬体形成,并启动自噬过程清除损伤线粒体和肝脂肪滴,抑制自噬将增加酒精毒性和脂肪肝形成[12]。在酒精性肝损伤动物模型中,雷帕霉素诱导自噬,抑制了与酒精诱导的NF-κB信号相关的炎症反应及炎性因子的释放[19]。推测自噬在减轻酒精诱导肝损伤中起关键作用。
Tab.2 The levels of NF-κB p65,serum TNF-αand IL-6(,n=7)
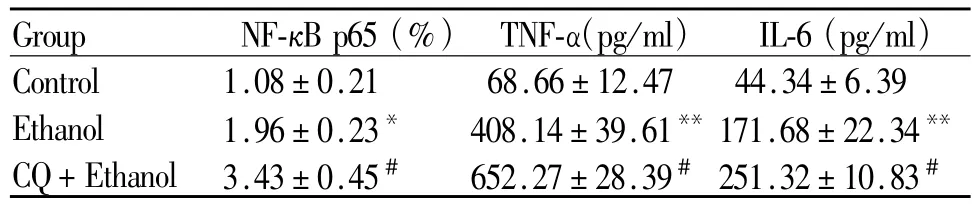
Tab.2 The levels of NF-κB p65,serum TNF-αand IL-6(,n=7)
TNF-α:Tumor necrosis factor-α;IL-6:Interleukin-6*P<0.05,**P<0.01 vs control group; #P<0.05 vs ethanol group
Group NF-κB p65(%) TNF-α(pg/ml) IL-6(pg/ml )Control 1.08±0.21 68.66±12.47 44.34±6.39 Ethanol 1.96±0.23* 408.14±39.61**171.68±22.34**CQ+Ethanol 3.43±0.45# 652.27±28.39# 251.32±10.83#
本实验通过酒精灌胃18 h,成功建立急性酒精肝损伤小鼠模型,小鼠肝组织出现明显的大小不等的脂滴,肝组织中TG含量和血清AST、ALT活性呈现不同程度的升高。研究还发现,急性酒精摄入增加肝组织NF-κB p65蛋白水平,同时增加促炎因子TNF-α和IL-6的释放。上述结果这表明,一次大量摄入酒精可引起明显的肝脏脂肪变性及肝脏炎性反应症信号激活。
LC3是自噬标志性蛋白。免疫荧光染色结果表明,一次大量摄入酒精明显增加肝自噬相关蛋白LC3的表达。Western blot结果也表明,酒精显著增强LC3-Ⅱ蛋白表达,与LC3染色结果一致,提示自噬在急性酒精中毒中发挥关键性作用。但自噬在急性酒精中毒中的具体作用机理尚不清楚。氯喹是一种常用的自噬抑制剂,通过改变溶酶体功能可阻断自噬相关的溶酶体融合和代谢过程。有研究表明,自噬在酒精诱导的急、慢性肝损伤中都有明显保护作用,使用氯喹抑制自噬将加重酒精诱导的肝损伤[20]。本实验结果与此一致:使用氯喹抑制自噬体与溶酶体的融合,即抑制自噬溶酶体功能从而抑制降解过程,增加酒精诱导的LC3表达从而抑制自噬的进程,却增加酒精诱导的脂滴形成、TG含量及血清AST、ALT活性,从而加重酒精诱导的肝损伤。这说明自噬在酒精性肝损伤中具有一定的保护作用。炎症是酒精性肝损伤主要的病理变化之一,有研究表明,氯喹抑制自噬加重LPS诱导的小鼠肝组织脂滴积累和炎症反应[21],提示自噬对炎症反应具有一定的抑制作用。本实验证实,氯喹抑制自噬加重酒精诱导的肝损伤及炎症反应,与炎症相关蛋白NF-κBP65的表达增加及血清促炎因子TNF-α和IL-6释放增加有关。
综上所述,推测在急性酒精肝损伤过程中,自噬可能作为一种适应性机制,通过降解细胞内损伤的细胞器等及循环再利用来提供能量,发挥保护作用;自噬抑制剂氯喹通过影响溶酶体功能及自噬清除损伤细胞器的功能,加重酒精诱导的肝脂肪变性及炎症,相关机理尚有待于深入探讨。炎症在酒精性肝损伤发病中有重要作用,自噬对酒精性肝损伤炎症反应具有一定抑制作用。因此,临床上治疗酒精肝在常规戒酒护肝等治疗的基础上,尝试应用诱导自噬药物如雷帕霉素等可能具有一定的价值。
[1] Pan JH,Lim YJ,Kim JH,etal.Rootbark of Ulmus davidiana var.japonica restrains acute alcohol-induced hepatic steatosisonset in mice by inhibiting ROS accumulation[J].PLoSOne,2017,12(11):e0188381.
[2] Tilg H,Moschen AR,Szabo G.Interleukin-1 and inflammasomes in alcoholic liver disease/acute alcoholic hepatitis and nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J].Hepatology,2016,64(3):955-965.
[3] Ju C,Mandrekar P.Macrophages and alcohol-related liver inflammation[J].Alcohol Res,2015,37(2):251-262.
[4] Dunn WA Jr.Autophagy and related mechanisms of lysosome-mediated protein degradation[J].Trends Cell Biol,1994,4(4):139-143.
[5] Glick D,Barth S,Macleod KF.Autophagy:cellular and molecularmechanisms[J].JPathol,2010,221(1):3-12.
[6] 朱焕勉,陈 然,薛 峰,等.自噬抑制剂氯奎对低氧诱导肺动脉平滑肌细胞增殖的影响[J].中国应用生理学杂志,2014,30(1):8-12.
[7] Hetz C.Apoptosis,necrosis and autophagy:from mechanisms to biomedical applications[J].Curr MolMed,2008,8(2):76-77.
[8] Mariйo G,Lópezotín C.Autophagy:molecularmechanisms,physiological functions and relevance in human pathology[J].CellMol Life Sci,2004,61(12):1439-1454.
[9] 何云凌,吴丽颖,黄 欣,等.自噬对不同低氧条件下PC12细胞存活的影响[J].中国应用生理学杂志,2013,29(3):193-196.
[10] Ding WX,Manley S,Ni HM.The emerging role of autophagy in alcoholic liver disease[J].Exp Biol Med,2011,236(5):546-556.
[11]NiHM,Du K,You M,etal.Critical role of FoxO3a in alcohol-induced autophagy and hepatotoxicity[J].Am J Pathol,2013,183(6):1815-1825.
[12]Ding WX,Li M,Chen X,et al.Autophagy reduces acute ethanol-induced hepatotoxicity and steatosis in mice[J].Gastroenterology,2010,139(5):1740-1752.
[13]Han JJ,PlaweckiMH,Doerschuk PC,et al.Ordinary differential equation models for ethanol pharmacokinetic based on anatomy and physiology[C]//Engineer Med Biol Society,2006.International Conference of the IEEE.IEEE,2006:5033-5036.
[14]Lieber CS.Alcoholic fatty liver:its pathogenesis andmechanism of progression to inflammation and fibrosis[J].Alcohol,2004,34(1):9-19.
[15]Lu Y,Cederbaum AI.CYP2E1 and oxidative liver injury by alcohol[J].Free Radic Biol Med,2008,44(5):723-738.
[16]Tak PP,Firestein GS.NF-kappa B:a key role in inflammatory diseases[J].JClin Invest,2001,107(1):7-11.
[17]da silva BS,Rodrigues GB,Rocha SW,et al.Inhibition of NF-κB activation by diethylcarbamazine prevents alcohol-induced liver injury in C57BL/6 mice[J].Tissue Cell,2014,46(5):363-371.
[18] Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[19]Kong X,Yang Y,Ren L,etal.Activation of autophagy attenuates EtOH-LPS-induced hepatic steatosis and injury through MD2 associated TLR4 signaling[J].Scient Rep,2017,7(1):9292-9304.
[20]Cho HI,Choi JW,Lee SM.Impairment of autophagosomelysosome fusion contributes to chronic ethanol-induced liver injury[J].Alcohol,2014,48(7):717-725.
[21] Chung KW,Kim KM,Choi YJ,et al.The critical role played by endotoxin-induced liver autophagy in the maintenance of lipid metabolism during sepsis[J].Autophagy,2017,13(7):1113-1129.
