产菊酯降解酶重组菌的高密度发酵工艺优化*
2018-06-07范新炯莫忠兴张曼曼裴生斌刘玉焕刘孝龙
范新炯,莫忠兴,张曼曼,裴生斌,刘玉焕,刘孝龙
(1.安徽医科大学基础医学院,安徽合肥230032;2.中山大学生命科学学院,广东广州510275)
目前,拟除虫菊酯类农药在农林卫病害的防治中发挥着巨大作用,其使用量在农药市场中位居第二位,且仍在持续增长[1-2]。但因拟除虫菊酯大量、频繁和不规范的使用所引发的环境和食品安全问题越来越受到人们关注。因此,如何高效降解农药残留已成为一个重要研究领域。生物法尤其是生物酶在处理拟除虫菊酯残留问题上具有处理简便、安全高效、应用范围广且无二次污染等优点,日益受到重视。到目前为止,已克隆出的拟除虫菊酯降解酶基因还较少,包括pytY、estP、pytH、pye3、pytZ、sys410、EstSt7、CMO和Est825等基因[3-11],这些基因主要处于实验室摇瓶发酵阶段,酶产量低,这在很大程度上限制了其在环境修复中的推广和应用。
微生物高密度发酵(high cell density cultivation,HCDC)是指利用一定的培养技术和装置提高菌体的发酵密度,使菌体密度较普通培养有显著提高,最终提高产物的比生产率[12]。高密度发酵是基因工程菌提高外源蛋白表达量的重要策略之一[13-14],可进一步缩短发酵周期,提高生产效率,降低生产成本,简化产品纯化工艺[15]。大肠杆菌因其遗传背景清晰、易于培养、生长速率快、转化率高、成本低廉等优点[16],已成为目前研究最成熟、使用最多的基因工程表达体系之一[17-18],采用高密度发酵技术,能有效提高菌体密度,增加重组蛋白在单位体积内的表达量。
本实验室前期通过构建吐鲁番盆地土壤的宏基因组文库,利用功能筛选方法,从中克隆到一个新型拟除虫菊酯类农药水解酶基因sys410(基因登录号JQ272178)。已将该基因克隆到表达载体pET-28a(+)上,并在E.coliBL21(DE3)中实现表达,该重组酶具有良好的稳定性与高效的催化活性[8]。在此基础上,本文以菌体密度和酶活力为指标,针对影响重组菌表达效果的因素如培养基组成、培养工艺、补料方式等进行优化,以实现该菌种小试规模的高密度高表达发酵。
1 实验材料和方法
1.1 材料
1.1.1 菌株重组大肠杆菌E.coliBL21(DE3)/pET-28a(+)-sys410,由实验室前期构建保存。
1.1.2 培养基
1)LB液体培养基(g·L-1):蛋白胨10、酵母粉5、氯化钠10、初始pH 7.0、添加终质量浓度50μg·L-1硫酸卡那霉素。
2)LB固体培养基:在液体LB培养基中添加质量浓度1.5 g·L-1琼脂粉灭菌冷却即为固体LB培养基。
3)2×YT培养基(g·L-1):蛋白胨16、酵母粉10、氯化钠5、初始pH=7.0、添加终质量浓度50μg·L-1硫酸卡那霉素。
4)微量元素混合液(g·L-1):CaCl20.04、ZnSO4·7H2O 0.18、MnSO4·H2O 0.1、Na2-EDTA 20.1、FeCl3·6H2O 16.7、CuSO4·5H2O 0.16、CoCl2·6H2O 0.18,溶解于蒸馏水中,用0.22μm超滤膜过滤除菌后直接使用。
1.2 培养和分析方法
1.2.1 种子培养 挑取单菌落至10 mL液体培养基中,37℃、220 r/min培养过夜。
1.2.2 摇瓶诱导发酵 将种子液以1%的接种量接入装有50 mL培养基中,37℃、220 r/min培养3 h后添加终质量浓度5 g·L-1的乳糖,37℃诱导培养 8 h。
1.2.3 酯酶的酶活力测定 采用对硝基苯酚法[11]。
1.2.4 菌体密度测定方法 使用浊度法间接测量菌体密度,发酵液适度稀释后,在分光光度计下测量600 nm下的光密度(A600),对应的吸光度乘以相应的稀释倍数即为对应发酵液菌体吸光密度。
1.3 单因子实验
1.3.1 培养基碳源的筛选、有机氮源的筛选、无机氮源的筛选、甘油质量浓度优化、酵母粉质量浓度优化 具体方法参照文献[19]。
1.3.2 硫酸铵质量浓度优化 以2×YT作为基础培养基,分别添加0、2、5、8、10和12 g·L-1的硫酸铵,接种培养3 h后添加终质量浓度5 g·L-1乳糖溶液,摇瓶诱导发酵8 h,取样测定菌体密度(A600)和酶活力。
1.3.3 硫酸镁浓度优化 以2×YT作为基础培养基,添加不同体积硫酸镁母液使其终浓度分别为0、5、10、20、30和40 mmol·L-1,接种培养3 h后添加终质量浓度5 g·L 乳糖溶液,摇瓶诱导发酵8 h,取样测定菌体密度和酶活力。
1.3.4 磷酸盐浓度优化 先配制1 mmol·L-1的磷酸盐母液,使用2×YT作为基础培养基,用蒸馏水稀释母液,使其终浓度分别为0、50、100、150、200和250 mmol·L-1,接种培养3 h后添加终质量浓度5 g·L-1乳糖溶液,摇瓶诱导发酵8 h,取样测定菌体密度和酶活性。
1.3.5 微量元素母液添加量的优化 使用2×YT作为基础培养基,分别添加体积分数0.5、1、1.5、2、2.5和3 mL·L-1的微量元素母液,接种培养3 h,添加终质量浓度5 g·L-1乳糖溶液,摇瓶诱导发酵8 h,取样测定菌体密度和酶活力。
1.4 正交实验
使用正交试验设计分析方法对发酵培养基进行优化(表1),以甘油、酵母粉、硫酸铵和磷酸盐作为试验因素,选用L9(34)(3水平4因素)正交试验对培养基进行优化。

表1 正交试验因素水平表Table 1 Orthogonal experimental factors and levels
1.5 摇瓶发酵条件优化
1.5.1 乳糖诱导浓度的优化 使用优化培养基进行摇瓶培养,接种培养3 h,分别添加终质量浓度为2、4、6、8和10 g·L-1的乳糖,摇瓶诱导发酵8 h,取样测定菌体密度和酶活力。
1.5.2 诱导温度的优化 以优化培养基进行摇瓶培养,37℃培养3 h,添加终质量浓度6 g·L-1乳糖,分别置于30、34、37、40和42℃条件下诱导培养8 h,取样测定菌体密度和酶活性。
1.5.3 接种量的优化 使用1%~5%接种量,接种培养3 h,加入终质量浓度6 g·L-1乳糖继续诱导培养8 h后取样测定菌体密度和酶活力。
1.5.4 培养基初始pH的优化 使用初始pH为6.8~7.6之间的初始培养基,接种培养3 h后,加入终质量浓度6 g·L-1乳糖继续诱导培养6 h,取样测定菌体密度和酶活力。
1.5.5 装液量的优化 以优化培养基进行发酵,250 mL三角瓶,装液量分别为50、75、100、125和150 mL,37℃条件下培养3 h,加入终质量浓度6 g·L-1乳糖继续诱导培养6 h,取样测定菌体密度和酶活力。
1.6 7.5 L发酵罐发酵工艺优化
1.6.1 溶氧浓度对菌体生长影响 发酵试验分3组进行,标记为a组、b组和c组,发酵过程使用3种不同的供氧方式:a组(固定转速500 r/min,固定通风量1.5 vvm,单管道通气不控制溶氧);b组(通过溶氧联动转速在200~1 000 r/min范围内,调节通风量1~4 vvm,单管道通气控制溶氧20%);c组(通过溶氧联动转速在200~1 000 r/min范围内,调节通风量1~4 vvm,双管道通气控制溶氧20%)。3组试验除供氧方式外,其他发酵工艺相同为:7.5 L发酵罐装液量为3.5 L,接种量2%,通过流加3 mol·L-1磷酸及φ=25%氨水,维持发酵液pH=7.0,控制发酵温度为37℃,维持罐压0.05 MPa,接种培养4 h后,以1.8 mL/min恒速流加A补料液,培养过程中实时监测培养基的溶氧值并绘制溶氧曲线,每隔1 h取样测定菌体密度,并根据每个测量点绘制生长曲线。
1.6.2 培养基初始碳氮源含量和不同的补料液对菌体生长的影响 本次发酵试验分4组进行,标记为a组、b组、c组和d组,通过比较不同初始碳氮源浓度和不同的补料液对菌体生长的影响(各组使用的发酵初始碳氮源浓度及补料液种类见表2)。其他发酵工艺相同:在7.5 L发酵罐装液量为3.5 L,接种量2%,转速调节在200~1 000 r/min范围内,通风量1~4 vvm,双管道通气控制溶氧20%,维持罐压0.05 MPa,流加3 mol·L-1磷酸及φ=25%氨水,维持发酵液pH=7.0,控制发酵温度为37℃,发酵前期以1.8 mL/min恒速流加A补料液,待通气和转速达到最大值时,恒溶氧20%联动补料进行培养,发酵过程中,每隔1 h取样测定菌体密度A600,并根据每个测量点绘制生长曲线。

表2 发酵初始碳氮源浓度及不同的补料液Table 2 The initial concentration of carbon and nitrogen resources and the type of feed liquid
1.6.3 不同的诱导时期对菌体的生长和酶活性的影响 发酵试验分为a组、b组和c组3组进行,除诱导方式外,其他发酵工艺相同:7.5 L发酵罐装液量为3.5 L,接种量2%,调节转速在200~1 000 r/min范围内,通风量1~4 vvm,双管道通气控制溶氧20%,维持罐压0.05 MPa,流加3 mol·L-1磷酸及φ=25%氨水,维持发酵液pH=7.0,控制发酵温度为37℃,发酵前期以1.8 mL/min恒速流加A补料液,待通气和转速达到最大值时,恒溶氧20%联动补料,培养到合适的时间,添加终质量浓度6 g·L-1乳糖进行诱导,其中,a组在菌体生长对数前期开始诱导(距离发酵开始12 h);b组在对数生长中后期进行诱导(距离发酵开始16 h);c组在平稳期开始诱导(距离发酵开始17 h),发酵过程每隔2 h取样测定菌体密度和酶活力。
1.7 粗酶粉的制备
1)用管式连续离心机连通发酵罐取样口,在8 000 r/min、恒温4℃条件下,连续离心收集湿菌体。取出离心收集的菌体并称重,将菌体重悬于pH=6.8的磷酸盐缓冲液,用磁力搅拌器搅拌均匀,配成15%的菌悬浮液,菌悬液用液体高压破碎仪在170 MPa、4℃条件下进行破碎,破碎液在4℃条件下、1 000 r/min离心20 min,收集上清液,所得的上清液即为粗酶液。
2)将粗酶液置于冷冻干燥盘,厚度小于1 cm(厚度过大影响冻干),将冷冻干燥盘放置于超低温冰箱中,-80℃条件下冷冻5 h,待粗酶液冻结成冰冻状,置于真空冷冻干燥设备中,分3个阶段进行冷冻干燥:第1阶段在-20℃维持5~6 h;第2阶段在-10℃维持8~10 h;第3阶段在5℃维持10~12 h。经冷冻干燥后获得的块状酶饼用研钵研磨成粗酶粉,并测定酶活力。
1.8 拟除虫菊酯类农药的降解能力测定
取1 g该粗酶粉溶解于1 L蒸馏水中混匀,取3 mL该混匀液与1 mL质量浓度为4 mg·L-1的农药标准液(氯氟氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯)混合,37℃反应20 min,用正己烷提取剩余农药,取1μL测定气相色谱分析,具体方法参照文献[11]。
2 实验结果与讨论
2.1 单因子实验
2.1.1 培养基碳源的筛选 碳源是微生物生长的一类重要营养物质。常用的碳源有糖类、油脂、有机酸、机酸酯和小分子醇。其中,葡萄糖具有容易被微生物代谢、价格低廉和使用方便等优点,常被用作工业发酵的首选碳源和培养基的主要成分,但以葡萄糖作为碳源时,高浓度的葡萄糖容易导致大量乙酸产生。以甘油作为碳源可明显减少乙酸的积累,如表3所示,该重组菌利用甘油作为碳源时,菌体生长密度达到最大(A600=6.1),酶活力最高为48.5 U·mL-1,所以选定甘油作为发酵培养基碳源。

表3 不同碳源对菌体生长及酶活力的影响Table 3 Effect of carbon sources on cells growth and enzymatic activity
2.1.2 培养基氮源的筛选 氮源指构成微生物细胞成分和代谢产物的含氮营养物。氮源一般可分为有机氮源和无机氮源。常见的有机氮源有酵母粉、蛋白胨、牛肉膏、酵母膏、黄豆饼粉、花生饼粉、棉子饼粉、玉米浆和鱼粉等。有机氮源成分复杂,富含各种蛋白质、肽类和游离氨基酸,还含有一定的糖类、脂类、微量元素、无机盐、维生素以及生长因子等,因此,微生物在富含有机氮源的培养基中生长旺盛。相对于有机氮源,无机氮源具有成分单一,质量较稳定,能被微生物快速利用的特点。常见的无机氮源有硫酸铵、硝酸铵、硝酸钠、柠檬酸三铵、氯化铵、氨水和尿素等。通过比较不同的氮源对菌体生长和酶表达的影响,结果见表4与表5,表明以酵母粉作为有机氮源进行培养,获得的菌体密度最大(A600=7.53),酶活力最高为65.1 U·mL-1。在添加同等质量的无机氮源情况下,以硫酸铵作为无机氮源,获得细胞密度最大(A600=6.54),酶活力57.3 U·mL-1。
2.1.3 培养基甘油质量浓度优化 结果如图1所示,当甘油处于较低质量浓度水平时,随着质量浓度的提高,菌体的生长密度和酶活力都有所提高。当甘油质量浓度达到20 g·L-1后,随着甘油质量浓度的提高,细胞密度和酶活力逐渐下降,适合的甘油质量浓度范围是20 g·L-1。

表4 不同的有机氮源对菌体生长和酶活力的影响Table 4 Effect of organic nitrogen on cells growth and enzymatic activity

图1 不同质量浓度的甘油对菌体和酶活力的影响Fig.1 Effect of different mass concentration of glycerol on cells growth and enzymatic activity
2.1.4 酵母粉浓度优化 酵母粉是发酵中经常使用的有机氮源,它不仅含有丰富的蛋白质、游离氨基酸、单核苷酸、维生素和微量元素等营养物质,而且易于被微生物吸收利用,结果见图2。酵母粉对菌体的生长和酶活性的影响非常明显。当酵母粉处于较低浓度时,随着酵母粉质量浓度的提高,细胞密度和酶活性都有明显的提高;当酵母粉质量浓度为20 g·L-1时,菌体密度达到最高为8.3,酶活力达到83 U·mL-1;随后,细胞密度和酶活性反而会下降,可能因氮源含量过于丰富,导致大量的代谢副产物的产生,影响菌体的生长和外源蛋白的表达。

图2 不同质量浓度的酵母粉对菌体和酶活力的影响Fig.2 Effect of different mass concentration of yeast extract on cells growth and enzymatic activity
2.1.5 硫酸铵浓度优化 结果如图3所示,当硫酸铵处于较低浓度时,随着硫酸铵浓度的提高,菌体密度和酶活性提高,但硫酸铵超过一定浓度后,随着硫酸铵浓度的提高,细胞密度和酶活性反而会下降,适合的硫酸铵质量浓度为8 g·L-1。
2.1.6 硫酸镁浓度优化 镁元素是许多酶的活化剂,具有促进碳水化合物的新陈代谢、核酸的合成和磷酸盐转化等作用,合适的硫酸镁浓度有利于菌体生长和产物的表达。本实验结果表明(图4),当硫酸镁处于较低浓度时,随着硫酸镁浓度的提高,细胞密度和酶活性有所提高,但硫酸镁浓度超过10 mmol·L-1时,随着硫酸镁浓度增加,菌体密度A600未出现明显变化,但酶活性会逐渐降低,合适的硫酸镁浓度10 mmol·L-1。

图3 不同浓度的硫酸铵对菌体和酶活力的影响Fig.3 Effect of different concentration of(NH4)2 SO4 on cells growth and enzymatic activity

图4 不同浓度的硫酸镁对菌体和酶活力的影响Fig.4 Effect of different concentration of MgSO4 on cells growth and enzymatic activity
2.1.7 培养基磷酸盐缓冲液浓度优化 磷酸盐是发酵过程常用的缓冲物质,不但具有维持溶液渗透压和质粒的稳定性的作用,而且对微生物的生长和外源蛋白的表达也有影响。徐浩等[19]利用高密度发酵生产突变型重组人肿瘤坏死因子rhTNFa-DK2,研究发现质粒的复制速度与培养基中磷酸盐的含量有直接的关系,当在低含量磷酸盐含量时,质粒复制速度慢,菌体密度低,产物产量不能达到生产要求;当磷酸盐含量过高时,又会导致菌体前期生长旺盛,衰退期提前到达,菌体密度也难以达到理想值。本实验现象(图5)与徐浩等[19]实验现象一致,当硫酸铵浓度为100 mmol·L-1时,菌体密度和酶活力最高。
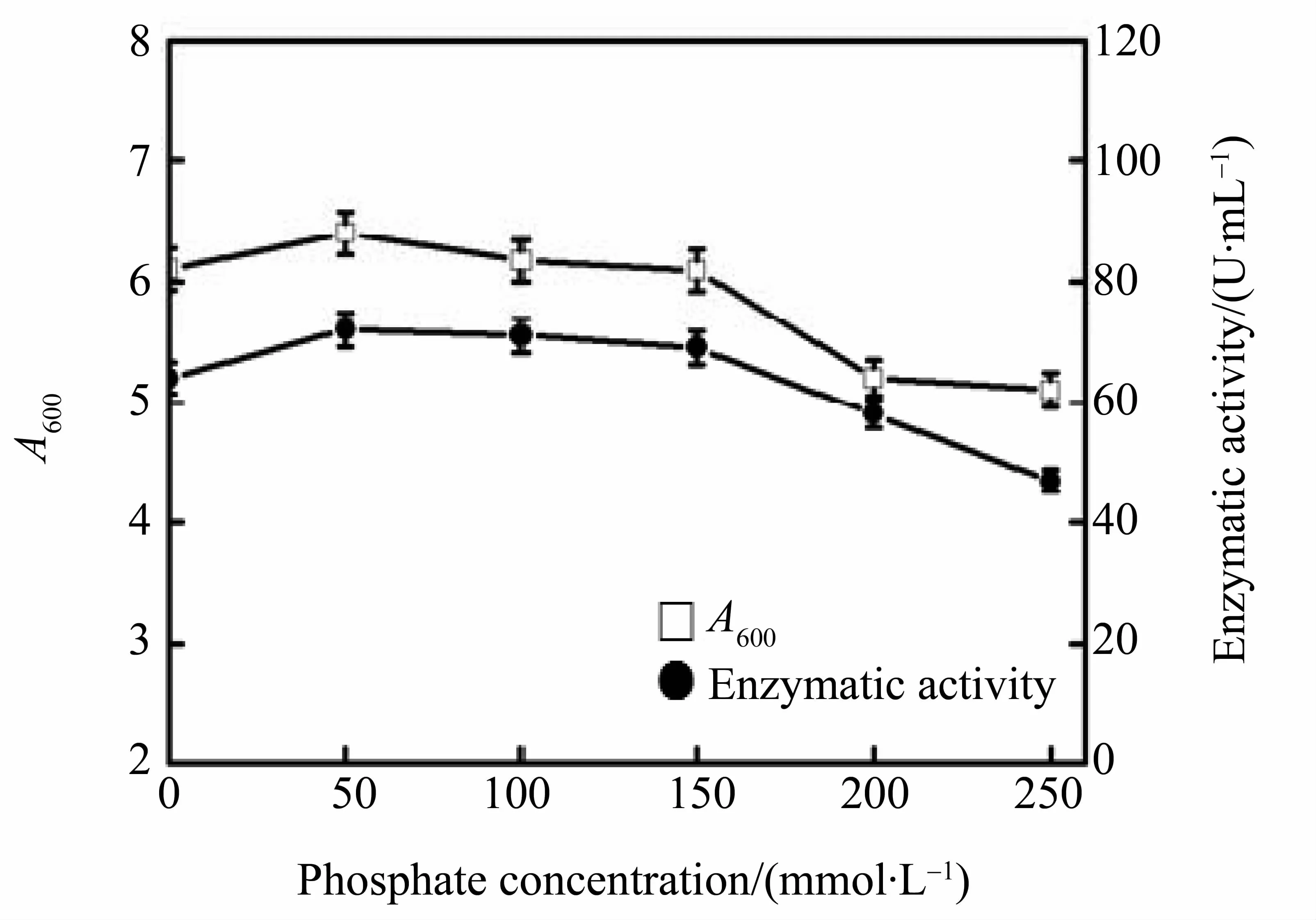
图5 不同浓度的磷酸盐对菌体和酶活力的影响Fig.5 Effect of different concentration of phosphate on cells growth and enzymatic activity
2.1.8 培养基微量元素母液添加量的优化 微量元素是指一些需求量少但对细胞的生长繁殖和基因表达产生很大影响的元素,像钙、铁、锰、锌等。如朱才庆等在大肠杆菌的培养研究中发现,在基础培养基中添加混合微量元素后,菌体生长得到很大的改善[20],在较低体积分数时,微量元素对该重组菌生长和酶活性均有促进作用,体积分数过高不利于菌体的生长和酶的表达,适合的微量元素添加量为1.5 mL·L-1(图6)。

图6 不同体积分数的微量元素对菌体和酶活力的影响Fig.6 Effect of different volume concentration of trace elements on cells growth and enzymatic activity
2.2 正交实验
根据单因素试验结果,使用正交试验设计分析方法对发酵培养基进行优化,以甘油、酵母粉、硫酸铵和磷酸盐作为试验因素,选用L9(34)(3水平4因素)正交试验对培养基进行优化,实验结果见表6。

表6 正交试验设计以及结果Table6 Orthogonal experimental design and results

表7 实验结果方差分析Table7 The results of analysis of variance
结果分析:利用正交助手软件,以菌体密度A600作为标准,进行直观分析,结果(图7)表明,酵母粉对菌体的生长影响极其显著,而甘油、硫酸铵和磷酸盐的影响不显著,4种成分对菌体生长影响的关系为酵母粉>甘油>硫酸铵>磷酸盐。较优的培养基组合为:20g·L-1的甘油、20g·L-1酵母粉、8g·L-1硫酸铵和100mmol·L-1磷酸盐缓冲液。
综上所述,摇瓶培养的最适培养基为:20g·L-1的甘油、20g·L-1酵母粉、8g·L-1硫酸铵、100mmol·L-1磷酸盐缓冲液以及1.5mL·L-1微量元素混合液。
2.3 摇瓶发酵工艺优化
2.3.1 乳糖诱导质量浓度的优化 当乳糖质量浓度在2~6g·L-1范围内时,随着加入的乳糖质量浓度的提高,酶量会提高,但是,当乳糖质量浓度大于6g·L-1,酶的产量与乳糖质量浓度呈负相关(图7),这说明过高的乳糖质量浓度可能抑制了酶的表达。另外,乳糖质量浓度对菌体终浓度影响不大,这可能是初始培养基营养较为丰富,此时,营养物质不是培养的限制因素,另一种可能是菌体对乳糖的利用情况较差。所以,选定以终质量浓度为6g·L-1的乳糖溶液进行诱导。
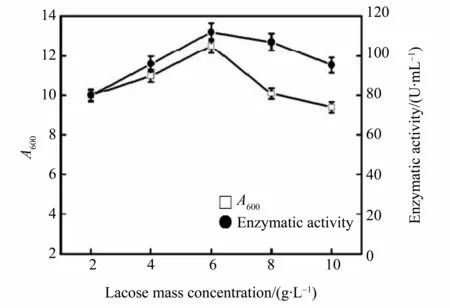
图7 不同质量浓度乳糖对菌体生长和酶活力的影响Fig.7 Effect of different concentration of lactose on cells growth and enzymatic activity
2.3.2 诱导温度的优化 随着温度提高,最终的菌体的密度也逐渐提高(图8),说明较高的温度利于大肠杆菌的生长。在30~37℃范围内,随着温度的提高,酶表达量有所提高,但提高不明显(从86提升到97 U·mL-1),当诱导温度大于37℃时,酶的表达量会下降,这说明过高的温度不利于酶的表达。

图8 诱导温度对菌体生长和酶活力的影响Fig.8 Effect of induction temperature on cells growth and enzymatic activity
2.3.3 接种量的优化 接种量的大小主要影响发酵周期和发酵产量。由于菌种液中含有大量的体外水解酶,利于菌体对培养基的分解利用,因此,合适的接种量利于菌体快速度过延滞期。但是接种量过大,容易造成菌体生长过快,培养液粘度增大,影响溶氧,结果见图9。接种培养8 h后,加入终质量浓度6 g·L-1乳糖继续诱导培养6 h后取样测定菌体密度和酶活性。摇瓶培养14 h,接种量对酶活性的影响不明显,使用2%~3%接种量较有利于菌体生长。
2.3.4 培养基初始pH的优化 细胞代谢网络需要各种酶的参与,合适而稳定的pH值是高效酶促反应的前提。结果如图10,该菌体在pH=7.2的初始培养下生长较好,在pH=7.0的初始培养基中酶表达较好。为了获得更多的表达产物,摇瓶发酵选用pH=7.0的初始培养基。值得注意的是,微生物在新陈代谢过程中产生的弱酸碱会反过来影响培养基的pH值,一般摇瓶条件下,不能通过补加酸碱维持培养基的pH,因此,适合菌体生长和产物表达的初始pH可能与菌体生长和酶活力的最适pH不一致。另外,使用补料式摇床或发酵罐可研究菌体生长和酶表达的最适pH值。

图9 接种量对菌体生长和酶活力的影响Fig.9 Effect of inoculum volumes on cells growth and enzymatic activity

图10 培养基初始pH值对菌体生长和酶活力的影响Fig.10 Effect of initial pH of culture media on cells growth and enzymatic activity
2.3.5 装液量的优化 结果见图11,装液量对菌体密度和酶活力有很大,随着装液量的增加,菌体密度和酶的表达量会快速降低。装液量主要影响培养基溶解氧,而溶解氧是菌体生长和酶活力的重要影响因素,合适的装液量有利于菌体生长和产物表达。250 mL三角瓶适合的装液量为50 mL。另外,可通过调节摇床转速提高溶氧值,转速一般维持在150~250 r/min。
2.3.6 在优化培养基和培养条件下的摇瓶结果 使用优化的培养基和培养工艺进行摇瓶培养(表8),培养14 h后,获得菌体密度A600为10.4,是优化前的1.8倍,酶活力也达到97.4 U·mL-1,是优化前的2倍。

图11 装液量对菌体生长和酶活力的影响Fig.11 Effect of liquid volume on cells growth and enzymatic activity

表8 优化条件下的摇瓶结果Table 8 Cells growth and enzymatic activity in the optimum condition
2.4 7.5 L发酵罐发酵工艺优化
2.4.1 供氧方式对菌体生长影响 通过对发酵罐通气管道的改装,比较了重组菌在单管道通气不控制溶氧、单管道通气控制溶氧20%和双管道通气控制溶氧20%3种供氧条件下的生长情况,结果见图12,发现在不控制溶氧的条件下,溶氧值会在发酵培养5 h左右降至0,溶氧降为0的几个小时内,菌体生长缓慢,快速进入稳定期,最终菌体密度A600仅为20左右(图12a)。当使用单管道通气,控制溶氧20%时,菌体的对数生长期明显延长,在相同的发酵时间内,获得的菌体密度A600达到50(图12b)。当使用双管道通气,控制溶氧20%的供氧方式进行培养时,获得的菌体密度A600进一步提高,达到80(图12c),推测其原因可能是,采用双管道通气,培养基接触的出气孔增多(由原来的10个增加到20个),培养基受氧面积大为增加,缓解了局部缺氧,所以菌体表现出较长时间的生长活力、对数生长期延长的特点,最终菌体密度A600能达到80。
2.4.2 培养基初始碳氮源浓度和补料液类型对菌体生长的影响 比较不同浓度碳氮的初始培养基和不同类型补料液对发酵结果的影响,结果见图13。

图12 供氧方式对菌体生长的影响Fig.12 Effect of different dissolved oxygen concentration on cells growth
通过比较图13曲线的a、b、c发现,以较低碳氮源浓度的初始培养基,流加碳氮源的培养工艺更容易实现高密度发酵。其中,曲线a是在含质量浓度为10 g·L-1甘油和酵母粉的初始培养结果,获得的菌体密度A600达到145。曲线c是在含质量浓度30 g·L-1甘油和酵母粉的初始培养基上的培养结果,获得菌体终密度A600仅为124,两者菌体终密度相差20左右。推测其原因是,以较高浓度的初始培养基进行培养,菌体在发酵前期代谢异常旺盛,产生大量的代谢副产物,积累的代谢副产物对菌体生长活力产生影响。此外,本文也试验了在补料过程中只流加甘油的培养方式,结果见图13曲线d,比较图13曲线d与c发现,只流加甘油的分批补料方式下,培养16 h左右,菌体生长就变得异常缓慢,菌体生长基本到达稳定期,此时即使加大甘油的流量,菌体生长速率也末见提高,最终获得的菌体密度A600仅为75。相反,补料流加碳氮源的培养方式此时正处于于快速生长阶段,最终获得的菌体密度A600为124,是前者1.6倍。所以,在分批补料发酵过程中,单纯靠补充碳源的补料方式并不能满足菌体的生长,适量补加氮源也十分重要,该试验结果与摇瓶培养基优化中正交分析结果相吻合,表明酵母粉是影响菌株生长的最显著因素。

图13 不同的初始碳氮源浓度和不同的补料液对菌体生长的影响Fig.13 Effect of different initial concentration of carbon and nitrogen resources and different feed liquid on cells growth
2.4.3 不同的诱导起始点对菌体的生长和酶表达的影响 不同的诱导起始点对菌体生长和酶表达的影响结果见图14,其中图14a为在菌体对数生长前期开始诱导,最终获得的菌体密度A600为125,酶活力为2 200 U·mL-1。图14b为在菌体对数生长中后期开始诱导,最终获得的菌体密度A600为142,酶活力为3 000 U·mL-1。图14c为在稳定期开始诱导,最终获得的菌体密度A600为145,酶活力为2 540 U·mL-1。结果表明,选取不同的诱导起始点对菌体的生长和酶表达影响很大,选择在对数生长中后期开始诱导更有利于菌体的生长和酶的表达。较摇瓶发酵结果相比,高密度发酵后的菌体密度提高13.6倍,酶活力提高30.8倍。

图14 不同的诱导起始点对菌体的生长和酶活力的影响Fig.14 Effects of induction time on cells growth and enzymatic activity
2.5 粗酶粉对拟除虫菊酯类农药的降解能力
每升破碎上清液经冷冻干燥处理后,可获得68.4 g粗酶粉。经测定,该酶粉的比酶活为119 426.9 U· g-1。GC检测如图15所示,经计算该酶对4种拟除虫菊酯类农药的降解率分别为96.3%、97.1%、96.4%和96.2%,其降解率高于已报到的其他拟除虫菊酯类农药降解酶[3-10]。

图15 气相色谱分析高密度发酵酶粉降解拟除虫菊酯的能力Fig.15 GC analysis of different pyrethroids hydrolyzed by enzymes.
3 结 论
1)本研究采用单因素和正交实验法对重组菌E.coliBL21(DE3)/pET-28a(+)-sys410进行摇瓶发酵条件优化,在最优培养基(含质量浓度20.0 g·L-1的甘油和酵母粉、8.0 g·L-1的硫酸铵,终浓度100.0 mmol·L-1的磷酸盐和5.0 mmol·L-1硫酸镁以及体积分数1.5 mL·L-1的微量元素)和最优发酵条件(装液量50 mL/250 mL、初始培养基pH 7.0、接种量2%,接种培养8 h后乳糖诱导6 h)下获得菌体密度A600为10.4,酶活力也达到97.4 U·mL-1。
2)以摇瓶发酵工艺为基础,对该重组菌进行了7.5 L发酵罐发酵工艺优化,最终菌体密度A600达到142,酶活力为3 000 U·mL-1,与摇瓶发酵相比,分别提高13.6和30.8倍,这是有关拟除虫菊酯类农药降解酶成功高密度发酵的第一例报道,为拟除虫菊酯类农药降解酶的扩大生产以及进一步的实际应用打下基础。
3)发酵菌体经冷冻干燥后获得粗酶粉,该酶粉对四种拟除虫菊酯类农药的降解率达95%以上,降解效果优于已报到的其他拟除虫菊酯类农药降解酶。
[1]LIN Q S,CHEN SH,HU M Y,et al.Biodegradation of cypermethrin by a newly isolated actinomycetes HU-S-01 from wastewater sludge[J].Int J Environ Sci Tech,2011,8:45-56.
[2]ZHANG C,WANG S H,YAN Y C.Isomerization and biodegradation of betacypermethrin byPseudomonas aeruginosaCH7 with biosurfactant production[J].Bioresour Technol,2011,102:7139-7146.
[3]RUAN Z Y,ZHAI Y,SONG J L,et al.Molecular cloning and characterization of a newly isolated pyrethroiddegrading esterase gene from a genomic library ofOchrobactrum anthropiYZ-1[J].PLoSOne,2013,8:e77329.
[4]WU P C,LIU Y H,WANG Z Y,et al.Molecular cloning,purification,and biochemical characterization of a novel pyrethroid-hydrolyzing esterase fromKlebsiella sp.strain ZD112[J].JAgric Food Chem,2006,54:836-842.
[5]WANG B Z,GUOP,HANGB J,et al.Cloning of a novel pyrethroid-hydrolyzing carboxylesterase gene fromSphingobium sp.JZ-1 and characterization of the gene product[J].Appl Environ Microbiol,2009,75:5496-5500.
[6]LI G,WANG K,LIU Y H.Molecular cloning and characterization of a novel pyrethroid-hydrolyzing esterase originating from the metagenome[J].Microb Cell Fact,2008,7:38.
[7]ZHAI Y,LI K,SONG J L,et al.Molecular cloning,purification and biochemical characterization of a novel pyrethroid-hydrolyzing carboxylesterase gene fromOchrobactrum anthropiYZ-1[J].J Hazard Mater,2012,221:206-212.
[8]FAN X J,LIU X L,HUANGR,et al.Identification and characterization of a novel thermostable pyrethroid-hydrolyzing enzyme isolated through metagenomic approach[J].Microb Cell Fact,2012,11:33-43.
[9]WEI T,FENG SX,SHEN Y L,et al.Characterization of a novel thermophilic pyrethroid-hydrolyzing carboxylesterase fromSulfolobus tokodaiiinto a new family[J].J Mol Catal B-Enzym,2013,97:225-232.
[10]CHEN SH,LIN Q S,XIAO Y,et al.Monooxygenase,a novel beta-cypermethrin degrading enzyme fromStreptomyces sp[J].PLoSOne,2013,8:e75450.
[11]刘孝龙,刘玉焕,范新炯.新型拟除虫菊酯降解酶的分子改造及降解特性研究[J].中山大学学报(自然科学版),2017,56(4):111-117.LIU Xiaolong,LIU Yuhaun,FAN Xinjiong.Molecular modification and degradation characteristics of a novel marine mud-derived pyrethroid hydrolase[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2017,56(4):111-117.
[12]黎鸿平,黄海婵,钟卫鸿.大肠杆菌高密度培养研究进展[J].化学与生物工程,2012,29:1-5.LI Hongping,HUANG Haichan,ZHONG Weihong.Research progress on high cell density cultivation ofE.coli[J].Chem Bioeng,2012,29:1-5.
[13]SHILOACH J,FASS R.GrowingE.colito high cell density-A historical perspective on method development[J].Biotechnol Adv,2005,23(5):345-357.
[14]吴江雪,符武钊,张添元,等.内皮细胞抑制素在毕节酵母中的表达与活性分析[J].中山大学学报(自然科学版),2003,42(6),83-86.WU Jiangxue,FU Wuzhao,ZHANG Tianyuan,et al.Expression of human endostatin inP.pastorisand the bioactivity of its product[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2003,42(6):83-86.
[15]叶波平,潘征,李怀标,等.鲨肝刺激物质类似物在大肠杆菌中的高密度发酵[J].生物工程学报,2009,25(9):1371-1378.YE Boping,PAN Zheng,LI Huaibiao,et al.High celldensity fermentation of shark hepatical stimulator analogue inEscherichia coli[J].Chin J Biotech 2009,25(9):1371-1378.
[16]NUCP,NUCK.Recombinant protein production inEscheichia coli[J].Postepy Biochemii,2006,52(4):448-456.
[17]DONG X,TANG B,LI J,et al.Expression and purification of intact and functional soybean(Glycine max)seed ferritin complex inEscherichia coli[J].JMicrobiol Biotechnol,2008,18(2):299-307.
[18]徐冰,马江锋,梁丽亚,等.基于高密度培养的反复分批发酵法生产丁二酸[J].化工学报,2011,62(9):2595-2599.XU Bing,MA Jiangfeng,LIANG Liya,et al.Succinic acid production by repeated batch fermentation based on high density culture[J].CIESC J,2011,62(9):2595-2599.
[19]徐皓,李民,阮长庚,等.高密度发酵生产突变型重组人肿瘤坏死因子rhTNFα-DK2的研究[J].工业微生物,1998,2:22-27.XU Hao,LI Min,RUAN Changgeng,et al.Production of mutant recombinant human tumor necroses factor by high density cell culture[J].Industrial Microbiology,1998,2:22-27.
[20]朱才庆,叶勤.微量元素对大肠杆菌生长和乙酸生成的影响研究[J].微生物学报,2004,2:230-234.ZHU Caiqing,YE Qin.Effects of trace elements on growth and acetate production ofEscherichia coli[J].Acta Microbiol Sin,2004,2:230-234.
