响应面法优化超声波-酶法提取紫色花椰菜原花青素
2018-06-06崔晶蕾刘振春周瑾琨
◎ 崔晶蕾,刘振春,彭 雪,张 悦,周瑾琨
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
紫色花椰菜,又名紫色花菜、紫色椰花菜、紫色甘蓝花、紫色洋花菜、紫色球花甘蓝[1],属十字花科芸薹属植物,原产于欧洲地中海沿岸一带,2014年在台湾上市,紫色花椰菜可食性部位为花球部,依据新鲜程度不同,花球呈现的颜色也不同,常见的颜色有深紫红色和浅紫红色两种,叶片深绿色,主根呈绿色夹杂紫色[2]。紫色花椰菜营养价值极为丰富,富含丰富的原花青素及维生素A、维生素B1、维生素B2、维生素C,其蛋白质和钾的含量极高,其中蛋白质高达3%左右,钾含量更是达到富钾蔬菜等级,紫色花椰菜的含钾量和香蕉等水果相当,被人们誉为“高蛋白高钾蔬菜”。由于它不像芹菜一般有着大量的粗纤维,紫色花椰菜花球细密,质地柔嫩,所以口感极佳[3]。紫色花椰菜口味和花椰菜类似,风味鲜美,常见的食用方法为炒制、白灼、炖煮等。
目前,对原花青素的提取研究较为广泛和全面,最早期的提取原花青素的方法是溶剂提取法,选用的溶剂也是最安全的水,原料基本上为松树皮、葡萄籽、蓝莓果渣等。随后人们发现,适当的升温、加压、脱氧热水等方法较常规的常温下用水提取效果明显好很多。随着逐步的发展,又考虑到用有机溶剂、有机酸等提取,还有一些处理方法也能加速原花青素的提取效率,例如超声波辅助提取法[4]、微波辅助提取法[5]、超声波微波联用[6]、超临界CO2提取法[7]、酶法[8]等。还有依据提取物性质的不同,加入纤维素酶制剂,促进植物细胞壁裂解,使原花青素提取物加速流出[9]。
目前,原花青素的测定方法也有很多且技术较为成熟,常见的测定原花青素含量的方法有正丁醇-盐酸法[10]、香草醛-盐酸法[11]、香草醛-硫酸法[12]、高效液相色谱法等[13],考虑到测定精度、测定结果的稳定性、操作简便及成本等因素,本试验采用低浓度香草醛盐酸法测定紫色花椰菜中原花青素的含量。
1 材料与方法
1.1 材料与仪器
紫色花椰菜:市售,产地上海;紫色花椰菜清洗后沥干水分,经过挑选、除杂、切碎、烘干、粉碎,过60目筛后备用。原花青素标准品:纯度≥95%,天津一方科技有限公司;香兰素:纯度≥99.5%,国药集团化学试剂有限公司;纤维素酶:酶活性≥150 U/mg,上海惠世生化试剂有限公司;甲醇、无水乙醇、盐酸、冰醋酸、乙酸钠:均为分析纯,北京化工厂。
101A-3ET电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂)、RZ102微型植物粉碎机(天津泰斯特仪器有限公司)、SHA-B水浴恒温振荡箱(金坛市江南仪器厂)、HH-2数显恒温水浴锅(金坛市江南仪器厂)、LXJ-ⅡB低速大容量离心机(上海安亭科学仪器厂)、AUY220电子天平(上海精天电子仪器有限公司)、TU-1901紫外分光光度计(北京普析通用仪器有限公司)、JY99-2D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、旋转蒸发仪(上海笠化仪器设备有限公司)。
1.2 实验方法
1.2.1 紫色花椰菜原花青素的提取方法
准确称取紫花菜粉末1.000 0 g置于100 mL小烧杯中,加入20 mL提前配制好的pH为5的HAc-NaAc缓冲溶液,向料液中加入一定质量的纤维素酶,在一定温度下水浴振荡酶解,然后在一定超声功率下进行一定时间的超声波提取后,分离上清液,将过滤后的滤渣中加入20 mL体积分数为50%的乙醇,在相同功率下提取20 min,保存滤液。再次将滤渣中加入20 mL体积分数为50%的乙醇,超声提取10 min,合并所有滤液并过滤。将收集的所有滤液置于旋转蒸发仪中蒸发浓缩至恒重,旋蒸温度为40 ℃,所得到的即为原花青素浓缩液。用甲醇将其定容至50 mL容量瓶中,在3 000 r/min下离心20 min,移取1 mL的上层清液保温比色测定吸光度,并通过原花青素标准曲线计算提取物浓度,记录并处理实验数据。
1.2.2 标准曲线的制作
配制溶液浓度为0.2 mg/mL的原花青素标准溶液,分别取1、2、3、4 mL和5 mL配制好的标液用甲醇定容至10 mL,震荡均匀后,各取1 mL(另取1 mL甲醇为空白)放置于试管中分别编号记录,各加入5 mL显色剂(A:2%香草醛-甲醇溶液和B:8%盐酸-甲醇溶液,1∶1,现用现配),摇匀,避光,在恒温水浴锅中保持35 min,温度控制在(30±1)℃,保温比色,取出比色皿,在500 nm处测其吸光度,分别平行测定3组,取平均值,绘制标准曲线[14]。以原花青素标准溶液浓度X(×0.2 mg/mL)对吸光度Y进行直线回归,得回归方程:Y=0.02X-0.0041,R2=0.999 2。
1.2.3 紫色花椰菜中原花青素提取率的计算

1.2.4 试验设计
(1)单因素试验。以原花青素的提取率为指标,超声波-酶法作为提取方法,准确称取紫色花椰菜粉末1.000 0 g,分别选择加酶量、酶解温度、酶解时间、超声波功率和超声时间5个因素作为影响紫色花椰菜原花青素提取的单因素,每组实验平行重复3次,取平均值,分别记录实验数据。①加酶量。利用醋酸-醋酸钠缓冲溶液将pH值调至为5,控制酶解温度为40 ℃,酶解时间60 min,超声时间30 min,超声波功率为300 W,加 酶 量 为0.5%、1.0%、1.5%、2.0%、2.5%和3.0%(以紫色花椰菜粉末质量为基准),分别测定不同加酶量下的紫色花椰菜原花青素提取率,确定最佳加酶量。②酶解温度。利用醋酸-醋酸钠缓冲溶液将pH值调至为5,加酶量2.0%,酶解时间60 min,超声时间30 min,超声波功率为300 W,酶解温度为40、45、50、55、60 ℃和65 ℃,分别测定不同酶解温度下的紫色花椰菜原花青素提取率,确定最佳酶解温度。③酶解时间。利用醋酸-醋酸钠缓冲溶液将pH值调至为5,控制加酶量2.0%,酶解温度为40 ℃,超声时间30 min,超声波功率为300 W,酶解时间为20、25、30、35、40 min和45 min,分别测定不同酶解时间下的紫色花椰菜原花青素提取率,确定最佳酶解时间。④超声波功率。利用醋酸-醋酸钠缓冲溶液将pH值调至为5,控制加酶量2.0%,酶解时间60 min,酶解温度为40 ℃,超声时间30 min,超声功率为200、250、300、350、400 W和450 W,分别测定不同超声波功率下的紫色花椰菜原花青素提取率,确定最佳超声波功率。⑤超声波时间。利用醋酸-醋酸钠缓冲溶液将pH值调至为5,控制加酶量2.0%,酶解时间60 min,酶解温度为40 ℃,超声波功率为300 W,超声波时间为10、15、20、25、30 min和35 min,分别测定不同超声波时间下的紫色花椰菜原花青素提取率,确定最佳超声时间。
(2)Box-Behnken响应面优化试验。通过单因素试验的结果,结合Box-Behnken的中心组合试验设计原理选取加酶量、超声波功率、超声波时间3个变量采用响应面分析法对其进行优化,以原花青素提取率为考察值,设计三因素三水平的响应面试验。试验因素与水平见表1。

表1 超声波-酶法辅助提取紫色花椰菜原花青素的响应面分析水平及因素表
1.3 数据处理
选择对紫色花椰菜原花青素提取率影响较大的加酶量、超声波功率、超声波时间3个因素进行统计分析,利用响应面分析软件design-expert8.0对试验数据进行处理,用Excel软件绘图。
2 结果与分析
2.1 原花青素标准曲线的绘制及其回归方程
配制原花青素标准溶液,浓度为0.2 mg/mL,选择最大吸收波长。经试验,最大吸收波长为500 nm,用紫外分光光度计分别测定梯度浓度下原花青素标准品溶液的吸光度,以原花青素浓度为横坐标,吸光度为纵坐标,绘制原花青素的标准曲线,如图1所示。可知,原花青素浓度-吸光度标准曲线回归方程为:

图1 原花青素溶液浓度的标准曲线图
2.2 单因素实验
2.2.1 加酶量对紫色花椰菜原花青素提取率的影响
由图2可知,加酶量增加,原花青素提取率逐渐增大,这是因为加酶量较低时,纤维素酶能够全部参与反应,处于酶反应动力学初级阶段[15],所以随着加酶量的增加,提取率增大且增大速率较快。当加酶量再继续增加时,原花青素提取率增加速度变缓慢,因为纤维素酶作用的底物的量是一定的,当反应完全,即底物被酶充分作用,被几乎彻底分解,反而继续增加酶的用量不会使原花青素释放量增加[16]。因此,纤维素酶的加入量选取2%较为适宜。

图2 加酶量对紫色花椰菜原花青素提取率的影响图
2.2.2 酶解温度对紫色花椰菜原花青素提取率的影响
由图3可知,随着酶解温度的增加,原花青素提取率先升高后下降,在温度50 ℃左右时,提取率最大,温度继续增加,原花青素提取率迅速降低,原因是高温可使酶失活,温度不断升高影响了酶的活性,削弱了酶促反应的进行,故最佳酶解温度为50 ℃。
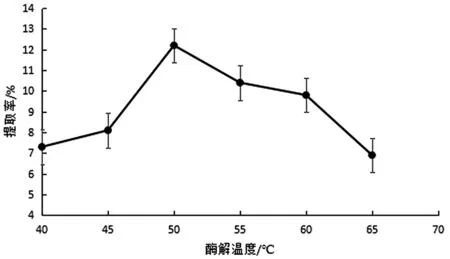
图3 酶解温度对紫色花椰菜原花青素提取率的影响图
2.2.3 酶解时间对紫色花椰菜原花青素提取率的影响
由图4可知,随着酶解时间的增加,紫色花椰菜原花青素的提取率逐渐升高,原因是酶解时间20 min时未被纤维素酶水解的底物较多,反应进行不完全,但随着时间增加,40 min后原花青素提取率不再明显升高反而在45 min时略有下降,所以最佳酶解时间为40 min。

图4 酶解时间对紫色花椰菜原花青素提取率的影响图
2.2.4 超声波功率对紫色花椰菜原花青素提取率的影响
由图5可知,随着超声波功率的增加,提取率增大,当超声波功率为300 W时,原花青素提取率达到最大值13.27%。功率超过300 W并且继续升高时,提取率呈略明显的下降趋势,主要是因为伴随着功率的加大,温度会逐渐上升,高温导致紫花菜粉末糊化,变性的菜粉原花青素也受到损伤[17],所以直接影响试验结果,故最佳超声波功率为300 W。

图5 超声波功率对紫色花椰菜原花青素提取率的影响图
2.2.5 超声波时间对紫色花椰菜原花青素提取率的影响
由图6可知,在10~25 min期间,提取率随时间增长而逐渐提高,主要是因为超声时间延长,超声波对底物的作用增强,加速目标产物从底物中分离出来的速率。当超声时间超过25 min并继续延长时,提取率由高逐渐降低。原因是由于过度的超声处理,导致产物结构发生变化[18],进而导致了提取率的降低。故最佳超声时间为25 min。

图6 超声波时间对紫色花椰菜原花青素提取率的影响图
2.3 利用超声波-酶法对紫色花椰菜原花青素提取的响应面设计实验
2.3.1 响应面试验结果
利用Box-Behnken对加酶量(X1)、超声波功率(X2)、超声波时间(X3)3个影响因素进行三因素三水平的中心组合试验设计,试验结果见表2,方差分析见表3。

表2 超声波-酶法提取紫色花椰菜原花青素的响应面设计及试验结果表

表3 超声波-酶法提取紫色花椰菜原花青素回归方程的方差分析表
2.3.2 回归方程的建立
对表2试验数据进行回归分析,利用Designexpert8.0。得到X1,X2,X3三因素对超声波-酶法提取紫色花椰菜原花青素提取率的二次多项回归方程:
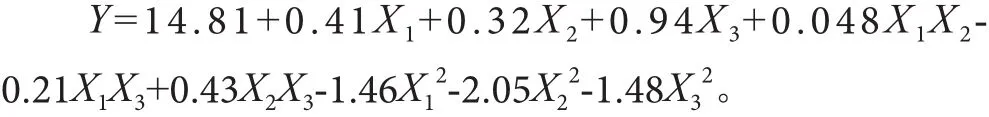
由表3可知,回归模型P<0.0001,说明二次回归方程模型差异极显著。模型的相关系数R2=0.912 1,校正决定系数=0.984 5,说明模型实际值与预测值拟合较好,失拟项P=5.10>0.05,表明失拟不显著,试验误差较小。因此该模型可以用于紫色花椰菜原花青素提取率的分析和检测。
2.3.3 双因素交互作用
(1)加酶量和超声波功率的交互作用。由图7的响应面图和等高线图可知,随着加酶量和超声波功率的加大,原花青素的提取率呈现先增后减的趋势,响应曲面的坡度倾斜较大,说明这两个因素的交互作用显著[19],当加酶量在2%左右、超声波功率为300 W左右时原花青素提取率较高。
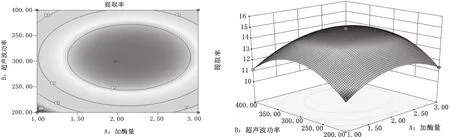
图7 加酶量和超声波功率的交互作用对提取率的影响图
(2)加酶量和超声波时间的交互作用。由图8可知,加酶量越大、超声波时间越长,原花青素的提取率先增大后减小,响应面图的曲面坡度较为平缓,说明这两者的交互效应较为显著,但没有加酶量和超声波功率的交互作用明显。

图8 加酶量和超声波时间的交互作用对提取率的影响图
(3)超声波功率和超声波时间的交互作用。由图9等高线图的形状可知,图形接近于圆形,超声波功率与超声波时间的交互作用对提取率的影响不显著。从响应面图的曲线变化趋势看,超声波时间对原花青素提取率的影响大于超声波功率。
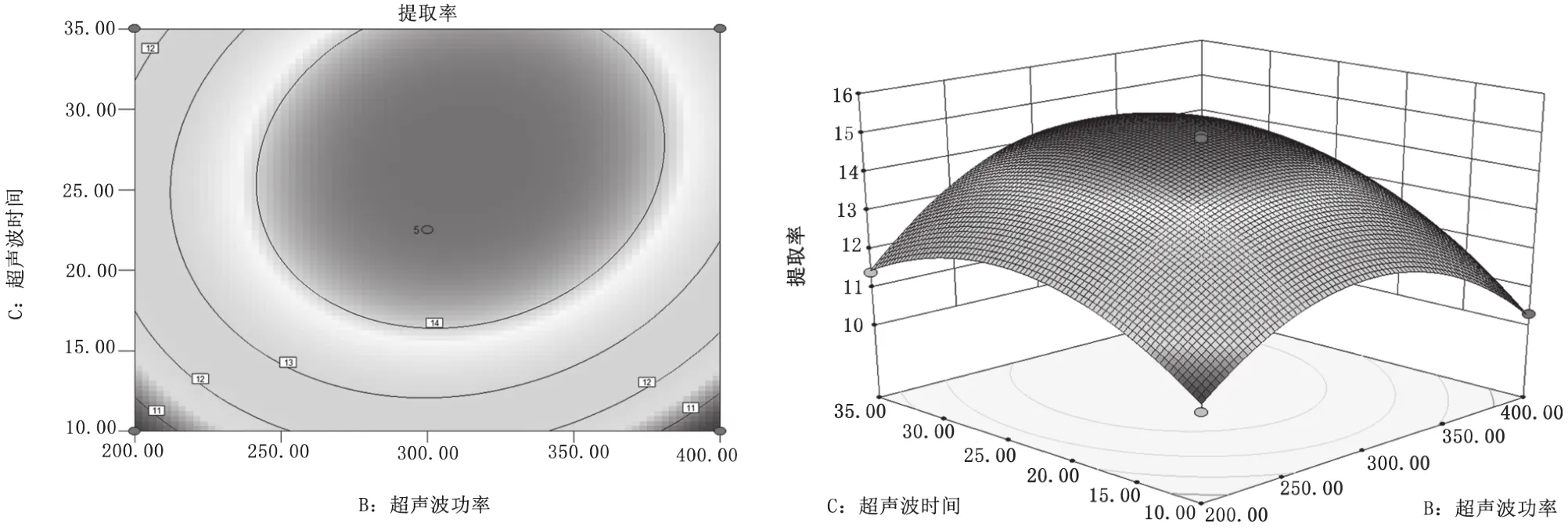
图9 超声波功率和超声波时间的交互作用对提取率的影响图
2.3.4 最佳工艺条件的确定及验证
利用Design Expert 8.0对回归方程进行分析可知,在加酶量为2.08%,超声波功率为316.63 W,超声波时间为25.86 min时,即为超声波-酶法提取紫色花椰菜原花青素的最佳工艺条件,按照以上条件参数进行3次平行试验以验证试验结果,其提取率的实测值为14.36%。该值落在响应值14.9877%的95%预测区间[14.231%,15.792%]内,表明所建回归模型可以较好地反映紫色花椰菜原花青素提取的最佳条件。
3 讨论与结论
本试验提取紫色花椰菜中原花青素,是通过超声波与纤维素酶协同作用的方法,再利用 Box-Behnken响应面法对提取条件的参数进行优化,最终确定最佳工艺条件:加酶量2.08%,超声波功率316.63 W,超声波时间25.86 min,此条件下的紫色花椰菜原花青素提取率为14.36%,与鲍晓亮等用超声波协同微波方法提取相比(提取率2.411%),提取率得到较大程度的提升,而且加入纤维素酶使提取缩短了处理时间、节省了溶剂用量,综上测试结果表明,超声波协同纤维素酶法提取紫色花椰菜原花青素,是一种较为理想的提取原花青素的方法。
[1]佚 名.台湾培育出新品紫色花椰菜[J].蔬菜,2014(1):77.
[2]高 宇.红椰菜栽培技术[J].现代农业,2012(3):12-13.
[3]李利锋.高硒茎花椰菜可防止结肠癌[J].农业科技通讯,2001(11):39.
[4]栾 娜,刘 行.超声波辅助提取紫甘蓝原花青素工艺的优化[J].安徽农业科学,2012,40(30):14651-14653.
[5]孙晓薇,李丽丽,王 涵,等.微波辅助提取落叶松树皮原花青素及其条件优化[J].食品工业,2015(1):35-38.
[6]薛昆鹏,颜流水,赖文强,等.超声微波酶解协同提取油茶壳中原花青素[J].化学研究与应用,2012(8):1295-1299.
[7]李 超,王卫东.原花青素提取方法的研究进展[J].粮油加工,2009(9):145-148.
[8]王 萍,苗 雨.酶法提取黑加仑果渣花色苷的研究[J].林产化学与工业,2008(1):113-118.
[9]Jitendra Kumar S, Patel A K, Adsul M,et al. Cellulase adsorption on lignin:A roadblock for economic hydrolysis of biomass[J]. Renewable Energy,2016,98:29-42.
[10]Richard M W, Thomas H T, James P M.Drying method and origin of standard affect condensed tannin (CT) concentrations in perennial herbaceous legumes using simplified butanol-HCl CT analysis [J].Journal of The Science of Food and Agriculture, 2008,88(6):1060-1067.
[11]杨依姗,李春美,陈美红.香草醛-硫酸法测定柿子单宁含量条件的优化[J].食品科技,2010,35(12):267-272.
[12]Yanagida A, Kanda T, Shoji T, et al.Fractionation of apple procyanidins by sizeexclusion chromatography.[J]. Journal of Chromatography A,1999,855(1):181-190.
[13]李春阳,许时婴,王 璋.香草醛-盐酸法测定葡萄籽梗中原花青素含量的研究[J].食品科学,2004,25(2):157-161.
[14]秦永剑,张加研,万永燕.纤维素酶辅助提取油菜籽皮中的原花青素[J].生物技术,2012,8(2):4-6.
[15]吴 春,张 艳.纤维素酶法提取葡萄籽中原花青素的研究[J].食品科学,2006,27(10):258.
[16]秦 菲,刘 蕊,王 龙.超声波辅助提取山竹果皮中的原花青素[J].食品与发酵工业,2012,38(7):157-160.
[17]耿敬章,秦公伟,张志健.超声波辅助提取樱桃中原花青素[J].中国食品添加剂,2010(4):183-187.
[18]郭希娟,马 萍,张桂芳.响应面法在可溶性膳食纤维超声提取中的应用[J].中国食品学报,2012,12(3):104-111.
[19]刘振春,鲍晓亮.超声波协同微波提取黑米原花青素的工艺研究[J].当代生态农业,2013(z1):66-73.
