免疫基因稀有变异与精神分裂症相关性☆
2018-06-06向波杨振兴喻明兰赵连生王英成李涛王强
向波 杨振兴 喻明兰 赵连生 王英成 李涛◎ 王强
精神分裂症终身患病率为1%[1]。研究发现该病的遗传度高达80%[2]。虽然具有高度遗传性,但其病理生理机制至今仍不明确。近年来,全基因组 关 联 分 析 (genome-wide association study,GWAS)发现许多单核苷酸多态性 (single nucleotide polymorphism,SNP)与精神分裂症易感风险相关[3],但它们只能解释表型变异的小部分[4]。越来越多的证据表明,少见(最小等位基因频率,minor allele frequency,MAF:1% ~5% ) 和 罕 见(MAF<1%)稀有变异在复杂性疾病的发生发展中起着重要作用(宏效应),可能弥补丢失的遗传性,如多中心大样本的欧洲人群全基因组外显子测序研究发现,特定生物通路稀有变异累积与精神分裂症相关[5]。因此,本研究将对中国人群精神分裂症患者和正常对照进行全基因组外显子测序,以探究免疫基因稀有变异累积与精神分裂症病因学的相关性。
1 对象与方法
1.1 研究对象患者组为四川大学华西医院心理卫生中心门诊或住院精神分裂症患者。入组标准:①由2名精神科医师诊断,符合《美国精神障碍诊断与统计手册(第4版)》精神分裂症诊断标准;②未曾服用过任何抗精神病药物、抗抑郁药、苯二氮类或其他影响中枢神经系统的药物,即为首发精神分裂症患者;③汉族。排除标准:①明确患有中枢神经系统疾病;②有物质滥用史;③有严重过敏史。对照组为成都市以及周边地区招募的志愿者。入组标准:①无精神疾病和神经系统疾病;②无精神疾病家族史;②汉族。排除标准同患者组。患者共入组94例,其中男46例,女48例;年龄(23.94±6.92)岁;受教育年限(12.79±3.15)年。对照共入组134名,其中男71名,女63名;年龄(24.39±10.95)岁;受教育年限(13.5±2.89)年。 两组在年龄、性别和教育年限之间差异无统计学意义(P>0.05)。本研究通过四川大学医学伦理委员会批准。入组前所有受试者或其监护人同意并签署知情同意书。
1.2研究方法
1.2.1 DNA获取 抽取受试者的外周血5~10 mL,加入EDTA抗凝,苯酚—氯仿法提取基因组DNA。
1.2.2 全基因组外显子捕获及测序 对234名受试者DNA随机打断,将片段化的DNA分子在酶的作用下补齐黏性末端而成为平末端,连接接头,通过外显子序列捕获芯片捕获目标外显子区域,然后对捕获的目标片段进行PCR扩增,末端补平及加“A”碱基,连接测序接头,最后应用 Illumina Hiseq 2000进行全外显子测序。
1.2.3 全外显子测序数据预处理 目标区域捕获测序,原始数据经过标签拆分后获得各个样本的原始序列,去除测序数据中的接头和低质量数据,运用 BWA 软件(http://bio-bwa.sourceforge.net/)比对到参考基因组上,采用GATK软件(https://software.broadinstitute.org/gatk/)对各个样本的比对数据进行多态性位点的检测,对单核苷酸变异(single nucleotide variation,SNV)和插入缺失突变(insertions and deletions,Indels)等数据进行统计和分析(主要参考dbSNP和hg19)。同时对每名受试者的测序深度、覆盖区域等数据进行统计,并采用Wilcoxon秩和检验方法进行组间比较。
1.2.4 免疫通路获取及其统计分析 本研究基于Reactome(http://www.reactome.org/)数据库获取了5个与免疫相关的生物通路(AUTOIMMUNE_THYROID_DISEASE、TRANSLOCATION_OF_ZAP_70_TO_IMMUNOLOGICAL_SYNAPSE、INTESTINA L_IMMUNE_NETWORK_FOR_IGA_PRODUCTION、IMMUNOREGULATORY_INTERACTIONS_BETWE EN_A_LYMPHOID_AND_A_NON_LYMPHOID_CEL L和 PRIMARY_IMMUNODEFICIENCY), 并应用KGGseq软件[6]对前期预处理完的数据进行质量控制(默认参数),以及采用 SKAT软件[7]中 Burden Analysis关联分析探究稀有变异与精神分裂症之间的关系 (主要对Gene-based和候选的5个免疫通路进行分析)。本研究也基于gsea4 gwas-v2(http://gsea4 gwas-v2.psych.ac.cn/) 软件探究Gene-based结果中有统计学意义的基因(P<0.05)所参与的生物通路。
2 结果
2.1 测序结果外显子富集后每名个体可以获取大约7.6 Gb的数据纳入后续分析,靶向大约34.60 Mb的外显子区域以及侧翼(flanking)区域。运用Burrows-Wheeler Aligner软件可以将99.75%的末端配对阅读框比对到参考基因组序列hg19。另外,为确保更高的检测灵敏度,88.60%的靶向捕获外显子区域被至少10×的高质量基因型覆盖,并且在患者组和对照组之间,大于1×(P=0.08)和大于10×(P=0.33)测序覆盖度差异没有统计学意义。见表1。

表1 外显子测序的数据汇总
2.2免疫通路稀有变异与精神分裂症相关分析对234名受试者外显子测序数据进行质量控制和多态性检测,有6名受试者由于质量偏低或污染而被排除(3名精神分裂症患者和3名对照)。当MAF≤1%时,Gene-based分析发现TYK2基因中有22个稀有变异在精神分裂症患者中高富集(P<0.001),同时也发现有统计学意义(P<0.05)的基因参与了 2个生物通路:Disease(P=0.034)和Adaptive Immune System (P=0.021),见表 2。当MAF≤1%时,也发现2个免疫通路中稀有突变在精神分裂症中高富集:AUTOIMMUNE_THYROID_DISEASE(P=0.001)和 TRANSLOCATION_OF_ZAP_70_TO_IMMUNOLOGICAL_SYNAPSE(P=0.016),见表 3。
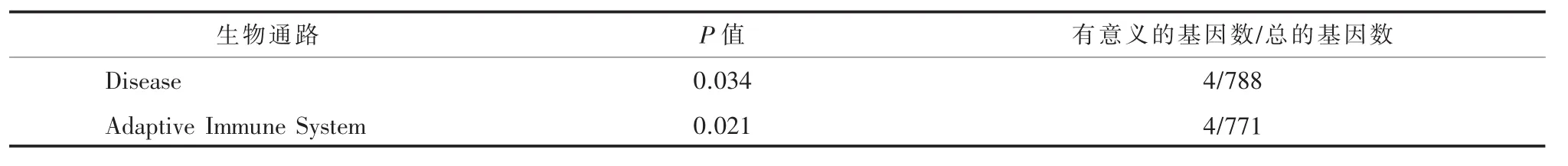
表2 Gene-based分析结果中有统计学意义基因参与的生物通路

表3 5个候选免疫通路及其分析结果
3 讨论
本研究通过对精神分裂症全基因组外显子进行测序,探究免疫通路中稀有变异累积与精神分裂症发病机制之间的关系,发现了2个免疫通路AUTOIMMUNE_THYROID_DISEASE和TRANSLO CATION_OF_ZAP_70_TO_IMMUNOLOGICAL_SYN APSE与精神分裂症相关。
自身免疫性甲状腺病 (autoimmune thyroid disease,AITD)是一组以甲状腺为靶器官的自身免疫性疾病,可影响全身多个系统。其发病率在7%~8%[8]。该病主要包括Graves病、Graves眼病和自身免疫性甲状腺功能减退 (autoimmune hypothyroidism,AIH)。AITD的发病机制复杂,可能与多个因素共同作用有关,如遗传因素、细胞因子[9]、细胞凋亡[10]以及微量元素等。已有研究显示AITD和精神分裂症可能存在共同的病理基础,如HAMMOND等[11]发现小病毒B19感染大脑可能引起AITD和精神分裂症,以及一些研究发现精神分裂症患者常伴有AITD[12]。
ZAP-70是一种胞内酪氨酸激酶,主要表达于T细胞。研究发现ZAP-70缺失的患者外周血中没有功能性T细胞,常伴有严重联合免疫缺陷[13]。动物实验也发现ZAP-70在CD8+T细胞中起着重要作用[14],并且已有研究报道CD8+T细胞与精神分裂症的病理机制相关[15]。ABERG等[16]对11185例精神分裂症患者和10768名正常对照进行分析,发现 TRANSLOCATION_OF_ZAP_70_TO_IMMUNOLOGICAL_SYNAPSE通路与精神分裂症相关,也进一步显示出该通路中常见/稀有变异累积在精神分裂症发病机制中起着重要的作用。
通过Gene-based分析,本研究发现P值最小的基因TYK2,该基因编码一种TYK2激酶,该激酶是JAK家族成员之一[17]。已有研究报道该基因与神经元[18]、细胞因子[19]以及精神分裂症[20]相关。DEBNATH等[21]的研究也报道了适应性免疫系统(adaptive immune system)与精神分裂症病理机制相关。
虽然本研究采用全基因组外显子测序技术发现免疫通路与精神分裂症相关,但也存在一些不足:首先,没有得到全基因组效能的基因,最主要的原因是样本量偏小,需要在后续的研究中扩大样本量进一步验证;其次,缺少不同种族人群独立样本的验证。
综上所述,本研究基于全基因组外显子测序和生物通路分析方法,发现2个免疫通路与精神分裂症病理生理机制相关,同时也需要在后续的大样本研究中进一步验证该结果,为精神分裂症的分子机制研究提供理论基础。
[1]GOTTESMAN II,MCGUFFIN P,FARMER AE.Clinical genetics as clues to the “real” genetics of schizophrenia (a decade of modest gainswhile playing for time) [J].Schizophr Bull,1987,13(1):23-48.
[2]TSUANG M.Schizophrenia:genes and environment[J].Biol psychiat,2000,47(3):210-220.
[3]MACARTHUR J,EBOWLER,GEREZO M,et al.The new NHGRI-EBI Catalog of published genome-wide association studies (GWAS Catalog) [J].Nucleic acids Res,2016,45(D1):D896-D901.
[4]李康,许瑞环,张洪德,等.定量计算已知易感变异对精神分裂症遗传度的解释度[J].中国神经精神疾病杂志,2014,40(8):449-453.
[5]PURCELLS M,MORAN JL,FROMER M,et al.A polygenic burden of rare disruptivemutations in schizophrenia[J].Nature,2014,506(7487):185-90.
[6]LIMX,GUIHS,KWAN JS,et al.A comprehensive framework for prioritizing variants in exome sequencing studies of Mendelian diseases[J].Nucleic Acids Res,2012,40(7):e53.
[7]IONITA-LAZA I,LEE S,MAKAROV V,et al.Sequence kernel association tests for the combined effect of rare and common variants[J].Am JHum Genet,2013,92(6):841-853.
[8]DAYAN CM,DANIELS GH.Chronic autoimmune thyroiditis[J].New Engl JMed,1996,335(2):99-107.
[9]TAYDE PS,BHAGWAT NM,SHARMA P,et al.Hypothyroidism and depression:Are cytokines the link? [J].Indian J Endocrinol Metab,2017,21(6):886.
[10]INOUE N,WATANABE M,ISHIDO N,et al.Involvement of genes encoding apoptosis regulatory factors (FAS,FASL,TRAIL,BCL2,TNFR1 and TNFR2)in the pathogenesis of autoimmune thyroid diseases [J].Hum immunol,2016,77 (10):944-951.
[11]HAMMOND CJ,HOBBS JA.Parvovirus B19 infection of brain:possible role of gender in determining mental illness and autoimmune thyroid disorders[J].Med Hypotheses,2007,69(1):113-116.
[12]RADHAKRISHNAN R,CALVIN S,SINGH JK,et al.Thyroid dysfunction in major psychiatric disorders in a hospital based sample[J].Indian JMed Res,2013,138(6):888.
[13]AU-YEUNG BB,SHAH NH,SHEN L,et al.ZAP-70 in signaling,biology,and disease [J].Annu Rev Immunol,2018,36:127-156..
[14]WALKOVICH K,VANDER LUGT M.ZAP70-Related Combined Immunodeficiency [M].Seattle (WA):University of Washington,Seattle,2017.
[15]BHADRA R,COBB CA,WEISSLM,et al.Psychiatric disorders in toxoplasma seropositive patients--the CD8 connection[J].Schizophr Bull,2013,39(3):485-489.
[16]ABERG KA,LIU Y,BUKSZAR J,et al.A comprehensive family-based replication study of schizophrenia genes [J].JAMA Psychiatry,2013,70(6):573-581.
[17]STARK GR,KERR IM,WILLIAMS BR,et al.How cells respond to interferons [J].Annu Rev Biochem,1998,67 (1):227-264.
[18]BIEBER AJ,SUWANSRINON L,Kerkvliet J,et al.Allelic variation in the Tyk2 and EGF genes as potential genetic determinants of CNS repair[J].Proc Natl Acad Sci USA,2010,107(2):792-797.
[19]BERG J,ZSCHEPPANG K,FATYKHOWN D,et al.Tyk2 as a target for immune regulation in human viral/bacterial pneumonia[J].Eur Respir J,2017,50(1):1601953.
[20]YIN X,LIN Y,SHEN C,et al.Integration of expression quantitative trait loci and pleiotropy identifies a novel psoriasis susceptibility gene,PTPN1[J].JGene Med,2017,19(1-2):1.
[21]DEBNATH M.Adaptive immunity in schizophrenia:functional implications of T cells in the etiology,course and treatment[J].JNeuroimmune Pharm,2015,10(4):610-619.
