超高压对草鱼肌原纤维蛋白结构的影响
2018-06-05闫春子夏文水许艳顺
闫春子, 夏文水, 许艳顺
(江南大学 食品学院,江苏 无锡 214122)
草鱼是重要的经济淡水鱼,其肌原纤维蛋白占主要肌肉蛋白质量的55%~65%。因此,了解肌原纤维蛋白结构变化对控制产品品质有着重要意义。
超高压技术是一种新兴的非热加工技术手段,物料经过一定的压力处理后,其微生物大部分被杀灭,内源酶大部分被灭活。相比加热杀菌,超高压处理可较大幅度地保留食品原有的营养和风味[1],因此,超高压技术已经作为商业保鲜手段被应用。近来,有报道表明,超高压处理对蛋白结构有很大影响[2],蛋白结构的变化又会影响鱼肉品质的变化。但是关于超高压对草鱼肉肌原纤维蛋白结构方面的影响却鲜有报道。作者以草鱼为原料,研究超高压处理对草鱼片肌原纤维蛋白结构的影响,包括总巯基和活性巯基、Ca2+-ATPase、表面疏水性、内源荧光光谱、以及拉曼光谱分析,为超高压技术在淡水鱼加工保鲜中的应用提供一定的理论基础。
1 材料与方法
1.1 材料
草鱼:市售。
1.2 设备
UHPF-600 MPa-50 L型超高压处理设备:包头科发食品机械有限公司产品;F-7000型荧光光谱仪:日本日立公司产品;RamTracer-200-HS型拉曼光谱仪:美国OptoTrace Technologies公司产品;精密电子天平:梅特勒-托利多仪器(上海)有限公司产品;4K-15型高速冷冻离心机:美国Sigma Sartorius公司产品;D-8941型真空包装机:Multivac公司产品;实验室用pH计 FE20:梅特勒-托利多仪器有限公司(上海)产品;紫外-可见分光光度计:上海天美科学仪器有限公司产品。
1.3 方法
1.3.1 样品预处理 将草鱼宰杀去内脏、鱼头、鱼皮,用蒸馏水冲洗干净,取背部鱼肉作为研究对象,切成约3 cm×3 cm×1 cm方块,于蒸煮袋真空密封好后用超高压设备进行处理,压力分别为200、300、400、500、600 MPa,保压时间为 15 min。 未经处理组记为0.1MPa,作为对照组。超高压后所有样品,在两小时内完成蛋白提取,并进行结构测定。
1.3.2 肌原纤维蛋白的提取 制备方法参照Lina R[3]的方法,并略作修改。取适量经过不同超高压处理的草鱼肉,加入5倍体积缓冲液(pH 7.0),混匀,9 000 r/min 4℃离心10 min,弃去上清液,重复上述操作2次。沉淀加入4倍体积缓冲液,10 000 r/min匀浆。静置30 min以充分溶解蛋白,9 000 r/min 4℃离心20 min,所得上清液即为肌原纤维蛋白溶液。肌原纤维蛋白浓度的测定采用双缩脲法测定,以牛血清白蛋白(BSA)作为标准蛋白。
1.3.3 总巯基和活性巯基含量测定 参考Yongsawatdigul[4]等的方法,并略作修改。用 0.6 mol/L KCl溶液将肌原纤维蛋白稀释到 2 mg/mL左右,取1 mL加入4 mL 50 mmol/L磷酸缓冲液。混匀,取 4 mL溶液,加入0.4 mL Tris-HCl缓冲液,40℃水浴 25 min。以0.6 mol/L KCl溶液作为空白,在紫外分光光度计412 nm处测定吸光值。
1.3.4 Ca2+-ATPase活性测定 用0.6 mol/L KCl溶液将肌原纤维蛋白溶液稀释到4.0~6.0 mg/mL左右。然后取1 mL蛋白溶液,分别加入0.5 mL 0.5mol/L pH 7.0 Tris-HCl缓冲液、0.5 mL 0.1 mol/L CaCl2、1 mL 1 mol/L KCl溶液、6.5 mL 去离子水,最后加入20 mmol/L ATP溶液。置于25℃水浴预热10 min,之后加入肌原纤维悬浊液,摇匀,等到加入20 mmol/L ATP溶液的时候开始记时,反应5 min后在反应体系中加入2.5 mL冰浴后的体积分数15%的三氯乙酸(TCA)溶液终止反应。另一组预先加入TCA溶液作为空白对照。反应结束后,将所得溶液离心(3 500 g,10 min),采用钼酸铵法测定上清液中释放的无机磷含量。
1.3.5 表面疏水性分析 参考Riebroya[5]等的方法测定其荧光强度,激发波长370.0 nm,发射波长480.0 nm。空白用氯化钾缓冲液替代。
1.3.6 内源荧光测定 把肌原纤维蛋白溶液用0.6mol/L KCl溶液稀释到0.05 mol/mL,选取激发波长295 nm,激发和发射狭缝宽度为2.5 nm,波长扫描范围为300~400 nm,扫描速度为12 000 nm/min,每个样品做3次平行。
1.3.7 拉曼光谱分析 拉曼光谱用 RamTracer®-200-HS便携式拉曼仪测量,激发波长785 nm,扫描范围100~3 300 cm-1,光谱分辨率 6 cm-1。
1.3.8 数据处理 数据结果采用Origin 9.1进行分析处理。
2 结果与讨论
2.1 总巯基和活性巯基含量的变化
肌原纤维蛋白分子约含有42个巯基,其中分布在球状头部结构的约有24或者26个,反应活性很强,是肌原纤维蛋白活性的重要组成部分。因此可以根据蛋白质巯基的含量变化情况进而预测蛋白质的变性程度[3]。
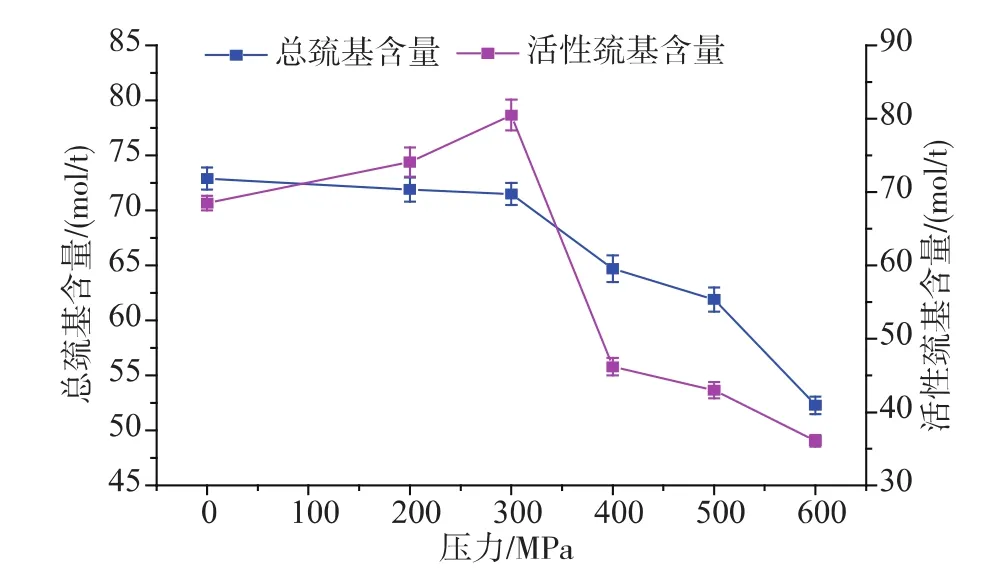
图1 不同压力处理后草鱼肌原纤维蛋白总巯基和活性巯基变化Fig.1 Changes in total sulfhydryl content and surfacereactive sulfhydryl content activity of myofibrilproteinof grass carp subjected to different high pressure processing
由图1可以看出,经过超高压处理过的草鱼片,肌原纤维蛋白总巯基含量随着压力的增大呈现减小的趋势,而活性巯基随着压力的增大呈现先增大后下降的趋势。在300 MPa时达到最大值,这与Hormann[6]和Chapleau[7]得到的结果一致。这是由于超高压处理之后,肌原纤维蛋白的活性位点发生变化或者移动,导致蛋白质分子发生变性从而展开,隐藏在蛋白结构内部的残基、巯基开始逐渐暴露于蛋白表面,并且随着压力的升高,巯基暴露逐渐增多,300 MPa处理后达到最大,而当压力继续升高时,蛋白质分子结构因为聚集而变得更加紧密,导致活性巯基含量减少[8]。此外,暴露于表面的巯基易于氧化生成二硫键,从而进一步导致总巯基含量的下降。
2.2 表面疏水性的变化
肌原纤维蛋白质的表面疏水性反映的是蛋白质分子表面的疏水性残基的相对含量,其变化可以表明蛋白质的表面性质发生改变,因此可作为蛋白质结构改变的表征指标。超高压对蛋白质空间结构的改变对疏水性氨基酸残基在蛋白质分子内外的分配产生影响,当肌原纤维蛋白分子发生变性时,内部的疏水性氨基酸暴露于表面,能与ANS(1-苯氨基萘-8-磺酸)探针结合呈现荧光,且肌原纤维蛋白的相对荧光强度与其表面疏水性成正相关[9]。
不同的超高压处理对草鱼肌原纤维蛋白表面疏水性的影响见图2,从图中可以看出,随着压力的不断增大,表面疏水性一直呈现上升的趋势,200~600 MPa处理后表面疏水性值分别上升了11%、55%、73%、76%、82%。主要的原因是超高压处理改变了肌原纤维蛋白的空间构型。
新鲜的草鱼肉蛋白质的疏水性基团大多位于蛋白质分子内部,故具有较低的表面疏水性。在蛋白质中具有疏水相互作用的基团为芳香族残基,它们均匀地分布在肌球蛋白分子尾部,包埋于α-双螺旋之间的界面内。
经过超高压处理之后,折叠态的肌原纤维蛋白分子开始伸展,位于蛋白质分子内部的部分疏水性基团外露,引起蛋白质分子表面疏水性的上升(见图2)。随着压力的逐步增大,疏水性基团外露的越来越多,导致疏水相互作用增强,同时这些疏水性残基就会重新分布,有更多的残基暴露于蛋白表面,从而表面疏水性增加[7]。
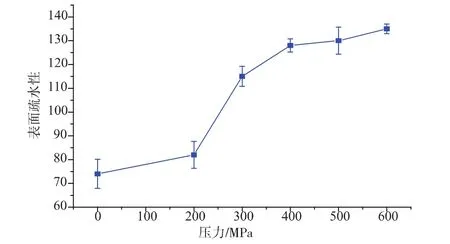
图2 不同压力处理后草鱼肌原纤维蛋白表面疏水性的变化Fig.2 Changes in surface hydrophobicityof myofibril protein of grass carp subjected to different high pressure processing
2.3 Ca2+-ATPase活性的变化
Ca2+-ATPase活性源于肌原纤维蛋白的球状头部结构,其活性与头部区域紧密相关,是分析蛋白质品质的重要指标[11]。
图3为不同压力处理对肌原纤维蛋白Ca2+-ATPase活性的影响,由图可以看出,随着压力的增大,Ca2+-ATPase的活性呈现一直下降的趋势。经200 MPa处理,Ca2+-ATPase的活性由对照组的0.52 μmol/(mg·min)降低至 0.46 μmol/(mg·min),其活性下降12%,当压力超过200 MPa时,Caμ-ATPase的失活速度逐渐加快,该研究结果同KO[10]等人一致。300 MPa以上的超高压处理可以明显降低Ca2+-ATPaes的活性,由图 3 分析可知,300、400、500、600 MPa分别降低了27%、63%、79%、85%,随着压力的增大,其活性显著下降。其中600 MPa处理下降的最为明显。雒莎莎等人研究显示,超高压处理明显抑制了肌球蛋白Ca2+-ATPase的活性,当压力≥150 MPa时,Ca2+-ATPase的失活速度明显加快。另外,总巯基含量的减少,导致蛋白分子内作用加强,会加剧Ca2+-ATPase的活性下降。
Ca2+-ATPase活性的降低表明超高压能够诱导肌原纤维蛋白头部变性,在相对较低的压力下,肌原纤维蛋白(粗丝的主要成分)就开始聚集,两个头部S1和S2首先融合成一个,接着它们聚集成一簇,尾部呈放射状的伸在外面。肌球蛋白分子的聚集不断增加,蛋白质的疏水性上升,这是因为超高压作用使肌球蛋白头部的疏水基团暴露出来,使肌球蛋白头部间的疏水作用加强,从而导致肌原纤维蛋白聚集[11]。
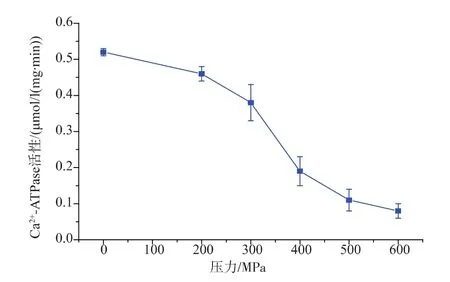
图3 不同压力处理后草鱼肌原纤维蛋白Ca2+-ATPase活性的变化Fig.3 Changes in Ca2+-ATPase activity of myofibril protein of grass carp subjected to different high pressure processing
2.4 内源荧光光谱分析
超高压处理会引起蛋白构象的改变,甚至引起蛋白质分子变性。在此过程中,部分氨基酸中的内源荧光生色基团的微环境和位置会发生相应的改变,因此,研究内源荧光光谱是监测超高压处理对蛋白质构象影响的有效手段。内源荧光分析的主要是色氨酸(Trp)残基,在295 nm处可只激发色氨酸残基,从而可以排除酪氨酸残基的干扰。图4为不同压力处理后得到的内源荧光光谱图,从图4中可以看出,在压力的作用下,肌原纤维蛋白的荧光光谱形状变化不明显,而对最大峰值以及强度的变化较为明显。肌原纤维蛋白的λmax集中在336 nm附近。有研究学者研究表明,λmax与色氨酸残基所处的微环境有着一定的关系[12]。λmax<330 nm,表明色氨酸残基位于蛋白质分子内部的非极性环境中。λmax>330 nm,表明色氨酸残基位于蛋白质分子外部的极性环境中。如图中所示,λmax位于336 nm附近,表明色氨酸残基位于蛋白质分子外部的极性环境中。随着压力的不断增大,荧光光谱的荧光强度不断增大,到600 MPa时达到最大。并且,λmax发生了一定的红移现象。这说明色氨酸残基可能是转移到蛋白分子外部,暴露在了极性环境中,而经过超高压处理后,荧光强度不断增强,色氨酸残基都暴露到分子表面极性强的环境中,这表明超高压处理改变了色氨酸的微环境,对肌原纤维蛋白的三级结构产生影响。

图4 不同压力处理后草鱼肌原纤维蛋白內源荧光图Fig.4 Changes inEndogenous fluorescence spectrumof myofibrilprotein ofgrass carp subjected to different high pressure processing
2.5 拉曼光谱分析
拉曼光谱是一种振动光谱技术,具有指纹式的高分辨率,对于分子结构分析有显著作用,是研究蛋白构象的一种重要手段。
经超高压处理后,草鱼片肌原纤维蛋白的拉曼图谱见图5。在拉曼图谱上最突出的谱带位于1 450 cm-1左右区域和1 650 cm-1左右区域,1 450 cm-1左右区域是C-H(CH2)弯曲振动谱带。C-H弯曲振动的谱带强度变化与蛋白质的三级结构的变化相关,其强度减弱表明部分内部疏水性残基的暴露[13]。酰胺I带集中于1 650 cm-1左右区域,常常用来被表征蛋白质二级结构[14]。有研究显示,位于1 600~1 700 cm-1左右的酰胺I带与蛋白骨架构象类型相关:主要来自于C=O伸缩振动和N-H平面弯曲振动。该谱带由位于1 645~1 660 cm-1(α-螺旋),1 665~1 680 cm-1(β-折叠),1 660~1 665 cm-1(无规则卷曲)三部分重叠的谱带构成。
3 结 语
超高压处理导致草鱼肌原纤维蛋白空间构象显著变化。随着压力的增大,Ca2+-ATPase活性、总巯基含量均显著下降,活性巯基先增加后降低。肌原纤维肌球蛋白的球状头部结构在压力作用下展开,疏水集团暴露,二硫键增多,并随着压力的进一步增大,蛋白质出现聚集。内源荧光和拉曼光谱表明,超高压处理改变了肌原纤维蛋白二级、三级结构,导致蛋白质变性。
[1]JIANG Bo,LI Yungao,MIU Ming,et al.Effects of high hydrostatic pressure on activity of enzymes and the mechanisms[J].Journal of Food Science and Biotechnology,2015,34(6):561-568.(in Chinese)
[2]QIU C,XIA W,JIANG Q.Pressure-induced changes of silver carp (Hypophthalmichthys molitrix) myofibrillar protein structure[J].European Food Research and Technology,2014,238(5):753-761.
[3]LINA R,YANSHUN X,QIXING J,et al.Investigation on structural changes of myofibrillar proteins from silver carp(Hypophthalmichthys molitrix) during frozen storage[J].Food Science and Technology Research,2013,19(6):1051-1059.
[4]YONGSAWATDIGUL J,PARK J W.Thermal denaturation and aggregation of threadfin bream actomyosin[J].Food Chemistry,2003,83(3):409-416.
[5]RIEBROY S,BENJAKUL S,VISESSANGUAN W,et al.Acid-induced gelation of natural actomyosin from Atlantic cod(Gadus morhua) and burbot(Lota lota)[J].Food Hydrocolloids,2009,23(1):26-39.
[6]HOFMANN K,HAMM R.Sulfhydryl and disulfide groups in meats[J].Advances in Food Research,1978,24:1-111.
[7]CHAPLEAU N,MANGAVEL C,COMPOINT J P,et al.Effect of high-pressure processing on myofibrillar protein structure[J].Journal of the Science of Food and Agriculture,2004,84(1):66-74.
[8]CHAPLEAU N J,de Lamballerie-Anton M I.Changes in myofibrillar proteins interactions and rheological properties induced by high-pressure processing[J].European Food Research and Technology,2003,216(6):470-476.
[9]CHOI S M,MA C Y.Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J].Food Chemistry,2007,102(1):150-160.
[10]BENJAKUL S,SEYMOUR T A,MORRISSEY M T,et al.Physicochemical changes in Pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62(4):729-733.
[11]KO W C,JAO C L,HSU K C.Effect of hydrostatic pressure on molecular conformation of tilapia (Orechromis niloticus) myosin[J].Journal of Food Science,2003,68(4):1192-1195.
[12]ZHOU A,LIN L,LIANG Y,et al.Physicochemical properties of natural actomyosin from threadfin bream (Nemipterus spp.)induced by high hydrostatic pressure[J].Food Chemistry,2014,156:402-407.
[13]LEFEVRE F,FAUCONNEAU B,THOMPSON J W,et al.Thermal denaturation and aggregation properties of Atlantic salmon myofibrils and myosin from white and red muscles[J].Journal of Agricultural and Food Chemistry,2007,55(12):4761-4770.
[14]LOPES D C F,DELVIVO F M,SILVESTRE M P C.Use of activated carbon for removing phenylalanine from reconstituted skim milk powder hydrolysates[J].LWT-Food Science and Technology,2005,38(5):447-453.
