HPMC的持水性能及其对面包酵母抗冻性的影响
2018-06-05王昕昕刘元法李进伟
王昕昕, 刘元法, 李进伟
(江南大学 食品学院,江苏 无锡214122)
冷冻面团是当今较新的一种面包加工技术,目的是分离面包的制作和焙烤过程,便于实现控制面包的规模化生产和新鲜度,近年在国内发展尤为迅速[1-2]。然而在冷冻面团加工过程中,一方面冰晶的生成和冻藏过程中重结晶现象破坏面筋网络结构和酵母细胞,同时,冻裂酵母释放出的谷胱甘肽会进一步破坏面筋及网络结构[3],从而导致酵母细胞存活率、发酵力和面团的持气能力均会有一定程度降低[4]。因此,在长时间的冻藏条件下,如何提高面包酵母的抗冻能力,以及保持面筋网络结构的完整是目前急需解决的核心问题之一。
羟丙基甲纤维素 (HPMC)是非离子型纤维素醚,相比于离子型纤维素醚,与重金属不发生反应,且具有酸碱稳定性等特点[5],且目前是纤维素醚种类中产量最少,性能最优、用途最为广泛。HPMC由纤维素经碱化和醚化制得,分子中羟基被甲氧基和羟丙基基团按一定比例所取代,由于羟基和羟丙基的亲水性,所以赋予HPMC良好的持水性能。为研究HPMC的持水性能,及其应用于冷冻面团中对可冻结水含量的影响和对面包酵母的抗冻作用。首先对比了质量分数1%的谷氨酸、海藻糖和HPMC溶液的抗冻活性,再将HPMC以不同质量分数添加入面团中,测定比较在冻藏45 d后面团中可冻结水质量分数的变化,最后测定添加谷氨酸、海藻糖和HPMC的酵母菌液在冻藏过程中的酵母细胞存活率(η)随冻藏时间和添加质量分数的变化。
1 材料与方法
1.1 材料与仪器
HPMC:山东赫达股份有限公司产品;高筋小麦粉:益海嘉里(昆山)食品工业有限公司产品。
差示扫描量热仪:美国TA仪器公司产品;多点磁力搅拌器:IKA(广州)仪器设备有限公司产品;显微镜:奥林巴斯有限公司产品产品。
1.2 实验方法
1.2.1 制备HPMC溶液 称取0.5 g不同型号HPMC,各量取50 mL蒸馏水,先将蒸馏水置于多点磁力搅拌器上,80℃加热20 min后,放入转子,转速调至400 r/min,将HPMC粉末缓慢加入,搅拌30min,使其充分溶胀,再将温度调至20℃搅拌30 min,使其形成透明溶液[6]。
1.2.2 抗冻活性的测定 利用差示扫描量热法(DSC)测定HPMC水溶液、谷氨酸溶液、海藻糖溶液(质量分数均为1%)的抗冻活性。先测定3种溶液和蒸馏水的结晶融化焓。在特定铝盒中称取15~20 μg溶液,先于20℃平衡,以5℃/min降温至-25℃,恒温10 min,再以5℃/min升温至30℃,记录冻结水的融化焓(ΔHw)及冻结溶液的融化焓(ΔHA)。
抗冻活性(AF):单位抗冻活性剂(g)在冻结材料中所产生未冻结水的质量(g),计算公式如下[7]:
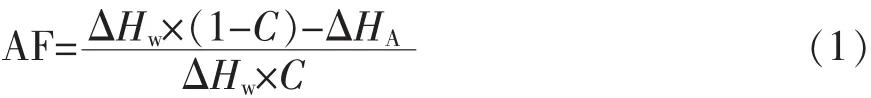
式中:ΔHw为冻结水的融化焓,mJ/mg;ΔHA为冻结溶液的融化焓,mJ/mg;C为溶液中抗冻剂的质量分数。
1.2.3 面团制作 制作面团配方为:高筋面粉500g、盐 7.5 g、水 270 g、HPMC(B400 为例)分别加入(0、0.5、1.5、2.5、3.5、5.0 g),将 HPMC 配制成溶液后再加入和面机中,低速搅拌5 min后高速搅拌2 min,使面筋网络充分形成。将面团静置15 min后,压片至2 mm,以保鲜膜包覆放置-18℃冰箱冻藏备用。
1.2.4 面团中水的可冻结水质量分数测定 利用差示扫描量热法(DSC)测定添加不同浓度HPMC面团[8],在冻藏一定时间后可冻结水的变化。在铝盒中称取15~20 μg面团,先于20℃平衡,以10℃/min降温至-60℃,恒温3 min,再以10℃/min升温至30℃,记录冷冻面团的融化焓(ΔHfw),及冻结水的融化焓(ΔHw)为339.2 mJ/mg,冷冻面团可冻结水质量分数计算公式为[9]:

式中:ΔHfw为冷冻面团的融化焓,mJ/mg;ΔHw为冻结水的融化焓,mJ/mg;Wt为为面团中水的质量分数,%。
1.2.5 酵母菌液的配制 称取10 g活性干酵母,用适量的生理盐水(质量分数0.9%)溶解后,定容至1 000 mL,静置10 h后,取上清液待用。取15 mL上清液配制质量分数0.5%、1%、1.5%、2.0%的谷氨酸、海藻糖的酵母菌液。分别取配制好的酵母菌液10mL于试管(D18×L180 mm)中,每个样重复3次。对于含HPMC的酵母菌液,先以上述同种方法配制200 mL的2%的酵母上清液待用,再以生理盐水分别配制50 mL质量分数1%、2%、3%、4%的HPMC溶液,将配置好的酵母菌液与HPMC溶液各吸取5 mL于试管(D18×L180 mm)中,充分混合搅匀,每个样重复3次。
1.2.6 酵母菌液的冻藏和解冻 将配制好的酵母菌液放入-18℃冰箱冻藏。待测定时取酵母菌液在30℃水浴中解冻15 min后测定其酵母细胞存活率。
1.2.7 酵母细胞存活率的测定 酵母细胞浓度采用血球计数板法测定。测定前,取0.1 mL酵母菌液和0.9 mL美蓝液于试管中,染色10 min[10]。每个样品重复测定3次,取平均值。η(η,%)为血球计数板中活细胞与总细胞数数量之比:
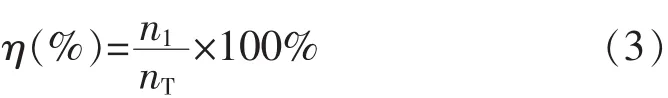
式中:n1为计数板中的活酵母细胞数量;nT为计数板中的酵母细胞总量。
1.3 数据分析
所有测定均重复3次,利用Origin8.5数据处理软件和Excel进行数据分析。
2 结果与讨论
2.1 HPMC对比其他抗冻剂的抗冻活性
纯水和不同溶液结晶融化焓曲线(图1)。冻结溶液的海藻糖、谷氨酸、HPMC添加质量分数均为1%。由图1可以看出,与冻结水、谷氨酸、海藻糖DSC曲线相比,HPMC溶液的融化曲线在最上方,表明冻结溶液结晶融化焓最低,且曲线明显偏右,代表结晶溶液融化温度最高,即HPMC的抗冻活性相比于海藻糖、谷氨酸有明显优势。
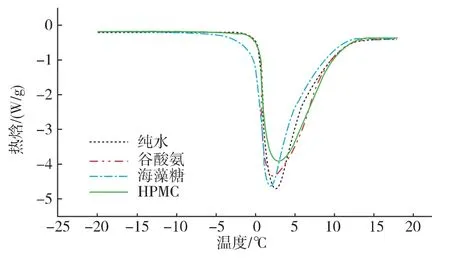
图1 冻结水和冻结溶液DSC曲线Fig.1 DSC curve of different frozen solution
通过对HPMC的取代度、聚合度和粘度值的比较及对不同分子结构HPMC与海藻糖、谷氨酸的抗冻活性进行对比(结果如图2所示),作者发现,A系列的HPMC抗冻活性明显低于B系列,这是由于A系列的HPMC羟丙基取代度较低,而羟丙基作为亲水基团可以与水分子形成分子间氢键,从而束缚部分水分子结晶,可抑制冻藏过程中水分子结晶及重结晶,表征为降低冻结溶液的结晶融化焓,即抗冻活性较强。如A400的AF为 5,B400的AF则为8.79。同时,在相同取代度条件下,不同的聚合度(以粘度表征)对于抗冻活性也有一定的影响,聚合度越大,分子链越长,羟丙基、羟基与水分子结合比例越大,抗冻活性越强,以 A100、A400、A4000为例,随着聚合度提高,AF值由4.19增加至7.76,相比于谷氨酸、海藻糖的AF值为3.98、5.99,HPMC的抗冻活性均有明显优势,后续实验中以B50000为例进行深入研究。
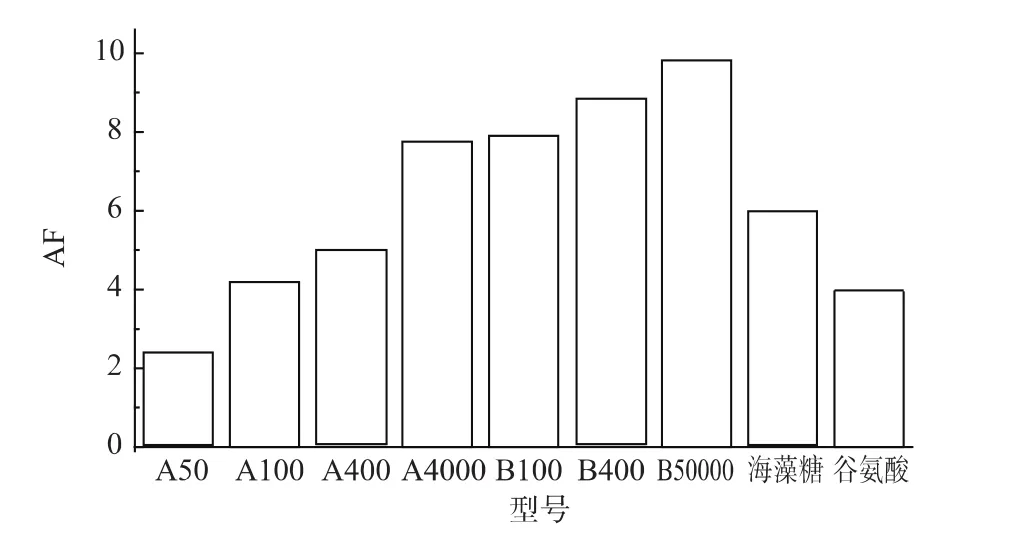
图2 对比海藻糖、谷氨酸、HPMC抗冻活性值Fig.2AF of HPMC compare with Glutamate and Trehalose
2.2 HPMC对冷冻面团中可冻结水质量分数影响
冷冻面团在冻藏过程中所产生的冰晶主要由可冻结水形成,冰晶不仅会对面筋网络结构造成破坏,且会破坏酵母细胞结构,造成酵母细胞存活率下降,这都将影响面团的发酵和最终面包的品质,所以降低冷冻面团中可冻结水含量对冷冻面团有着重要意义。添加一定浓度的HPMC(B50000)对于冷冻面团的初始结晶温度To、峰值温度Tp没有显著的影响,但在冻藏1 d和45 d后,添加HPMC的样品冰晶融化范围(Te-To)较小,在冻藏1 d后,相比空白样品,添加质量分数0.5%HPMC面团样品的冰晶融化范围降低16.6%,冻藏45 d后降低6.8%。而面团冰晶融化范围越小,意味着冻藏期间形成的冰晶大小分布就越均匀[11];同时随着HPMC添加浓度的增大,面团的结晶融化焓明显降低。
ΔHfw的降低的原因[12]主要由于体系中可冻结水含量降低或体系中原本的水分降低,本实验是由于HPMC中的羟丙基基团对于水分子的束缚作用导致其可冻结水质量分数降低。图3表明,在冻藏45 d后,面团可冻结水质量分数明显升高,而添加HPMC后,可冻结水质量分数由空白面团的65.2%下降至51.3%。同时,随着HPMC质量分数由0%增大到1%,可冻结水质量分数会显著下降,冻藏1 d的情况下,可冻结水质量分数由62.5%降至46.5%,冻藏45 d后,可冻结水质量分数由65.2%降至51.3%。Sharadanant[13]和Leray[14]等认为,将亲水胶加入冷冻面团中,由于胶体分子上的亲水基团和水分子之间由氢键相互作用,可达到吸附面团中部分游离水的效果,从而阻止水分子进一步迁移,降低冷冻面团中游离态水的含量,进一步减少冰晶含量,减缓对面筋蛋白的破坏。
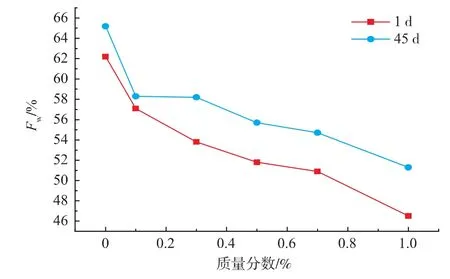
图3 冻藏45 d后HPMC浓度对面团中可冻结水质量分数的影响Fig.3 Effect ofHPMC’s concentration on frozen watercontent in frozen dough after 45 d
2.3 HPMC对冻藏过程中酵母细胞存活率的影响
HPMC由于同时存在疏水性基团甲氧基及亲水性基团羟丙基,所以其有良好的乳化性能,乳化剂已作为酵母冷冻保护剂被广泛研究。徐云峰[15]等发现经冷冻后,相比于空白组,含乳化剂的培养液中酵母存活率,由50%升提升至80%,相对提高了60%。
在抗冻剂质量分数为1%,冻藏温度为-18℃的条件下,测定酵母细胞存活率随冻藏时间的变化。如图4所示,冻藏初期,在0~6 d内,η呈显著下降趋势,以0~2 d内η下降最为迅速,冻藏2 d后,空白酵母菌液η仅为37.2%,而添加质量分数1%谷氨酸、海藻糖后酵母冻藏率分别可达47.9%、54.3%,添加质量分数1%HPMC的酵母菌液η为62.1%,远高于空白菌液,和其它对照组。冻藏6 d后,η下降变缓,8 d后基本保持平衡,此时空白酵母菌液η为23.2%,添加1%的谷氨酸、海藻糖、HPMC的酵母菌液η分别为34.8%、44.3%、55.5%。由此可得出结论,酵母菌液在冷冻初期下降迅速,8 d后保持稳定,HPMC对于其它抗冻剂而言有着明显优势,这是由于HPMC的羟丙基对于水分子有着束缚作用,在冷冻前期,可有效减少冰晶的形成,防止了重结晶,减少对酵母细胞的破坏作用,提高了酵母细胞存活率;随着冻藏时间的延长,在冻藏后期,存活的酵母细胞将开启自身代谢调节,例如合成海藻糖来达到自我保护的目的,所以酵母细胞存活率保持稳定[15]。
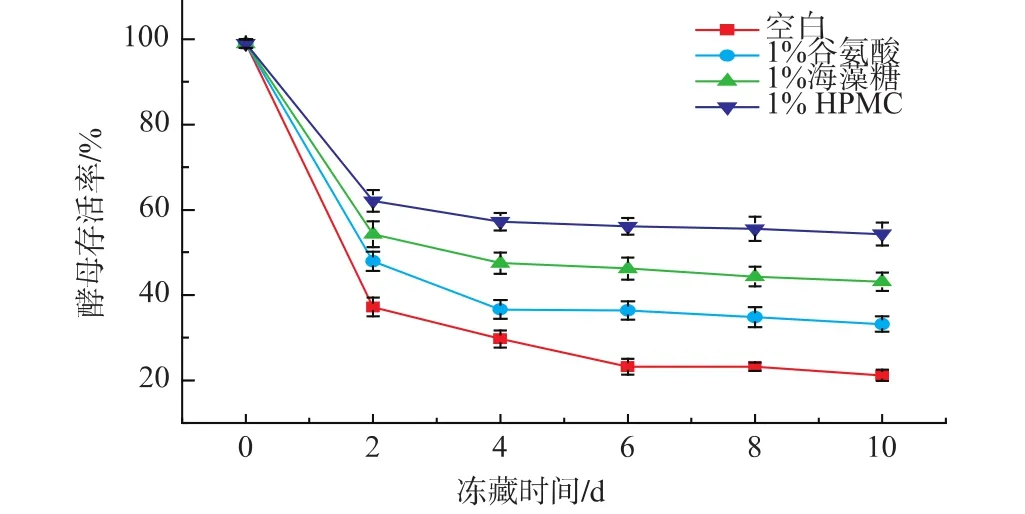
图4 酵母细胞存活率随冻藏时间变化而变化Fig.4 Effect offrozen time on ratio of yeast cells
在冻藏温度-18℃下,冻藏时间8 d的条件下,通过改变酵母菌液中不同抗冻剂的添加浓度,测定酵母细胞存活率。由图5可以得到:在HPMC添加质量分数为0~1.0%时,η随着其添加质量分数的增加而显著提高,由空白样的23.2%增至55.5%,添加谷氨酸、海藻糖的样品η分别为34.8%、44.3%;随着抗冻剂质量分数进一步提高,HPMC对η的影响保持稳定,谷氨酸和海藻糖还有增幅,当超过1.5%的添加量时,3组样品的η基本保持稳定,HPMC效果明显优于谷氨酸和海藻糖。

图5 酵母细胞存活率随抗冻剂质量分数的变化Fig.5 Effect of concentration of cryoprotectants on ratio of yeast cells
3 结语
通过对比研究不同型号HPMC、海藻糖、谷氨酸的抗冻活性,HPMC对面团中可冻结水含量的影响,及其对提高冻藏过程中酵母细胞存活率可发现,HPMC的抗冻活性由于其分子结构从2.4变化至9.82,通过适当选型,可远高于海藻糖、谷氨酸的5.99和3.98;在冻藏45 d后,添加HPMC的面团可冻结水质量分数由空白样的65.2%降至51.3%;同时,由于HPMC优异的持水性能,添加质量分数1%HPMC样品的酵母细胞在冻藏8 d的存活率也由空白的23.2%提升至55.5%,明显高于添加海藻糖、谷氨酸样品的44.3%,34.8%。所以,结果表明HPMC的持水性能对于降低面团中可冻结水含量和提高酵母细胞在冻藏过程中的存活率有显著效果,对实验研究和冷冻面团生产工艺具有一定的指导意义。
[1]徐云峰,徐学明.复配乳化剂提高酵母抗冻性及改善冷冻面团品质的研究[D].无锡:江南大学,2009.
[2]LIShuguo,CHEN Hui.Studyon compound frozen dough qualityconditioner[J].CHINA Western Cereals&Oils Technology,2002,4:12-15.
[3]KLINE L,SUGIHARA T F.Factors affecting the stability of frozen bread doughs.I.Prepared by straight dough method[J].Baker’s Digest,1968,42:44-80.
[4]RIBOTTA P D,PEREZ G T,LEON A E,et al.Effect of emulsifier and guar gum on micro structural,rheological and baking performance of frozen bread dough[J].Food Hydrocolloids,2004,18(2):305-313.
[5]HAN Minbing.The development and prospect of HPMC[J].Meticulous and Specialty Chemicals,1998(12):1-3.
[6]ZHANG C,ZHANG H,WANG L.Effect of carrot (Daucuscarota)antifreeze proteins on the fermentation capacity of frozen dough[J].2007,40:763-769.
[7]MITSUIKI M,MIZUNO A,MOTOKI M.Isolation andcharacterization of high antifreeze active peptides inenzymic digests of hemoglobin[J].Cryobiol Cryotechnol,1996,42:102-107.
[8]LAAKSONEN T J,ROOS Y H.Thermal,dynamic-mechanical,and dielectric analysis of phase and state transitions offrozen wheat doughs[J].Journal of Cereal Science,2000,32(3):281-292.
[9]LODI A,VODOVOTZ Y.Physical properties and water state changes during storage in soy bread with and without almond[J].Food Chemistry,2008,110(2):554-561.
[10]L.Plourde-Owobi,S.Durner,GGoma,J.Francois.Trehalosereserver in Saccharomyces cerevisiae:phenomenon of transport,accumulation and role in cell viability[J].International Journal of Food Microbiology,2000,55:33-40.
[11]CARINI E,VITTADINI E,CURTI E,et al.Effect of different mixers on physicochemical properties and water status of extruded and laminated fresh pasta[J].Food Chemistry,2010,122(2):462-469.
[12]HWANG J Y,SHYU Y S,HSU C K.Grape wine less improves the rheological and adds antioxidant properties to ice cream[J].LWT-Food Science and Technology,2009,42(1):312-318.
[13]OKANO T,NISHIYAMA S,SHINOHARA I,et al.Effect of hydrophilic and hydrophobic microdomains on mode of interaction between block polymer and blood platelets[J].Journal of Biomedical Materials Research,1981,15(3):393-402.
[14]RIBOTTA P D,LEON A E,ANON M C.Effect of freezing and frozen storage of doughs on bread quality[J].Journal of Agricultural and Food Chemistry,2001,49(2):913-918.
[15]XU Yunfeng,YANG Na,JIN Zhengyu,et al.Cryoprotectiverole of combined emulsifiers with soybean lecithin[J].Journal of Food Science and Biotechnology,2011,30(2):213-216.
[16]潘振兴,黄卫宁.冷冻保护剂影响冷冻面团发酵与烘焙特性的研究[D].无锡:江南大学,2008.
