甘蔗烟酰胺转氨酶基因(SoNAAT1)的克隆及其在缺Fe胁迫下表达量变化
2018-06-05李长宁MukeshKumarMalviya陈艳露覃丽萍
农 倩,李长宁,Mukesh Kumar Malviya,苏 琴,张 艳,陈艳露,覃丽萍,谢 玲
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.农业部广西甘蔗生物技术与遗传改良重点实验室/广西甘蔗遗传改良重点实验室,广西 南宁 530007;3.广西作物遗传改良生物技术重点开放实验室,广西 南宁 530007)
【研究意义】Fe是植物必需的营养元素,在各种生理生化代谢中具有非常重要的作用。土壤中Fe的含量很丰富,但植物可利用的可溶性Fe含量却很低,世界上约30 %的土壤由于生物可获得性Fe的缺乏而限制植物对Fe的吸收,严重影响农作物产量和品质[1]。甘蔗是我国重要的糖料作物,近年来,甘蔗主产区的幼苗出现严重的缺Fe失绿问题,影响了我国甘蔗生产及食糖安全。缺Fe胁迫下,植物具有两种不同的Fe吸收利用系统,机理Ⅰ型植物主要通过酸化根表环境,提高根际还原效率,将Fe3+还原为Fe2+后被吸收利用;机理Ⅱ型仅存在于单子叶禾本科植物中,其可通过根系分泌大量具有很强的Fe3+螯合作用的Fe载体,促进植物对Fe的吸收[2-3],分泌Fe载体的多寡与Fe吸收能力大小呈正相关。植物Fe载体主要由麦根酸及其衍生物组成[4],麦根酸的生物合成途径中,由烟酰胺转氨酶(NAAT)催化烟酰胺生成酮类中间产物的反应是麦根酸类Fe载体合成过程的关键限速步骤[5-6]。因此,克隆甘蔗NAAT基因并分析其在缺Fe胁迫下的表达情况,对研究甘蔗Fe载体生物合成调控机理及抗逆育种均具有重要意义。【前人研究进展】烟酰胺转氨酶活性与植物根部分泌的麦根酸类物质量和缺Fe胁迫耐受性有关,如大麦NAAT在缺Fe胁迫下活性增强,恢复供Fe活性被抑制[7]。大麦中的2个NAAT基因在根部都受缺Fe强烈诱导表达,而水稻中发现的6个NAAT基因,只有NAAT1表达受缺Fe胁迫诱导[8-9]。将大麦NAAT基因转入水稻后,转基因植株分泌麦根酸类物质的能力显著增强,根系Fe吸收量增加,植株对缺Fe的耐受性及产量也有所提高,显示出NAAT基因在提高作物缺Fe耐受性的巨大潜力[10]。【本研究切入点】目前,已有报道在多种植物中克隆得到NAAT家族的相关基因[7-8,11-12],然而对甘蔗NAAT基因尚无相关研究。【拟解决的关键问题】采用反转录PCR(RT-PCR)与cDNA末端快速扩增(RACE-PCR)克隆编码甘蔗烟酰胺转氨酶的基因并进行生物信息学分析,探索其进化保守性及在缺Fe胁迫下的表达特性,为进一步探讨该酶在麦根酸类Fe载体生物合成途中的作用提供依据。
1 材料与方法
1.1 材料与处理
试验于2017年6月至9月在广西甘蔗遗传改良重点实验室玻璃温室内进行。甘蔗品种选用新台糖22号(ROC22),蔗种首先砍成单芽,选取完好无损蔗芽在沙床中培育,待蔗苗长到3~4叶期时,筛选出大小基本一致、长势均一幼苗移栽至装有1/2 霍格兰(Hoagland)营养液的桶中,桶大小为21 cm × 20 cm (直径×高),每桶盛营养液8 L,pH 6.0,置于通风阴凉处。为防止根系缺氧和有害分泌物积累,使用充气泵每隔2 h充气15 min,每4 d更换1次营养液,植株长势恢复后进行分组处理:对照处理(Control,C):1/2 Hoagland营养液培养,Fe含量10 μmol·L-1;缺Fe胁迫处理(Fe Deficiency,FD):营养液中Fe含量0.1 μmol·L-1,在处理2、4和7 d后,采集幼嫩根系分装速冻于液氮中,-80 ℃冰箱中保存备用。
1.2 生理指标测定
根系内源脱落酸(ABA)含量采用酶联免疫吸附法(ELISA)测定,酶联免疫试剂盒由中国农业大学植物生理与生物化学国家重点实验室王保民教授提供,测定流程按说明书,使用ANTHOS-2010酶标仪测定,每个样品重复测定3次。采用微量法测定过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性,相关试剂盒购于苏州科铭生物技术有限公司并按其说明书测定。采用DPS软件进行数据方差分析,其中以Duncan’s新复极差法(P≤0.05)进行显著性分析。
1.3 RNA提取及cDNA第一链合成
甘蔗根系总RNA采用Trizol法提取,Trizol试剂购自北京康为世纪生物科技有限公司。实时荧光定量PCR所需cDNA由Formentas公司试剂盒合成,逆转录引物为 Oligo(dT)18,SoNAAT1基因全长扩增所需cDNA由Clontech公司试剂盒合成,使用试剂盒配备的逆转录引物。RNA提取及cDNA合成步骤按照说明书操作。
1.4 SoNAAT1基因全长克隆
根据课题组先前在基因芯片实验中获得的SoNAAT1 EST序列片段,设计3’-RACE引物:5’-CGGCTTGGATGGATAGTTACC-3’及5’-RACE引物:5’-CTGGACAAATGTTGGAGGATC-3’,然后分别结合Clontech公司RACE试剂盒提供的接头引物18AP(5’-GGCCACGCGTCGACTAGTAC-3’)及UPM引物扩增SoNAAT1基因全长cDNA。扩增体系含:2×GoldStar Best Master Mix 25 μl、cDNA 2 μl、10 μmol·L-1的正向及反向引物各1 μl、以双蒸水补齐至50 μl。扩增程序为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。PCR产物经1.2 %琼脂糖凝胶电泳检测,回收纯化目的条带,连接至pMD18-T载体,转化DH5α感受态细胞后,筛选阳性克隆送去测序并进行序列拼接。拼接完成后,在基因编码框首尾设计引物F: 5’-ATGGAGAACAGCGCCAGCAAGAG-3’和R: 5’-TCACT TTGCCGGGTTCTTGTATCG-3’进行扩增以验证序列准确性,反应体系及程序如前所述。
1.5 SoNAAT1基因生物信息学分析
选用BlastP搜索蛋白质相似性(https://blast.ncbi.nlm.nih.gov/);使用ExPASy(http://expasy.org/tools/)分析编码蛋白质的基本理化性质;通过ClustalW2程序(http://www.ebi.ac.uk/Tools/clustalw2/index.html)进行蛋白质多序列比对并由Espript (http://espript. ibcp.fr/ESPript/ESPript/)进行颜色渲染;使用MEGA 6.0程序(http://www.megasoftware.net/)绘制聚类分析图;使用SOPMA软件预测蛋白的二级结构。
1.6 实时荧光定量PCR
根据获得的SoNAAT1基因序列设计荧光定量 PCR引物,其中正向引物序列SoNAAT1-F:5’-CTGGACAAATGTTGGAGGATC-3’,反向引物SoNAAT1-R:5’-CGGCTTGGATGGATAGTTACC-3’以甘蔗甘油醛-3-磷酸脱氢酶(GAPDH,EF189713)为内参基因,设计内参引物,正向引物GAPDH-F:5’-TGGTGCTGACTATGTCGTGGA-3’,反向引物GAPDH-R:5’-CATGGGTGCATCTTTGCTTG-3’。实时荧光定量PCR扩增体系含:2×All-in-One qPCR Mix (Gene Copoeia) 10、2 μl cDNA、4 μmol·L-1正向及反向引物各1 μl、以无菌水补齐至20 μl。扩增程序如下:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。反应完成后进行融解曲线检验,按照2-ΔΔCt法计算基因表达水平的相对表达量。
2 结果与分析
2.1 SoNAAT1基因全长cDNA克隆
以混合甘蔗根系cDNA为模板,SoNAAT1基因经5’-和3’-RACE-PCR扩增获得的产物长度分别为988 bp(图1-A)和795 bp(图1-B)。对目的条带回收,连接转化,蓝白筛选后送上海生工公司测序,拼接后得到SoNAAT1基因全长cDNA为1593 bp,包含启始密码ATG和终止密码TGA,开放阅读框(Open read frame,ORF)长度为1206 bp(图1-C),编码401个氨基酸,5’和3’端非翻译区长度为98 和289 bp,3’非编码区还包括一个19 bp ploy(A)尾巴,对该基因在NCBI上进行注册,命名为SoNAAT1,获得登录号JQ292842。
2.2 序列生物信息学分析
通过Expasy工具分析表明SoNAAT1基因编码蛋白等电点为5.64,分子量为44.2 kD,亚细胞定位于细胞质。SoNAAT1蛋白的疏水性预测发现,氨基酸链上第361位脯氨酸(Pro-361)疏水性最强,分值为2.544;分值最低的是第290位谷氨酸(Glu-290),为-1.878;平均亲水系数(GRAVY)为0.033,为疏水蛋白质。二级结构预测显示该蛋白共出现4种构象:其中α-螺旋、随机转曲、延伸链和β-转角、分别占比40.65 %、27.68 %、22.94 %和8.73 %。将获得的SoNAAT1序列通过NCBI BlastP比对表明,其与玉米(NM_001138546)、水稻(Os11g0552000)和高粱(XP_002450952)的一致性/相似性依次为99 %/68 %、99 %/ 76 %和99 %/71 %,说明SoNAAT1与其他作物NAAT基因进化关系较近。通过与水稻、玉米、高粱NAAT家族基因的氨基酸序列聚类分析发现(图2),SoNAAT1与高粱SbNAAT3优先聚在一个小分支。NAAT多序列比对结果表明(图3),甘蔗与上述3种作物的序列间高度相似,参与烟酰胺转氨酶功能的关键氨基酸位点高度保守。
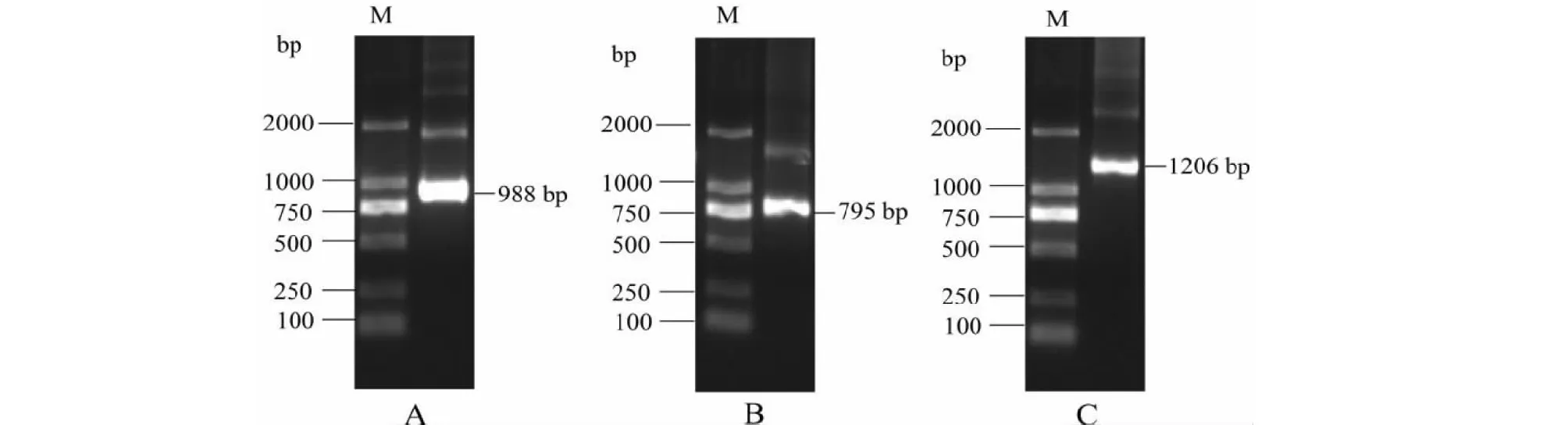
A: 5’-RACE产物; B: 3’-RACE产物;C: SoNAAT1编码框扩增产物A: 5’-RACE-PCR amplified results; B: 3’-RACE-PCR amplified results; C: Open reading frame amplified results of SoNAAT1图1 SoNAAT1基因的扩增结果Fig.1 Amplified products of SoNAAT1 gene

图2 不同作物NAAT基因的氨基酸同源性分析Fig.2 Homology analysis of NAAT amino acid sequence from sugarcane and other crops

利用ClustalW2进行氨基酸序列比对并通过ESPript进行颜色渲染,深色背景表示一致序列,下标星号的为参与烟酰胺转氨酶功能的关键氨基酸SoNAAT1 is aligned with NAAT proteins from Zea mays (Zm) and Sorghum bicolor (Sb) . The alignment was conducted by ClustalW2 and colored with ESPript, and dark backgrounds represents similar sequences. The asterisk corresponds to residues critical to aminotransferase function图3 NAAT氨基酸序列多重比对Fig.3 Amino acid sequence alignment of NAAT proteins
2.3 ABA含量及相关抗氧化酶活性变化
与对照相比,缺Fe胁迫处理的内源ABA含量呈增加趋势,在处理后的2、4和7 d分别比对照增加21.3 %、26.1 %和30.7 %,均显著高于对照(图4-A)。缺Fe胁迫处理下相关抗氧化酶CAT、POD和SOD的活性均高于对照,但是各酶与对照之间的增量趋势又有所不同。CAT活性在处理后2、4和7 d分别比对照增加42.8 %、75.4 %和78.2 %(图4-B),一直呈递增趋势,与对照差异显著;POD和SOD的活性在处理后2、4和7 d分别比对照增加43.6 %、95.2 %和48.9 %(图4-C)和4.4 %、25.8 %和16.9 %(图4-D),均呈现先升高后下降的变化趋势。在缺Fe胁迫第2天,SOD活性没有显著改变,在胁迫第4、7天,POD和SOD的活性与对照差异显著。
2.4 SoNAAT1表达量分析
以甘蔗GAPDH基因作为内参基因,利用实时荧光定量PCR技术分析SoNAAT1基因于缺Fe胁迫处理下在甘蔗根系中的转录水平。由图5可知,SoNAAT1的表达随着胁迫时间的延长而增强,在处理后的第2、4和7 天表达量分别是对照的2.8、3.4和6.7倍,表达量差异显著。

同一处理时间内,标有不同小写字母的处理间在0.05水平差异显著Bars superscribed by a different lowercase letter are significantly different at the 0.05 probability level at the same treated time图4 缺Fe胁迫处理下甘蔗根系ABA含量及相关抗氧化酶活性的变化Fig.4 Effects of Fe deficiency treatment on ABA content and antioxidant enzymes activity of sugarcane root
3 讨 论
研究显示,Fe吸收机理Ⅱ型植物主要包含禾本科单子叶植物,这类植物耐受缺Fe胁迫能力的大小与植物根系分泌麦根酸类Fe载体的种类和数量息息相关。比如大麦是禾本科作物中麦根酸类Fe载体分泌数量最多的,其耐受缺Fe胁迫能力就较强;反之,水稻分泌麦根酸类Fe载体的能力不如大麦,其耐受缺Fe胁迫能力也较弱[2-3]。在机理Ⅱ型植物中,Fe吸收的关键在于植物Fe载体的合成,烟酰胺转氨酶(NAAT)是麦根酸类植物Fe载体合成过程中的关键限速酶[13]。本研究克隆得到编码甘蔗烟酰胺转氨酶的SoNAAT1基因全长,对该基因进行序列分析的结果表明,其拥有完整的编码框,编码的蛋白质序列与其他作物如玉米、水稻、高粱中的NAAT序列具有很高的同源性,尤其是与同属C4作物的高粱SbNAAT3相似性极高,各作物的NAAT序列中参与烟酰胺转氨酶功能的关键氨基酸序列高度保守,SoNAAT1基因表达量始终随着缺Fe胁迫时间延长而不断增加。这些结果说明SoNAAT1基因可能与水稻[8-9]、高粱[9]、玉米[9]、小麦[12]、大麦[14]、等植物中已研究的NAAT基因的功能相似,参与根系麦根酸类植物Fe载体合成,响应缺Fe胁迫等一系列逆境胁迫过程。

同一处理时间内,标有不同小写字母的处理间在0.05水平差异显著Bars superscribed by a different lowercase letter are significantly different at the 0.05 probability level at the same treated time图5 缺Fe胁迫处理对甘蔗根系SoNAAT1表达量的影响Fig.5 Expression changes of SoNAAT1 gene in sugarcane roots under Fe deficiency treatment
研究表明,植物在遭受缺Fe胁迫时,会迅速激活Fe吸收系统,以提高植株吸收利用Fe的能力,此外,内源Fe再利用系统还会同时得到调节,活化植株体内存储的Fe,并将其优先输送到生长旺盛部位,从而有效缓解缺Fe胁迫对植物生长造成的伤害[15]。研究显示,植物响应缺Fe胁迫的生理和分子反应受到Fe吸收和代谢相关基因表达的调节,而多种激素和信号小分子参与了此类的调节作用[16-17],如ABA参与调节了缺Fe胁迫下拟南芥内源Fe再利用的过程[18]。本研究结果显示缺Fe胁迫能快速诱导ABA在根系中大量累积,且ABA积累和SoNAAT1基因表达量都随着缺Fe胁迫时间延长而不断增加,但SoNAAT1基因表达量与ABA合成是否存在定量或相互调节关系,还需进一步研究证实。CAT、POD和SOD是植物体内抗氧化酶系统的重要组分,共同作用于清除机体内过量的氧自由基,降低其对细胞的毒害作用,3种酶都是植物中重要的含Fe蛋白酶[19],因此缺Fe影响酶的活性[20]。本研究结果表明,短期的缺Fe胁迫处理下3种酶活性迅速提高,表明抗氧化酶防护系统能够快速应答缺Fe处理,提高活性以减少过量氧自由基的产生对植物体造成的损害;随着胁迫时间延长,虽然SoNAAT1基因表达量一直在增加,加大麦根酸类Fe载体的合成以增加植株对Fe的吸收能力,由于环境中可获得Fe的缺乏,导致植株处于缺Fe状态,POD和SOD活性呈先升高后下降的趋势,与前人研究结果一致[21],证实了缺Fe对含Fe蛋白酶活性的影响。
4 结 论
甘蔗SoNAAT1基因编码序列高度保守,表达量随着缺Fe胁迫时间的延长而不断增强,推测该基因参与了甘蔗麦根酸类Fe载体生物合成途径的调控过程,缺Fe胁迫引起甘蔗根系内源ABA含量和相关抗氧化酶活性增加,并与SoNAAT1表达密切相关。
参考文献:
[1]Guerinot M L,Yi Y. Iron:nutritious,noxious,and not readily available[J]. Plant Physiology,1994,104(3):815-820.
[2]Marschner H,Römheld V. Strategies of plants for acquisition of iron[J]. Plant Soil,1994,165(2): 261-274.
[3]Kobayashi T,Nishizawa N K. Iron uptake,translocation,and regulation in higher plants[J]. Annual Review of Plant Biology,2012,63(1):131-52.
[4]Takagi S,Nomoto K,Takemoto T. Physiological aspect of mugineic acid,a possible phytosiderophore of graminaceous plants[J]. Journal of Plant Nutrition,1984,7(1-5):469-477.
[5]Ma J F,Shinada T,Matsuda C,et al. Biosynthesis of phytosiderophores,mugineic acids,associated with methionine cycling[J]. Journal of Biological Chemistry,1995,270(28):16549-16554.
[6]Inoue H,Higuchi K,Takallashi M,et al. Three rice nicotianamine synthase genesOsNAS1,OsNAS2 andOsNAS3 are expressed in cells involved in long-distance transport of iron and differentially regulated by iron[J]. Plant Journal,2003,36(3):366-381.
[7]Takahashi M,Yamaguchi H,Nakanishi H,et al. Cloning two genes for nicotianamine aminotransferase,a critical enzyme in iron acquisition(StrategyII)in graminaceous plants[J]. Plant Physiology,1999,121(3):947-956.
[8]Cheng L,Wang F,Shou H,et al. Mutation in nicotianamine aminotransferase stimulated the Fe(II) acquisition system and led to iron accumulation in rice[J]. Plant Physiology,2007,145(4):1647-1657.
[9]Inoue H,Takahashi M,Kobayashi T,et al. Identification and localisation of the rice nicotianamine aminotransferase geneOsNAAT1 expression suggests the site of phytosiderophore synthesis in rice[J]. Plant Molecular Biology,2008,66(1-2):193-203.
[10]Takahashi M,Nakanishi H,Kawasaki S,et al. Enhanced tolerance of rice to low iron availability in alkaline soils using barley nicotianamine aminotransferase genes[J]. Nature Biotechnology,2001,19(5):466-469.
[11]Bashir K,Inoue H,Nagasaka S,et al. Cloning and characterization of deoxymugineic acid synthase genes from graminaceous plants[J]. Journal of Biological Chemistry,2006,281(43):32395-32402.
[12]Beasley J T,Bonneau J P,Johnson A A T. Characterisation of the nicotianamine aminotransferase and deoxymugineic acid synthase genes essential to strategy II iron uptake in bread wheat (TriticumaestivumL.)[J]. PLoS ONE,2017,12(5):e0177061
[13]Kanazawa K,Higuchi K,Nishizawa N K,et al. Nicotianamine aminotransferase activities are correlated to the Phytosiderophore secrotions under Fe-deficient conditions in Gramineae[J]. Journal of Experiment Botany,1994,45(281):1903-1906.
[14]Kanazawa K,Higuchi K,Nishizawa N K,et al. Detection of two distinct isozymes of nicotianamine aminotransferase in Fe-deficient barley roots[J]. Journal of Experiment Botany,1995,46(290):1241-1244.
[15]Jin C W,You G Y,He Y F,et al. Iron deficiency-induced secretion of phenolics facilitates the reutilization of root apoplastic iron in red clover[J]. Plant Physiology,2007,144(1):278-285.
[16]Chen S,Sanchez-Fernandez R,Lyver E,et al. Functional characterization of AtATMl,AtATM2,and AtATM3,a subfamily ofArabidopsishalf-molecule ATP-binding cassette transporters implicated in iron homeostasis[J]. Journal of Biological Chemistry,2007,282(29):21561-21571.
[17]Yang J L,Chen W W,Chen L Q,et al. The 14-3-3 protein GENERAL REGULATORY FACTOR11 (GRF11)acts downstream of nitric oxide to regulate iron acquisition inArabidopsisthaliana[J]. New Phytologist,2013,197(3):815-824.
[18]Lei G J,Zhu X F,Wang Z W,et al. Abscisic acid alleviates iron deficiency by promoting root iron reutilization and transport from root to shoot inArabidopsis[J]. Plant Cell and Environment,2014,37(4):852-863.
[19]Balk J,Lobreaux S. Biogenesis of iron-sulfur proteins in plants[J]. Trends in Plant Science,2005,10(7):324-331.
[20]Ranieri A,Castagna A,Baldan B,et al. Iron deficiency differently affects peroxidase isoforms in sunflower[J]. Journal of Experiment Botany,2001,52(354):25-35.
[21]高 丽,史衍玺. 铁胁迫对花生某些生理特性的影响[J]. 中国油料作物学报,2003,25(3):51-54.
