经尿道姑息性前列腺切除术联合内分泌治疗对晚期前列腺癌合并膀胱出口梗阻的疗效分析
2018-06-04姚裘徐彭伟阳东荣
姚裘 徐彭伟 阳东荣
前列腺癌居我国男性恶性肿瘤发病率第6位,并呈逐年增长趋势。约80.0%~90.0%的患者就诊时已是晚期,失去了根治性手术机会,一线内分泌治疗是延缓疾病发展的重要手段[1]。晚期前列腺癌患者因局部肿瘤发展,往往合并膀胱出口梗阻,甚至继发上尿路梗阻引起肾功能损害等。经尿道前列腺姑息性切除术能在较短时间内缓解患者的并发症,明显提高生活质量[2-3]。但经尿道姑息性手术对患者临床进展及总体生存率的影响如何,目前尚无明确定论。本研究对我院符合研究条件的转移性前列腺癌患者的临床资料进行了分析,以探讨经尿道姑息性前列腺切除术联合内分泌治疗对晚期前列腺癌合并膀胱出口梗阻的临床疗效。
对象与方法
一、一般资料
回顾性分析我院2009年1月至2017年10月前列腺癌患者的临床资料。按以下标准筛选符合要求病例:①行前列腺穿刺活检或因前列腺增生行经尿道手术,病理确诊为前列腺癌;②影像学检查发现转移灶,临床分期为T3~4N0M1、T3~4N1M0或T3~4N1M1,不适宜行根治手术;③所有病例均在确诊后即行最大限度雄激素阻断治疗(maximum androgen blockade therapy,MAB);④手术组患者尿流动力学检查结果均证实存在膀胱出口梗阻,内分泌治疗1~3个月症状改善不佳,行经尿道姑息性手术治疗。对照组为无明显膀胱出口梗阻、或存在膀胱出口梗阻但不能耐受或拒绝经尿道手术治疗者。排除标准为:①首次诊断后即行前列腺癌根治术;② 首次诊断后即行前列腺放射性粒子植入术或外放射治疗:③首次诊断后即行阿比特龙、恩扎鲁胺等二线治疗。最终收集符合要求的患者181例, 其中73例行经尿道前列腺电切或激光手术联合MAB(手术组);108例予单纯内分泌治疗(对照组)。
二、内分泌及手术治疗方法
内分泌治疗方案为药物去势(诺雷得或抑那通)+抗雄药物(康士得或氟他胺),早期个别患者采用手术去势(双侧睾丸切除)+抗雄药物(康士得或氟他胺)。经尿道姑息性手术方式为经尿道前列腺电切除术、经尿道前列腺绿激光手术或2 μm 激光手术。
三、复查及生存期随访
手术组所有患者于术前及术后1个月行尿流动力学检查、国际前列腺症状评分(IPSS)及前列腺癌治疗功能评价量表(FACT-P)评分。所有病例至少1~3个月检测1次血清PSA及睾酮(T)水平,记录PSA谷值,记录患者PSA无进展生存期(progression-free survival, PFS),即从接受治疗PSA开始下降至PSA再次上升时间。所有病例于治疗开始后1~3个月行FACT-P复测,评价治疗后生活质量。所有患者至少3~6个月进行1次影像学复查,记录患者影像学PFS(radiographic PFS, rPFS), 即出现实体瘤疗效评价标准RECIST 1.1规定的软组织病灶进展和(或)骨扫描观察到的骨转移灶进展的时间。随访4~91个月,中位随访时间34 个月。随访资料通过我院电子病历系统、影像学系统、门诊随访及电话随访获得,随访截止时间为2017年10月1日。
四、统计学方法
应用 SPSS 19.0 进行统计学分析。计量资料应用独立样本t检验;计数资料使用χ2检验;分级变量使用两个独立样本比较的Wilcoxon秩和检验;Kaplan-Meier法分别比较两组疾病无进展生存率、总体生存率;Cox比例风险回归模型对总体生存期(overall survival, OS)进行多因素分析。显著性水平a=0.05,P<0.05为差异有统计学意义。
结 果
一、手术组与对照组临床资料比较
两组患者的年龄、治疗前血清总PSA值、前列腺体积、Gleason评分、有无基础疾病和基线FACT-P评分等基础资料比较,差异无统计学意义(P值均>0.05)。与对照组比较,手术组PSA谷值更低(1.77 ng/ml vs 3.14 ng/ml,P=0.000);治疗后FACT-P平均值较对照组高(124.33 vs 119.45,P=0.021)。差异均有统计学意义。见表1。

表1 手术组与对照组临床资料比较
二、手术组术前、术后IPSS、Qmax、PVR和FACT-P评分比较
手术组73例患者手术均顺利完成。平均手术时间(47.8±11.5)min,术后平均留置导尿管时间(63.5±18.4)h,术后平均住院天数(3.4±0.9)d。术后1个月患者IPSS(12.74±3.43)分、Qmax(18.23±2.26)ml/s、PVR(27.41±8.28)ml和FACT-P评分(124.33±14.00)与术前比较均有改善(P值均<0.05),差异有统计学意义。见表2。其中,2例患者术后出现急迫性尿失禁,经1~3个月提肛训练后恢复;1例因尿潴留、3例因梗阻症状行二次手术,未发现严重手术并发症及围术期死亡病例。
三、手术组与对照组生存期比较
1.Kaplan-Meier生存分析显示手术组中位PSA PFS优于对照组(20.10个月 vs 12.58个月,Log-rankP=0.002)。见图1。

表2 手术组术前、术后IPSS、Qmax、PVR和FACT-P评分比较

图1 两组病例PSA无进展生存率比较

图2 两组病例影像学无进展生存率比较
2.Kaplan-Meier生存分析显示手术组中位rPFS优于对照组(21.40个月 vs 14.31个月,Log-rankP=0.004)。见图2。
3.手术组与对照组的3年生存率、5年生存率分别是76.7% vs 53.2%、38.8% vs 28.6%,手术组明显高于对照组。两组平均OS分别为53.31 个月 vs 45.08个月,Log-rankP=0.028,手术组的生存曲线优于对照组。见图3。
4.Cox风险回归模型分析发现,是否手术、治疗前血清PSA水平、基线及治疗后FACT-P评分是总体生存率的独立影响因素,且差异有统计学意义。而年龄、Gleason评分、前列腺体积和基础疾病对总体生存率的影响无统计学意义。见表3。

图3 两组病例总生存率比较
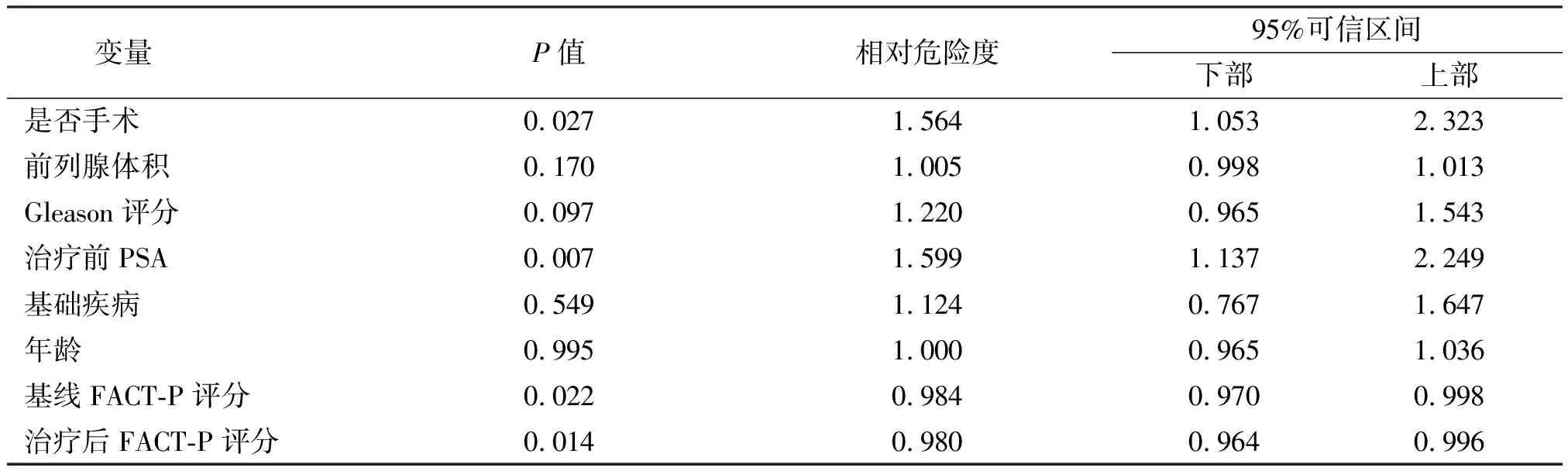
表3 两组病例总体生存数据的Cox比例风险分析
讨 论
晚期前列腺癌尤其伴有转移的患者, 注重的是全身性治疗,即内分泌治疗和化疗。有一部分患者因前列腺体积增大引起梗阻致尿潴留或因出血而需要手术干预。本研究手术组73例患者因膀胱出口梗阻行经尿道姑息性手术治疗,术后IPSS评分、Qmax、PVR和FACT-P评分均较术前明显改善。前列腺癌伴膀胱出口梗阻症状的患者,采用经尿道光汽化或经尿道电切手术治疗有效,可迅速缓解患者的下尿路梗阻症状,提高患者生活质量[3]。
但经尿道手术除缓解局部症状外,对患者疾病进展及总体生存率的影响,大多文献并未提及[4]。在一些其他类型的肿瘤,如胃癌、结直肠癌、乳腺癌及肾细胞癌中[5-8],已有确切的证据表明减瘤手术可以提高患者的生存率,并增加其对后续治疗的反应。而经尿道前列腺切除术是否能达到“减瘤”目的还存在争议。有学者[9]认为,经尿道前列腺切除术可直接减少肿瘤细胞数量,改变前列腺癌细胞的受体表达量,从而延长前列腺癌对内分泌治疗的有效时间[10-11]。但也有学者[12]认为,经尿道姑息性手术尽管能减轻膀胱出口梗阻,但并不能减少前列腺肿瘤体积,甚至担心手术使前列腺静脉及静脉窦开放,在手术灌注液压力作用下有可能使前列腺癌细胞进入血液循环,从而发生远处转移。Qin等[11]则认为,前列腺癌的转移原因在于其具有转移特性的前列腺癌细胞,TURP并不会引起前列腺癌的扩散。本研究中,两组病例在治疗开始3个月后复查时,远处转移病灶的变化无统计学差异,在6个月以后,对照组的远处转移进展反而高于手术组,差异有统计学意义,所以手术组的远处转移进展并不快于对照组。国内外临床研究[13-15]也得到了类似的结论,即TURP等经尿道手术不会促进前列腺肿瘤细胞播散或进展。故经尿道手术治疗晚期前列腺癌是安全的。
另外,也有研究表明[16-18],前列腺癌患者生活质量的改善与总生存时间相关。本试验采用FACT-P来评估患者生活质量[19],统计发现无论是基线还是治疗后FACT-P均是患者OS的独立预后因素,结果与上述研究一致。经尿道姑息性手术可能通过改善生活质量使患者生存获益。
对于激素敏感型前列腺癌患者,内分泌治疗可明显缩小肿瘤体积,可能使大部分合并尿潴留患者避免手术[20]。目前经尿道手术对患者OS的影响尚不十分明确。笔者不建议对所有合并膀胱出口梗阻的患者即刻行经尿道姑息性手术治疗,可在内分泌治疗1~3个月后再次评估梗阻情况以决定是否行经尿道手术。
本研究结果提示经尿道姑息性前列腺切除术联合内分泌治疗可改善晚期前列腺癌膀胱出口梗阻症状及生活质量,并可能延缓疾病进展、延长患者OS,是晚期前列腺癌合并膀胱出口梗阻的一种安全有效的治疗方法。但因前列腺癌进展缓慢,至观察截止时间仍有近半数病例存活,导致截尾数据过多,在一定程度上影响统计学分析的准确性。因此,所得结论仍需样本量更大、随访时间更长的研究进一步证实。
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006[J]. CA Cancer J Clin,2006,56(2):106-130.
[2] Crain DS, Amling CL, Kane CJ. Palliative transurethral prostate resection for bladder outlet obstruction in patients with locally advanced prostate cancer[J]. J Urol,2004,171(2 Pt 1):668-671.
[3] 刘磊,侯小飞,马潞林,等. 晚期前列腺癌膀胱出口13梗阻患者姑息性经尿道前列腺切除术疗效评价[J]. 北京大学学报:医学版,2015,47(4):597-600.
[4] 叶敏,朱英坚,王伟明,等. 经尿道汽化切除治疗伴膀胱出口梗阻的晚期前列腺癌[J]. 中华泌尿外科杂志,2007,28(8):544-547.
[5] Temple LK, Hsieh L, Wong WD, et al. Use of surgery among elderly patients with stage IV colorectal cancer[J]. J Clin Oncol,2004,22(17):3475-3484.
[6] Rapiti E, Verkooijen HM, Vlastos G, et al. Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis[J]. J Clin Oncol,2006,24(18):2743-2749.
[7] Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-sb alone for metastatic renal-cell cancer[J]. N Engl J Med,2001,345(23):1655-1659.
[8] Petrillo M, Anchora LP, Scambia G, et al. Cytoreductive Surgery Plus Platinum-Based Hyperthermic Intraperitoneal Chemotherapy in Epithelial Ovarian Cancer: A Promising Integrated Approach to Improve Locoregional Control[J]. Oncologist,2016,21(5):532-534.
[9] Mostaghel EA, Page ST, Lin DW, et al. Intraprostatic androgens and androgen-regulated gene expression persist after testosterone suppression: therapeutic implications for castration-resistant prostate cancer[J]. Cancer Res,2007,67(10):5033-5041.
[10] Qin X, Ma C, Yao X, et al. Palliative Transurethral Resection of the Prostate (TURP) May Improve Cancer Control in Hormone Sensitive Metastatic Prostate Cancer (PCa)[J]. Urology,2009,74(4):270
[11] Qin XJ, Ma CG, Ye DW, et al. Tumor cytoreduction results in better response to androgen ablation—a preliminary report of palliative transurethral resection of the prostate in metastatic hormone sensitive prostate cancer[J]. Urol Oncol,2012,30(2):145-149.
[12] Crain DS,Amling CL,Kane CJ. RE: Palliative transurethral prostate resection for bladder outlet obstruction in patients with locally advanced prostate cancer[J]. J Urol,2005,173(1):324-325.
[13] 孙颖浩,许传亮,钱松溪,等. 经尿道前列腺电切治疗前列腺癌(附47例报告)[J]. 中华泌尿外科杂志,1998,19(9):534-536.
[14] Marszalek M, Ponholzer A, Rauchenwald M, et al. Palliative transurethral resection of the prostate: Functional outcome and impact on survival[J]. BJU Int,2007,99(1):56-59.
[15] 陶凌松,陶良俊,陈弋生,等. 晚期前列腺癌伴膀胱出口梗阻TURP 或α1A 受体阻滞剂联合内分泌治疗的疗效分析[J]. 中华男科学杂志,2015,21(7) :626-629.
[16] Beer TM, Miller K, Tombal B, et al. The association between health-related quality-of-lifescores and clinical outcomes in metastatic castration-resistant prostate cancer patients: Exploratory analyses of AFFIRM and PREVAIL studies[J]. Eur J Cancer,2017,87:21-29.
[17] Gupta D, Braun DP, Staren ED. Prognostic value of changes in quality of life scores in prostate cancer[J]. BMC Urol,2013,13:32.
[18] Sullivan PW, Nelson JB, Mulani PM,et al. Quality of life as a potential predictor for morbidity and mortality in patients with metastatic hormone-refractory prostate cancer[J]. Qual Life Res,2006,15(8):1297-1306.
[19] 张凯,龚侃,周利群,等. 晚期前列腺癌患者生活质量评估FACT—P问卷调查[J]. 中华医学杂志,2008,88 (10):665-668.
[20] Sood R, Singh RK, Goel H, et al. Can androgen-deprivation therapy obviate the need of channel transurethral resection of the prostate in advanced prostate cancer with urinary retention? A prospective study[J]. AJU,2017,15(4):339-346.
