PA-MSHA和吡柔比星膀胱灌注治疗的对比分析
2018-06-04张中沛刘清源王灵点段小雨刘闯孙春山丁德刚
张中沛 刘清源 王灵点 段小雨 刘闯 孙春山 丁德刚
膀胱癌是泌尿系统最常见的恶性肿瘤,位居我国泌尿生殖系统肿瘤发病率第一,在西方国家其发病率居第二位,仅次于前列腺癌[1]。膀胱癌任何年龄均可发生,且发病率随年龄的增长而增加。目前膀胱癌的治疗方法主要为手术治疗,可根据肿瘤的临床分期、病理分级以及患者的一般情况,选择较为合适的手术方式。然而单纯行经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor, TURBT)术后膀胱肿瘤的复发率高,故非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer, NMIBC)通常采取的治疗方式为TURBT结合膀胱灌注化疗,以降低其术后复发率。本文主要探讨TURBT后行铜绿假单胞菌-甘露糖敏感血凝菌毛株(pseudomonas aeruginosa-mannose sensitive hemagglutinin, PA-MSHA)及吡柔比星(Pirarubicin, THP)膀胱灌注治疗的疗效及不良反应的比较。
对象与方法
一、一般资料
选取2012年11月至2017年3月河南省人民医院行TURBT的非肌层浸润性膀胱尿路上皮癌患者91例,其中男53例,女38例。入组标准:①行膀胱镜检查后活检提示为NMIBC,行TURBT术,术后病理结果证实为NMIBC,与活检结果一致;②无过敏史;③无其他系统肿瘤史、无化疗药物使用史;④一般情况良好;⑤患者及家属签署知情同意书。排除标准:①浸润性膀胱肿瘤患者;②复发的浅表性膀胱肿瘤患者;③有其他肿瘤史、有使用化疗药物病史;④因各种原因不能行TURBT手术者;⑤有药物过敏史;⑥合并严重的肾、肝、心等脏器功能不全或者有泌尿系统感染;⑦患者不能够配合治疗、依从性差者。根据膀胱灌注药物的不同分为实验组(PA-MSHA)41例和对照组(THP)50例。其中实验组24例男性患者,17例女性患者,中位发病年龄(65±16)岁,肿瘤数目3个29例,>3个12例;临床分期:Ta期17例,T1期24例;病理分级:G1级8例,G2级21例,G3级12例;对照组29例男性患者,21例女性患者,中位发病年龄为(68±15)岁,肿瘤数目3个36例,>3个14例;临床分期:Ta期18例,T1期32例;病理分级:G1级11例,G2级28例,G3级10例。两组患者的年龄、性别比例、临床分期等一般资料比较差异均无统计学意义(P>0.05)。
二、药品及器材
实验组采用的药品为北京万特尔生物制药有限公司生产的铜绿假单胞菌注射液,1 ml/支,商品名为万特普安,生产批号:国药准字S20043022。对照组采用的药品为注射用盐酸吡柔比星,10 mg/瓶,生产厂商:深圳万乐药业有限公司,生产批号:国药准字H10930105。所有患者灌注时使用的尿管均为同一品牌大小适合患者的三腔尿管。
三、方法
实验组在行TURBT后24 h内,采用PA-MSHA 10 ml常温溶于生理盐水40 ml,经尿管进行膀胱灌注治疗,使药物在膀胱内保留30 min左右,保留一段时间改变体位,行左侧卧位、右侧卧位、仰卧位和俯卧位,每个体位保持相同的时间,保证药物灌注整个膀胱。灌注周期:每周灌注1次,8次后改为每月灌注1次,灌注总时间为1年。对照组在行TURBT后24 h内,采用THP 30 mg溶于50 ml注射用水,经尿管行膀胱灌注治疗,使药物在膀胱内保留30 min左右,保留一段时间改变体位,行左侧卧位、右侧卧位、仰卧位和俯卧位,每个体位保持相同的时间,保证药物灌注整个膀胱。灌注周期:每周灌注1次,8次后改为每月灌注1次,灌注总时间为1年。
四、随访与观察
观察每例患者在整个灌注过程中的不良反应及肿瘤复发情况。患者每3个月行血常规、肝肾功能、心电图、泌尿系超声及膀胱镜检查,了解每次灌注后患者膀胱刺激症状、血尿、胃肠道反应、发热及心脏情况,白细胞、肝肾功能变化及膀胱癌复发的情况、复发时间、后续治疗等,随访终点为2018年3月20日,中位随访时间25个月。
五、统计学方法
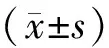
结 果
一、两组不良反应的比较
实验组41例患者,其中发生急性膀胱炎3例,血尿3例,发热2例,胃肠道反应1例,不良反应发生率为21.95%(9/41)。对照组50例患者,发生急性膀胱炎8例,血尿5例,发热5例,胃肠道反应3例,不良反应发生率为42.00%(21/50)。两组中均未出现肝肾功能损伤的患者。两组不良反应发生率比较差异有统计学意义(χ2=4.098,P=0.043)。
二、两组复发率的比较
实验组复发例数为10例,术后6个月复发3例,术后12个月复发5例,术后24个月复发2例,总复发率为24.39%(10/41);对照组复发例数为11例,术后6个月复发6例,术后12个月复发4例,术后24个月复发1例,总复发率为22.00%(11/50)。两组复发率比较差异无统计学意义(χ2=0.031,P=0.860)。
讨 论
在泌尿系统恶性肿瘤中,膀胱癌的发病率居前列,且大多数为浅表性、低级别,常规的治疗方式为手术治疗,但是单纯手术的患者术后复发率较高,且相关的研究表明,有10%~20%的浅表性癌患者复发时转为浸润性癌,这是由于膀胱癌经常表现为多中心性或者多灶性生长从而导致新的肿瘤生长,而行TURBT中肿瘤细胞的残留或者是脱落种植于膀胱表面进而导致膀胱癌的复发[2]。对于患有膀胱癌的患者,从理论上讲,只要不切除膀胱,肿瘤就有复发的可能,通常复发的主要因素包括原发肿瘤未切除干净、TURBT术中肿瘤细胞的脱落种植、膀胱内原有的移行上皮增殖或发生非典型病变、膀胱上皮继续受尿液内致癌物质的刺激等[3]。一般认为不进行膀胱内灌注治疗,患者的3年肿瘤复发率高达50%~70%[4]。TURBT术后的膀胱灌注治疗对于NMIBC来说是术后重要的辅助治疗手段,Witjes等[5]的研究认为:TURBT术后的膀胱灌注治疗能有效降低NMIBC的短期复发率。目前用于膀胱灌注治疗的药物主要有两种,一种为具有细胞毒性的化疗药物,另一种为免疫抑制剂。Lamm等[6]在一项研究中证实,膀胱内灌注治疗可将肿瘤复发的短期发生率降低15%~18%,但5年后,患有肿瘤复发的患者数量与仅接受手术治疗的患者数量相当。通常认为,膀胱癌TURBT术后灌注药物浓度与其抗肿瘤效果具有正相关性,而与不良反应发生率同样呈正相关性。因此,根据患者的个体差异选择适合患者的药物剂量和合理灌注方案尤为重要。理想的灌注药物具有在膀胱上皮内达到有效的药物浓度、肿瘤细胞的高敏感性、药物血液浓度低、不良毒副作用小等特点。
PA-MSHA是由中国微生物学家穆希亚教授建立的一种MSHA毛细血管周围PA菌株[7]。PA-MSHA除保留自然界铜绿假单胞菌的完整菌体以外,还具有周身密布的1型菌毛。在过去的二十年中,PA-MSHA在中国已被用作胃癌、乳腺癌、肺癌和恶性淋巴瘤患者的辅助治疗,以降低与化学疗法相关的感染率,并提高化疗的敏感性、机体的免疫功能和患者的生活质量[8-9]。另有相关研究表明,经过热灭活的PA-MSHA可以通过激活树突细胞、单核细胞、抗原呈递细胞和NK细胞,用于佐剂来触发幼稚免疫反应。PA-MSHA使得细胞因子诱导的杀伤细胞(cytokine induced killer, CIK)中活化相关标志物的表达发生改变,使促炎性细胞因子γ-干扰素和IL-2增加,而抑制性细胞因子IL-10下调,使CIK细胞具有更高的活化能力[10],从而抑制肿瘤细胞的增殖。对于膀胱癌而言,PA-MSHA可以抑制膀胱癌细胞的增殖并诱导其细胞凋亡[11],同时也可以诱导M1巨噬细胞极化,增强其吞噬作用,从而抑制肿瘤生长同时也抑制膀胱细胞增殖[12]。
THP又名吡喃阿霉素,是蒽环类抗肿瘤药物,于多柔比星氨基糖的4位上加上四氢吡喃基,结构的改变使其抗癌性提高[13-14],能够快速进入癌细胞中,阻止其DNA的复制和转录[15],使肿瘤细胞无法进入分裂期。国内有学者[16]借助THP的蒽环能发出荧光的特性,通过荧光显微镜观察膀胱黏膜对THP的吸收情况,发现膀胱内灌注THP患者的正常膀胱组织内基本观察不到THP,而在膀胱癌组织内却可以观察到大量THP,且吸收迅速。可能的原因为THP是分子数较高的化疗药物,正常膀胱黏膜无法吸收,而在膀胱癌组织中,黏膜的正常结构遭到破坏,导致通透性改变,从而使THP容易被膀胱癌组织吸收。我国学者沈善林等[17]的相关研究证实,盐酸吡柔比星膀胱内保留灌注30 min为临床最佳方案。
我们选取TURBT术后行膀胱灌注的患者,灌注不同的药物(PA-MSHA和THP),并对灌注后患者的不良反应发生率、肿瘤复发率进行随访及比较分析。结果表明,PA-MSHA和THP均可以降低TURBT术后的浅表性膀胱癌的复发率,两者疗效差异无统计学意义,但两者不良反应的发生率存在差异,实验组PA-MSHA的不良反应发生率为21.95%(9/41),其中急性膀胱炎3例、血尿3例、发热2例、胃肠道反应1例,对照组THP的不良反应发生率为42.00%(21/50),其中急性膀胱炎8例、血尿5例、发热5例、胃肠道反应3例。值得注意的是,两组中均未发现肝肾功能损伤、神经毒性的病例。另对照组有1例患者多次灌注后出现排尿困难,可能的原因为该患者出院后进行膀胱灌注治疗时,灌注操作不规范,将药物经尿管注入膀胱后直接将尿管拔出,使药物经尿道而非尿管流出体外,引起尿道损伤。尿道损伤的原因可能由于灌注药物THP有效膀胱灌注浓度对于尿道黏膜刺激性较大引起。
由于本研究中选取病例仅限于河南省人民医院,病例数较少,可能存在个体变异、选择偏倚等原因,导致研究结果存在偏差。
TURBT联合膀胱灌注治疗方法使膀胱癌患者避免了开放手术及全身化疗、放疗,提高了患者的术后生活质量,各种灌注药物的出现也给了患者更大的选择空间。目前各种灌注药物中,有效性高、不良反应发生率低的灌注药物更容易受到医生及患者的青睐。PA-MSHA膀胱灌注的疗效与THP无明显差异,不良反应发生率低,是目前较为良好的灌注药物选择。该药的多重抗癌机制,不仅仅对于降低膀胱癌的复发有较好的作用,对于其他系统肿瘤也同样有效。
[1] 张万生,王立国,郭彬彬,等. 修复基因XRCC4多态性与膀胱癌易感性的Meta分析[J]. 现代泌尿外科杂志,2016,21(9):676-680.
[2] Meyer JP, Persad R, Gillatt DA. Use of bacille Calmette-Guérin in superficial bladder cancer[J]. Postgrad Med J,2002,78(922):449-454.
[3] Kuroda M, Niijima T, Kotake T, et al. Effect of prophylactic treatment with intravesical epirubicin on recurrence of superficial bladder cancer--The 6th Trial of the Japanese Urological Cancer Research Group (JUCRG): a randomized trial of intravesical epirubicin at dose of 20mg/40ml, 30mg/40ml, 40mg/40ml[J]. Eur Urol,2004,45(5):600-605.
[4] 钱本江,李惠长. 吡柔比星与丝裂霉素膀胱灌注预防人膀胱癌复发比较的Meta分析[J]. 国际外科学杂志,2007,34(5):294-296.
[5] Witjes JA, Hendricksen K. Intravesical pharmacotherapy for non-muscle-invasive bladder cancer: a critical analysis of currently available drugs, treatment schedules, and long-term results[J]. Eur Urol,2008,53(1):45-52.
[6] Lamm DL. Long-term results of intravesical therapy for superficial bladder cancer[J]. Urol Clin North Am,1992,19(3):573-580.
[7] Mu XY. Success in establishing the MSHA-positive Pseudomonas aeruginosa fimbrial strain[J]. Wei Sheng Wu Xue Bao,1986,26(2):176-179.
[8] Li Z, Hao D, Zhang H, et al. A clinical study on PA-MSHA vaccine used for adjuvant therapy of lymphoma and lung cancer[J]. Hua Xi Yi Ke Da Xue Xue Bao,2000,31(3):334-337.
[9] Chen WD, Tang ZH, Xu F. Application of PA-MSHA vaccine adjuvant therapy and TAC scheme for treatment of breast carcinoma[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2009,29(6):1204-1207.
[10] Zhang C, Zhang Z, Wang L, et al. Pseudomonas aeruginosa-mannose sensitive hemagglutinin injection treated cytokine-induced killer cells combined with chemotherapy in the treatment of malignancies[J]. Int Immunopharmacol,2017,51:57-65.
[11] Zhu YP, Bian XJ, Ye DW, et al. Pseudomonas aeruginosa-mannose-sensitive hemagglutinin inhibits proliferation and induces apoptosis in a caspase-dependent manner in human bladder cancer cell lines[J]. Oncol Lett,2013,5(4):1357-1362.
[12] Liu J, Duan X. PA-MSHA induces apoptosis and suppresses metastasis by tumor associated macrophages in bladder cancer cells[J]. Cancer Cell Int,2017,17:76.
[13] Umezawa H, Takahashi Y, Takeuchi T, et al. The absolute structures of THP-adriamycins.[J]. J Antibiot (Tokyo),1984,37(9):1094-1097.
[14] Tsuruo T, Iida H, Tsukagoshi S, et al. 4'-O-tetrahydropyranyladriamycin as a potential new antitumor agent[J]. Cancer Res,1982,42(4):1462-1467.
[15] Zheng SE, Xiong S, Lin F, et al. Pirarubicin inhibits multidrug-resistant osteosarcoma cell proliferation through induction of G2/M phase cell cycle arrest[J]. Acta Pharmacol Sin,2012,33(6):832-838.
[16] 李清,徐涛,王晓峰. 吡柔比星膀胱内灌注预防非肌层浸润性膀胱尿路上皮癌复发的机制[J]. 中华肿瘤杂志,2009,31(12):904-907.
[17] 沈善林,刘佃成,于江,等. 三种吡柔比星膀胱灌注保留时间的临床疗效比较研究[J]. 临床泌尿外科杂志,2014,29(11):971-973.
