介孔SiO2/PPy复合微球对布洛芬的负载与释放研究
2018-06-04乔永生沈腊珍
李 贝, 乔永生, 沈腊珍, 王 伟
(1. 山西大同大学 化学与环境工程学院, 山西 大同 037009; 2. 忻州师范学院 化学系, 山西 忻州 034000;3. 北方自动控制技术研究所, 山西 太原 030006)
0 引 言
布洛芬(IBU)作为一种非甾体烷基苯丙酸类抗炎药, 可通过抑制环氧酶的活性, 从而抑制前例腺素的合成和疼痛的生理信号, 常用于减轻疼痛、 炎症和发热[1-2]. 目前, 已用于各种疾病治疗, 如:动脉导管未闭, 类风湿性关节炎, 囊性纤维化, 立体性低张力, 牙痛, 痛经, 发热, 头痛, 阿尔茨海默病, 帕金森病及乳房炎等. 同时, IBU具有较好的药理活性, 分子尺寸为0.6~1 nm适合放置在无机介孔材料的介孔中[3]. 但其生物半衰期短(1~3 h)[1], 需要频繁给药, 会产生毒副作用且其水溶性差, 高剂量口服后会刺激胃肠道造成广谱胃肠道副作用, 轻度消化不良进一步导致胃出血, 使IBU服用量受到限制. 因此, 需使用药物传递体系通过肠外途径直接将IBU送至感染部位, 使毒副作用最小化[4].
目前已研究出各种IBU控释给药系统, 如磁性纳米粒子载药体系可在外磁场作用下直接将药物输送到靶向位点处[5]; 石墨烯基药物传递体系具有较大表面积可负载大量药物, 且其基底表面和边缘具有许多官能团使其易于分散在水中和生理环境中[6], 可用于一些水不溶性药物的传递并实现pH响应药物释放; 金属-有机骨架纳米复合物、 聚合物纳米粒子、 TiO2纳米粒子及介孔二氧化硅纳米粒子、 聚吡咯微球, 以及这些纳米粒子构成的复合微球同样可用于IBU药物控释体系[7-10]. 其中, 介孔二氧化硅纳米粒子具有无毒性, 生物相容性, 化学稳定性, 对氧化反应具有惰性, 表面具有大量羟基可为进一步修饰及IBU等药物负载提供连接位点, 药物也可嵌入到其介孔腔中, 从而提高载药量并减缓药物释放速率; 且其制备方法简易, 以正硅酸乙酯为硅源通过Stöber法即可直接获得. 聚吡咯作为一种有机聚合物光热剂的较高的光热转换效率, 优异的热稳定性, 电导率高, 生物相容性好且具有生物可降解性, 其骨架上的氨基可用于连接治疗试剂来实现药物传递. 同时, 吡咯单体通过简单的原位化学聚合或电化学聚合后即可得到聚吡咯粒子. 将介孔二氧化硅与聚吡咯结合后可获得多功能IBU药物控释体系, 相比于单一纳米粒子药物载体, IBU不仅可通过氢键作用负载在介孔二氧化硅上, 同时聚吡咯涂层上的氨基也可为药物提供连接位点, 使载药量提高; 而且聚吡咯涂层的修饰使负载在mSiO2上的药物释放途径延长, 可减缓药物释放速率, 实现药物缓释, 并延长药物半衰期, 降低毒副作用, 同时深入研究聚吡咯涂层的光热转化能力及热疗效果, 还可以获得具有高载药量及缓慢药物释放能力的多功能药物载体.
本文首先通过胶束聚集模板法合成介孔二氧化硅粒子, 再通过未使用任何表面活性剂的水热法进行聚吡咯涂层的修饰, 获得介孔二氧化硅/聚吡咯复合微球. 采用SEM、 XRD、 FT-IR对产物的形貌、 物相、 结构与化学成分进行表征, 并研究其对布洛芬药物的负载能力以及在pH= 7.4的磷酸氢二钠-磷酸二氢钠缓冲溶液中的药物释放行为.
1 实验方法
1.1 试剂与仪器
溴化(-)-N-十二基-N-甲基麻碱(DMEB), 羧基乙基硅烷三醇钠盐(25wt%)水溶液(CSS), 氢氧化钠, 正硅酸乙酯(TEOS), 无水乙醇, 过硫酸铵(APS), 吡咯, 十二水合磷酸氢二钠, 二水合磷酸二氢钠, 布洛芬(IBU), 所有药品均为分析纯. 主要仪器有: TESCAN MAIA 3 LMH型高分辨率扫描电子显微镜(捷克), 德国Burker公司D8 Focus X射线衍射仪, FTIR-650傅里叶变换红外光谱仪, 德国SPECORD 210 PLUS 紫外可见分光光度计.
1.2 介孔二氧化硅(mSiO2)粒子的制备
通过胶束聚集模板法制备介孔二氧化硅(mSiO2)[11]. 将1 500 μL 浓度为0.125 mol·L-1的NaOH与40 mL的蒸馏水混合, 并加入10 mL浓度为7.8 mmol·L-1的溴化(-)-N-十二基-N-甲基麻碱水溶液和20 μL 的羧基乙基硅烷三醇钠盐(25wt%)水溶液CSS, 室温下机械搅拌1 h. 之后逐滴加入300 μL 的TEOS继续搅拌反应8 h. 分离沉淀用蒸馏水和无水乙醇交替冲洗几次, 并在60℃的烘箱中干燥4 h, 得到白色的mSiO2粒子研磨后用于下一步反应.
1.3 介孔二氧化硅/聚吡咯(mSiO2/PPy)复合微球的制备
采用未使用任何表面活性剂的水热法进行聚吡咯涂层的修饰[12]. 称取上述制备的mSiO2粒子10 mg放入20 mL蒸馏水中, 超声2 min后使其溶解. 加入100 μL的新鲜吡咯(使用前蒸馏并保存在4℃的棕色瓶中), 搅拌1 h后转移到反应釜中, 并逐滴加入预先配制的过硫酸铵(APS)水溶液 (1 g APS放入10 mL蒸馏水中), 140 ℃下水热反应8 h. 自然冷却, 用蒸馏水和乙醇交替冲洗几次后, 空气干燥, 得到黑色的mSiO2/PPy复合微球.
1.4 布洛芬(IBU)的负载与释放研究
考虑到安全性选用乙醇作为溶剂, 进行布洛芬(IBU)药物负载. 将7 mg上述获得的 mSiO2/PPy 微球放入17.5 mL浓度为1 mg/mL的布洛芬/乙醇溶液中, 室温下机械搅拌进行药物负载. 24 h后静置吸取上清液并用一定量乙醇清洗, 用紫外可见分光光度计测上清液及清洗液中残余的IBU浓度间接计算药物负载量. 将得到的载药mSiO2/PPy微球室温下空气干燥用于药物释放研究. 通过式(1)~(3)分别计算总载药量、 包封率及载药率.
总载药量=C0V0-C1V1-C2V2,
(1)
式中:C0,C1和C2分别为药物的初始浓度及上清液、 清洗液中的药物浓度, mg/mL;V0,V1和V2分别为药物的初始体积及上清液、 清洗液的体积, mL.
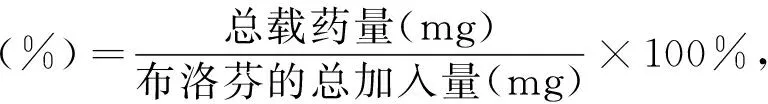
(2)

(3)
在pH=7.4的0.2 mol·L-1磷酸氢二钠-磷酸二氢钠缓冲溶液中进行IBU药物释放. 将上述干燥后的载药复合微球置于25 ml pH=7.4的0.2 mol·L-1磷酸氢二钠-磷酸二氢钠缓冲溶液中, 搅拌作用下进行药物释放. 每间隔一段时间移取一定量上清液, 并加入等量的新鲜缓冲溶液保持体积恒定. 用紫外可见分光光度计测定药物随时间的释放量变化, 得到pH=7.4条件下的药物释放曲线. 通过式(4)计算t时刻的累积药物释放率

(4)
2 结果与讨论
2.1 机理分析
本文首先通过胶束聚集模板法合成介孔二氧化硅, 其中溴化(-)-N-十二基-N-甲基麻碱是一种双子表面活性剂作为软模板, 羧基乙基硅烷三醇钠盐作为助结构导向剂. 当DMEB浓度处于7.8 mmol·L-1以下时, 易于形成小的胶束聚集体, 加入CSS后通过静电相互作用可进一步稳定胶束聚集体结构. 同时, 加入的正硅酸乙酯在碱性条件下快速水解缩合, 并迅速聚集在胶束聚集体周围, 形成介孔壳层结构, 进一步生长获得介孔二氧化硅粒子. 第二步中, 通过未使用任何表面活性剂的水热法进行聚吡咯壳层的修饰. 在搅拌作用下吡咯单体首先吸附在mSiO2粒子表面, 加入氧化剂过硫酸铵后, 在水热条件下, 吡咯单体聚合形成聚吡咯并进一步生长形成聚吡咯外壳, 从而得到mSiO2/PPy复合微球.
2.2 SEM分析
图 1 给出了mSiO2纳米粒子和mSiO2/PPy复合微球的SEM图. 由图 1(a) 可以看出, 所得到的mSiO2纳米粒子为形状规则的球形且粒径均匀, 尺寸在120±30 nm. 由图 1(b) 可以看出, 所得到的mSiO2纳米粒子表面具有孔径为2~3 nm均匀的小孔, 进一步证实了所得到的SiO2纳米粒子为介孔材料. 由图 1(c) 可以看出, mSiO2/PPy复合微球粒子表面变得光滑, 表面介孔消失且尺寸增大到150~250 nm, 表明聚吡咯涂层成功地修饰在mSiO2纳米粒子表面.
同时, 可观察到聚吡咯涂层均匀地包覆在一个或多个mSiO2纳米粒子表面, 获得了mSiO2/PPy复合微球. 这些结果均表明合成了具有介孔二氧化硅纳米粒子内核, 聚吡咯外壳的mSiO2/PPy复合微球.

图 1 样品的SEM图Fig.1 SEM images of samples
2.3 XRD分析
图 2 为mSiO2纳米粒子和mSiO2/PPy复合微球的XRD图, 图谱中均出现非晶态包峰. 在图 2(a) 中, 15°~39°间出现明显的包峰, 表明无定形非晶态mSiO2纳米粒子的存在[13]. 图2(b)中包峰的范围发生微弱的变化 (16°~38°), 证实了非晶态聚吡咯涂层的成功包覆使粒子尺寸发生较小变化, 从而使峰宽略微变窄. 这些结果与SEM表征相一致, 均表明 mSiO2/PPy 复合微球的形成.
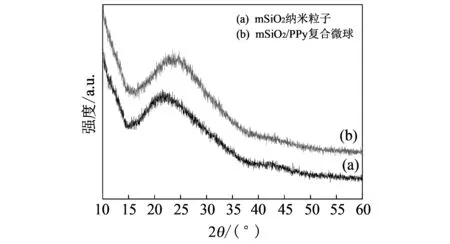
图 2 样品的XRD图Fig.2 XRD patterns of samples
2.4 FT-IR分析
为进一步证实产物的结构信息和化学成分进行了红外光谱分析, 图 3 中给出了mSiO2纳米粒子和mSiO2/PPy复合微球的FTIR图. 所有样品中, 3 432 cm-1和3 158 cm-1处为吸附水中-OH的非对称伸缩振动峰, 而-OH的弯曲伸缩振动峰均处于1 635 cm-1[14], 1 401 cm-1处出现的衍射峰为所用模板中的C-C伸缩振动[15].
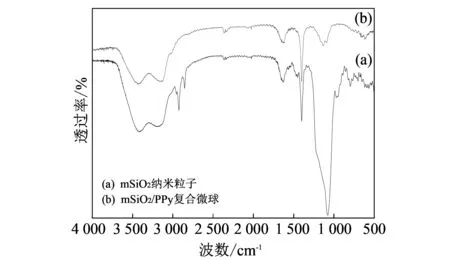
图 3 样品的FTIR图Fig.3 FTIR spectra of samples
在图 3(a) 中, 458 cm-1处为Si-O弯曲振动峰, 798 cm-1和1 078 cm-1处分别为Si-O-Si对称伸缩振动和非对称伸缩振动[16]. 同时, Si-OH中硅醇基团伸缩振动出现在951 cm-1[14]处, 这些结果均表明mSiO2纳米粒子的形成. 图 3(b) 中, 781 cm-1处为聚吡咯环中C-H面外弯曲振动, 850 cm-1处的新衍射峰为C-H面外变形振动[17]. 在mSiO2/PPy复合微球中, 1 078 cm-1处的Si-O-Si非对称伸缩振动峰变弱, 这是由于在1 135 cm-1和1 088 cm-1处均存在聚吡咯的C-H面内变形振动[17]. 1 560 cm-1处为吡咯环伸缩振动峰, C-N伸缩振动峰出现在1 314 cm-1处. 1 635 cm-1和3 432 cm-1处的衍射峰变得尖锐, 这可归因于在这两处分别存在聚吡咯的C=C拉伸振动和N-H拉伸振动[1]. 这些结果均证实了在所得到的复合微球中存在mSiO2和PPy.
2.5 药物负载与释放性能
本文采用传统的非甾体抗炎药布洛芬作为药物模型, 研究所形成的mSiO2/PPy复合微球的药物负载与释放行为. 使用乙醇作为溶剂进行药物负载, 由于其相比于布洛芬的其他良溶剂如正己烷毒性、 挥发性均变小且与人体的生理环境相似[18]. 研究表明, 相比于Kurczewska等人制备的载药量仅为182.72 mg/g的树枝状聚合物功能化的埃洛石纳米管药物载体和Gao等人制备的具有250 mg/g载药量的介孔硅酸盐药物传递体系[8,18], mSiO2/PPy复合微球的总载药量可提升到534.28 mg/g, 包封率可达21.34%, 载药率明显提高至53.35%.
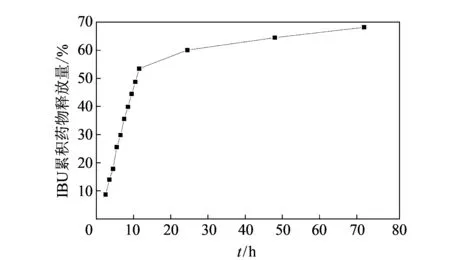
图 4 mSiO2/PPy复合微球的IBU药物释放曲线Fig.4 IBU drug release curve of mSiO2/PPy composite microspheres
在pH=7.4的0.2 mol·L-1磷酸氢二钠-磷酸二氢钠缓冲溶液中进行药物释放 (7.4 为人体体液的pH值), 研究所形成的复合微球的药物释放行为. 图 4 为载药mSiO2/PPy复合微球在 pH=7.4 的缓冲液中的药物释放行为, 研究表明, 在前12 h内药物释放速率较快, 累积药物释放量可达54%. 随后的60 h内药物释放量仅为14%, 最终获得68%的药物释放量. 这是由于在初始阶段, 吸附在复合粒子表面的药物可快速释放, 接下来为通过氢键相连的药物释放, 随后嵌入在mSiO2介孔腔中的药物缓慢释放, 使药物释放速率逐步减慢, 对负载的IBU药物产生缓释作用. 同样, 所制备的mSiO2/PPy复合微球也可作为其他抗炎、 抗癌药物载体, 以实现药物的缓慢释放.
3 结 论
本文首先通过胶束聚集模板法合成了粒径为120±30 nm 的mSiO2纳米粒子, 形貌均一且其表面具有均匀的介孔. 然后, 采用未使用任何表面活性剂的水热法在mSiO2纳米粒子表面进行聚吡咯涂层的包覆, 获得了尺寸处于150到250 nm 之间的表面光滑的mSiO2/PPy复合微球. 采用SEM, XRD和FT-IR等表征手段对所合成的产物进行了形貌, 物相和化学成分及结构信息的分析. 研究了mSiO2/PPy复合微球对IBU的负载能力, 其载药率可提升至53.35%, 这可能是由于其不但具有大表面积的聚吡咯外壳, 而且内核mSiO2拥有介孔腔也可为药物提供连接位点. 在pH=7.4的缓冲溶液中, 68%的药物可在72 h内释放, 并实现了持续药物释放. 这些结果表明, 此复合微球可作为优异的药物控释载体, 也可用于负载其他抗炎、 抗癌等药物. 还可进一步研究聚吡咯壳层的光热转化性能, 及此复合微球在体内的药物释放行为.
参考文献:
[1] Kamari Y, Ghiaci M. Preparation and characterization of ibuprofen/modified chitosan/TiO2hybrid composite as a controlled drug-delivery system[J]. Micropor. Mesopor. Mat., 2016(234): 361-369.
[2] 平文卉, 周楠, 陈建忠, 等. Fe3O4/羧甲基-羟丙基-β-环糊精聚合物磁性纳米材料固相萃取分离-紫外-可见联用分析槲皮素[J]. 中国卫生检验杂志, 2016, 26(1): 16-19.
Ping Wenhui, Zhou Nan, Chen Jianzhong, et al. Analysis of quercetin with Fe3O4/carboxymethyl-hydroxypropyl-β-cyclodextrin polymer magnetic nanoparticles solid phase extraction coupled with UV-vis spectrometry[J]. Chin. J. Health Lab. Tec., 2016, 26(1): 16-19. (in Chinese)
[3] Tang C, Guan Y X, Yao S J, et al. Preparation of ibuprofen-loaded chitosan films for oral mucosal drug delivery using supercritical solution impregnation[J]. Int. J. Pharmaceut., 2014(473): 434-441.
[4] Jarosz M, Pawlik A, Szuwarzyński M, et al. Nanoporous anodic titanium dioxide layers as potential drug delivery systems: drug release kinetics and mechanism[J]. Colloid. Surface. B, 2016(143): 447-454.
[5] Sasidharan M, Luitel HN, Gunawardhana N, et al. Synthesis of magneticα-Fe2O3and Fe3O4hollow nanospheres for sustained release of ibuprofen[J]. Mater. Lett., 2012(73): 4-7.
[6] Ribeiro L N M, Alcntara A C S, Darder M, et al. Bionanocomposites containing magnetic graphite as potential systems for drug delivery[J]. Int. J. Pharmaceut, 2014(477): 553-563.
[7] Nadizadeh Z, Naimi-Jamal M R, Panahi L. Mechanochemical solvent-free in situ synthesis of drug-loaded {Cu2(1,4-bdc)2(dabco)}nMOFs for controlled drug delivery[J]. J. Solid State Chem., 2018(259): 35-42.
[8] Kurczewska J, Cegowski M, Messyasz B, et al. Dendrimer-functionalized halloysite nanotubes for effective drug delivery[J]. Appl. Clay Sci., 2018(153): 134-143.
[9] Pawlik A, Jarosz M, Syrek K, et al. Co-delivery of ibuprofen and gentamicin from nanoporous anodic titanium dioxide layers[J]. Colloid. Surface. B, 2017(152): 95-102.
[10] Jadhav S A, Brunella V, Scalarone D, et al. Poly(NIPAM-co-MPS)-grafted multimodal porous silica nanoparticles as reverse thermoresponsive drug delivery system[J]. Asian J. Pharm. Sci., 2017(12): 279-284.
[11] Feng Z, Li Y, Niu D, et al. A facile route to hollow nanospheres of mesoporous silica with tunable size[J]. Chem. Comm., 2008(23): 2629-2631.
[12] Liu X, Wu H, Ren F, et al. Controllable fabrication of SiO2/polypyrrole core-shell particles and polypyrrole hollow spheres[J]. Mater. Chem. Phys., 2008(109): 5-9.
[13] Bi Y, Xiao D, Ren S, et al. The binary system of ibuprofen-nicotinamide under nanoscale confinement: from cocrystal to coamorphous state[J]. J. Pharm. Sci., 2017(106): 3150-3155.
[14] Huang S, Fan Y, Cheng Z, et al. Magnetic mesoporous silica spheres for drug targeting and controlled release[J]. J. Phys. Chem. C, 2009(113): 1775-1784.
[15] Feng W, Zhou X, Nie W, et al. Au/polypyrrole@Fe3O4nanocomposites for MR/CT dual-modal imaging guided-photothermal therapy: an in vitro study[J]. Acs Appl. Mater. Interfaces, 2015, 7(7): 4354-4367.
[16] Xu Z, Li C, Kang X, et al. Synthesis of a multifunctional nanocomposite with magnetic, mesoporous, and near-IR absorption properties[J]. J. Phys. Chem. C, 2010(114): 16343-16350.
[17] Zhao H, Huang M, Wu J, et al. Preparation of Fe3O4@PPy magnetic nanoparticles as solid-phase extraction sorbents for preconcentration and separation of phthalic acid esters in water by gas chromatography-mass spectrometry[J]. J. Chromatogr. B, 2016(1011): 33-44.
[18] Gao L, Sun J, Zhang L, et al. Influence of different structured channels of mesoporous silicate on the controlled ibuprofen delivery[J]. Mater. Chem. Phys., 2012(135): 786-797.
