扶正解毒方对脓毒血症大鼠免疫系统调节作用的研究*
2018-06-02冯兴林郑佩君徐雪飞
黎 萍 冯兴林 郑佩君 徐雪飞
(浙江省衢州市人民医院,浙江 衢州 324000)
脓毒症(Sepsis)是指宿主对感染产生的失控反应,并出现危及生命器官功能障碍的临床综合征,是重症患者最常见的疾病之一,具有发病率高、死亡率高的特点[1]。目前针对脓毒症的病理生理机制研究主要集中在早期促炎与抗炎反应的动态失衡、凝血功能障碍、免疫抑制、细胞凋亡、细菌内毒素移位等方面,其中免疫系统失调与脓毒症的发生发展密切相关[2-3]。目前除胸腺肽、乌司他丁等药物外,临床上暂未出现特异性针对脓毒症治疗的药物。中药复方制剂具有多成分、多疗效、多靶点等特点,其在脓毒症的治疗中具有广泛的前景[4]。 扶正解毒方由连翘、生甘草、柴胡、拳参、黄芪、党参组成,具有解毒降浊、益气扶正等功效。本研究拟通过盲肠结扎穿孔术模拟脓毒症大鼠模型,探讨扶正解毒方对脓毒症大鼠免疫系统的调节作用,以期为脓毒症治疗药物的开发提供新的思路。现报告如下。
1 材料与方法
1.1 实验动物 健康昆明(KM)小鼠20只,雌雄各半,体质量 18~20 g,许可证编号:SCXK(京)2016-0001;成年 Sprague-Dawley(SD)雄性大鼠 50只,体质量180~230 g,许可证编号:SCXK(京)2016-0017,均购于北京华阜康生物科技股份有限公司。所有实验动物在实验前于标准SPF环境下,采用标准饮食喂养以适应环境1周。
1.2 试剂及仪器 扶正解毒方由本院中药制剂实验室自制[扶正解毒方包括连翘、生甘草、柴胡、拳参、黄芪、党参,常规煎制并浓缩成为100%药液[(相当于1 mL 药液中含生药量 1 g),批号:20170401];乌司他丁注射液购于广东天普生化医药股份有限公司(规格1 mL∶5 万 U,批号:20151104);注射液用氧氟沙星购于安徽省先锋制药有限公司(规格0.2 g,批号:20150315);ADVIA240全自动生化分析仪(德国西门子);CytoFLEX流式细胞仪(美国贝克曼库尔特)。
1.3 分组与造模 采用随机分组法将KM小鼠分为实验组与对照组,每组10只。实验组小鼠一次性灌胃给予扶正解毒方浓缩煎剂2000 mg/kg,对照组小鼠于同一时间段给予同等剂量生理盐水。给药后,两组大鼠均自由活动且给予标准饮食喂养,密切观察72 h内KM小鼠死亡率、精神状态、日常活动以及饮食情况。参考文献[5],制备脓毒症大鼠模型。将SD大鼠随机分为假手术组(n=10)与手术组(n= 40)。 腹腔注射10%水合氯醛诱导和维持大鼠麻醉,将大鼠仰卧固定后,在无菌操作下沿腹中线剪开约2 cm开口,找到盲肠后并小心分离出盲肠。在距盲肠末端约1/2处采用4号线结扎,并用14号针头在盲肠末端约0.5 cm处横穿插孔,来回贯穿两次,从针孔挤出少量肠内物。然后将盲肠复位,关腹。整个过程中应谨慎避免伤害肠系膜血管,以及避免肠内物感染手术切口。术前、术后均采用腹腔注射氧氟沙星25 mg/kg。术后每只大鼠皮下注射生理盐水(50 mg/kg)以补充体液。假手术组除不进行盲肠结扎以及穿孔外,余下操作同手术组。18 h后统计两组大鼠死亡率,结果手术组大鼠存活32只,假手术组大鼠存活8只。
1.4 给药方法 以假手术组大鼠作为对照组(n=8),手术组大鼠按随机数字表法分为模型组(n=11),扶正解毒方组(n=11),乌司他丁组(n=10)。各给药组灌胃剂量按照动物体表面积折算成等效剂量,扶正解毒方组给药剂量为20 mL/kg(腹腔注射),乌司他丁组给药剂量为1万U/kg(腹腔注射);对照组与模型组给予等量生理盐水。各组均每日给药1次,连续5 d。第5天给药前12 h所有动物均禁食不禁水,给药后2 h采用大鼠尾静脉取血5mL,肝素钠抗凝以备用。
1.5 标本采集与检测 取3 mL血样于3500 r/min,4℃下离心5 min,分离上清液得大鼠待测血清送于本院检验科采用ADVIA240全自动生化分析仪检测,检测指标包括白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、白细胞、中性粒细胞、降钙素原(PCT)、C 反应蛋白(CRP)。 取余下 2 mL 血样,加入红细胞裂解液后,于1500 r/min,4℃下离心5 min,弃其上清液,加入预冷的PBS清洗细胞2次,制备淋巴细胞悬液。采用流式细胞仪检测外周T淋巴细胞亚群CD4+、CD8淋巴细胞百分比及CD4+/CD8+的比值。
1.6 统计学处理 应用SPSS21.0统计软件分析。所有计量资料均以(±s)表示,空白组、模型组、给药组之间炎症因子水平、CD细胞亚群百分比及CD4+/CD8+比值比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠急性毒性实验 实验过程中,未观测到小鼠中毒死亡案例。与对照组小鼠相比,实验组小鼠在服药24 h内,进食量以及饮水量显著降低,日常活动量也显著减少,精神活跃程度下降,表现为闭眼、弓背、嗜睡、部分小鼠出现拉稀便、多尿现象。24 h后,给药组小鼠活动量逐渐增加,饮食量逐渐增多、拉稀便、多尿症状逐渐好转。72 h时观察两组小鼠在饮食、日常活动量、精神状态上已无明显差异,说明本院自制扶正解毒方不存在配伍禁忌,对小鼠无毒副作用。
2.2 各组脓毒症大鼠炎症因子水平比较 见表1。与对照组相比,模型组大鼠血清中IL-6、IL-10、TNF-α含量、白细胞数以及中性粒细胞数均显著升高,差异具有统计学意义(P<0.05)。与模型组比较,扶正解毒方组与乌司他丁组大鼠上述指标均显著下降(P<0.05)。
表1 各组大鼠血清中炎症因子水平比较(±s)
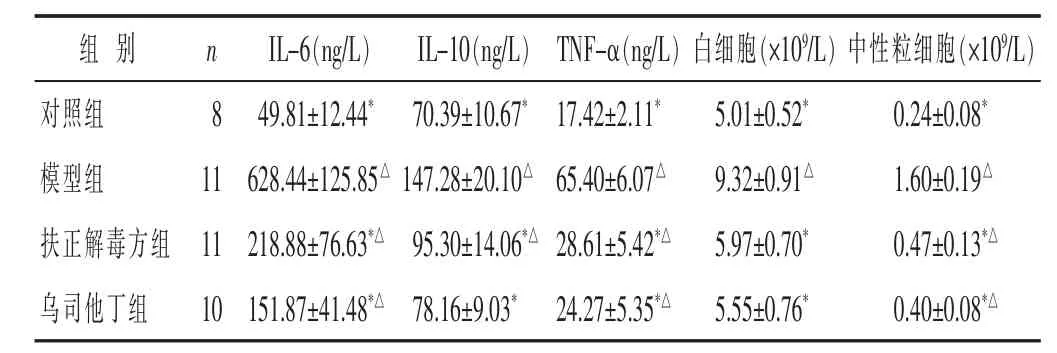
表1 各组大鼠血清中炎症因子水平比较(±s)
与模型组比较,*P<0.05;与对照组比较,△P<0.05。 下同。
组 别 n IL-6(ng/L) IL-10(ng/L) TNF-α(ng/L)白细胞(×109/L)中性粒细胞(×109/L)对照组 8模型组 11扶正解毒方组 11 49.81±12.44* 70.39±10.67*17.42±2.11*628.44±125.85△ 147.28±20.10△ 65.40±6.07△218.88±76.63*△ 95.30±14.06*△ 28.61±5.42*△5.01±0.52* 0.24±0.08*9.32±0.91△ 1.60±0.19△5.97±0.70* 0.47±0.13*△乌司他丁组 10151.87±41.48*△ 78.16±9.03* 24.27±5.35*△5.55±0.76* 0.40±0.08*△
2.3 各组脓毒症大鼠PCT、CRP含量比较 见表2。与对照组比较,模型组大鼠PCT、CRP含量均显著上升(P<0.05)。脓毒症大鼠服用扶正解毒方与乌司他丁后,两组大鼠血清中PCT、CRP含量均显著降低(P<0.05),但仍显著高于对照组(P<0.05)。
表2 各组大鼠血清中PCT、CRP含量比较(±s)

表2 各组大鼠血清中PCT、CRP含量比较(±s)
组 别 n PCT(ng/mL) CRP(μg/mL)对照组 8 73.46±11.08* 2.00±0.31*模型组 11 381.60±39.06△ 6.02±0.55△扶正解毒方组 11 297.80±26.50*△ 4.44±0.62*△乌司他丁组 10 218.73±35.20*△ 3.42±9.0.37*△
2.4 各组脓毒症大鼠CD细胞亚群比较 见表3。与对照组比较,模型组大鼠CD4+百分比下降,CD8+百分比升高,CD4+/CD8+比值小于1;给予脓毒症大鼠扶正解毒方与乌司他丁后,CD4+、CD8+百分比含量得到显著逆转,CD4+/CD8+比值大于1。
表3 各组大鼠CD4+、CD8+淋巴细胞百分比及CD4+/CD8+比值比较(±s)
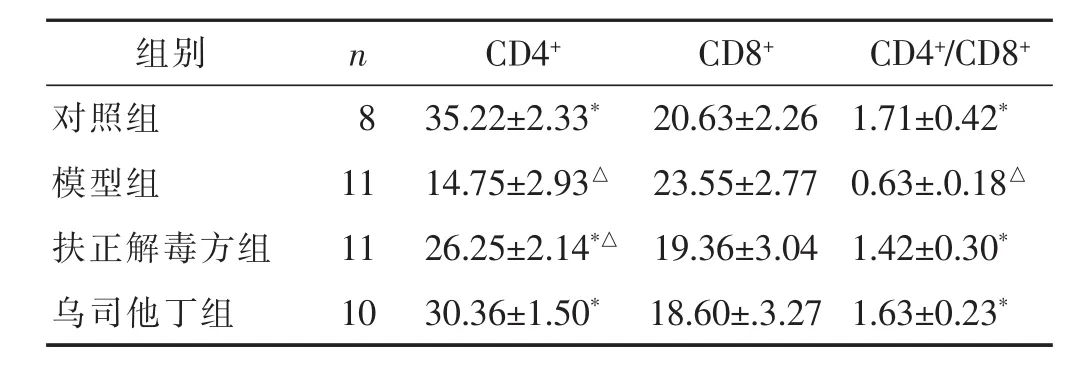
表3 各组大鼠CD4+、CD8+淋巴细胞百分比及CD4+/CD8+比值比较(±s)
组别 n CD4+ CD8+ CD4+/CD8+对照组 8模型组 11扶正解毒方组 11 35.22±2.33* 20.63±2.26 1.71±0.42*14.75±2.93△ 23.55±2.77 0.63±.0.18△26.25±2.14*△ 19.36±3.04 1.42±0.30*乌司他丁组 10 30.36±1.50* 18.60±.3.27 1.63±0.23*
3 讨 论
近年来研究表明,脓毒症患者血液中同时存在促炎细胞因子(如IL-6、TNF-α等)以及抗炎细胞因子(如IL-1、IL-10 等)水平增加,可引起机体免疫抑制[6-7]。 在脓毒症发生、发展过程中,患者的免疫状态处于免疫细胞过多激活和淋巴细胞受抑制的双向异常或紊乱状态、导致机体免疫失衡,产生大量有害因子,巨噬细胞抗原功能受损,最终患者导致多器官功能损伤[8]。因此,研究药物对脓毒血症患者免疫功能调节的影响以防止病情恶化,具有尤为重要的现实意义。
中医学认为脓毒症属于中医温病、伤寒的范畴,病因多为温热毒邪(如感染、中毒、休克等)蕴藏于体内,毒瘀互结是其基本病机,正气亏虚是其病理基础[9]。因此,针对脓毒症的治疗应以清热解毒、降浊化瘀为主,兼顾益气扶正。本研究所采用的扶正解毒方煎剂,方中连翘、生甘草具有清热利湿、解毒散结的功效,辅以柴胡拳参可凉血止血、降浊散瘀。另外黄芪配党参可益气固表、化瘀通络,祛风养血。在小鼠急性毒性试验中,可发现实验室自制的扶正解毒方对小鼠无毒副作用,口服安全剂量可高达2000 mg/(kg·d)。根据最大安全剂量以及预实验结果最终确定本研究中脓毒症大鼠的给药剂量为20 mL/kg。本研究中以乌司他丁作为阳性对照,参照已发表文献用法用量[10-11],确定本研究中以腹腔注射乌司他丁1万U/kg为给药剂量。
本研究结果显示,模型组大鼠血清中IL-6、IL-10、TNF-α等炎症因子水平以及白细胞、中性粒细胞计数均显著高于对照组大鼠。在给予扶正解毒方煎剂以及乌司他丁注射液后,脓毒症大鼠血清中上述指标较模型组大鼠均显著降低(P<0.05)。推测可能原因为扶正解毒方可有效抑制炎症因子的释放。王丁超等[12]在其研究中指出扶正败毒颗粒能够降低脓毒症大鼠白细胞以及中性粒细胞比例,与本研究结果一致。
PCT与CRP水平是临床中常用于评估感染严重程度的重要指标[13]。本研究结果显示,模型组大鼠血清中PCT、CRP含量显著高于对照组大鼠(P<0.05),说明脓毒症大鼠体内受到严重感染。给予扶正解毒方煎剂及乌司他丁治疗后,相关指标得到显著逆转(P<0.05)。正常情况下,甲状腺细胞产生PCT后经降解几乎不进入血液。在脓毒症大鼠体内,PCT降解过程会受到内毒素或细胞因子抑制从而使血液中PCT含量显著增加。同时在感染或组织损伤的机体中血浆内CRP含量将急剧上升[14]。 信淑珍等[15]对 160名脓毒症患者炎症因子水平与疾病严重程度的关系进行分析,研究结果表明脓毒症患者PCT、CRP水平均与疾病的严重程度呈正相关。由此说明,扶正解毒方可有效降低脓毒症大鼠体内PCT、CRP水平。
CD4+是T淋巴细胞亚群中发挥特异性免疫作用的主要成分,在免疫应答的全面调节中起关键性作用[16]。本研究结果显示,模型组大鼠CD4+T淋巴细胞百分比低于对照组,说明脓毒症大鼠免疫功能受到抑制,分别给予脓毒症大鼠扶正解毒方煎剂与乌司他丁后,脓毒症大鼠体内CD4+百分比显著升高,说明免疫功能逐渐恢复。通常采用CD4+/CD8+比值直接反映宿主淋巴细胞的紊乱状态。与对照组大鼠比较,模型组大鼠CD4+/CD8+比值显著降低,可说明模型组大鼠细胞免疫功能被显著抑制(P<0.05)。经扶正解毒方煎剂与乌司他丁给药后,CD4+/CD8+比值升高,且与对照组比较无显著差异。说明扶正解毒方可有效调节脓毒症大鼠的细胞免疫水平,有利于免疫平衡的恢复,且效果与乌司他丁类似。
综上所述,扶正解毒方可有效抑制脓毒症大鼠血清中IL-6、IL-10、TNF-α等炎症因子水平、以及白细胞、中性粒细胞数、降低PCT、CRP含量,有效调节T淋巴细胞免疫水平,以利于免疫平衡的恢复。
[1]Fleischmann C,Scherag A,Adhikari NK,et al.Assessment of global incidence and mortality of hospital-treated Sepsis.Current Estimates and Limitations[J].Am J Respir Crit Care Med,2016,193(3):259.
[2]Cohen J,Vincent JL,Adhikari NKJ,et al.Sepsis: a roadmap for future research[J].Lancet Infect Dis,2015,15(5):581.
[3]师灵灵,韩艳秋,任慧娟,等.脓毒症的病理生理机制研究进展[J].中华医院感染学杂志,2016,26(8):1914-1916.
[4]郭小刚,冷建春,王卫星,等.中药复方治疗脓毒症患者疗效观察及对部分细胞因子和免疫学因子的影响[J].云南中医中药杂志,2011,32(2):13-15.
[5]荆喜中.野生型小鼠脓毒血症模型的建立及应用研究[D].广州:广东药科大学,2016:10-30.
[6]王珂琪,张俊平.脓毒症防治药物研究进展[J].国际药学研究杂志,2015,42(4):473-477.
[7]马帅,郭树彬.脓毒症免疫麻痹与细胞免疫调理治疗研究进展[J].中华急诊医学杂志,2016,25(7):969-973.
[8]Esposito S,De SG,Boccia G,et al.Sepsis and septic shock:New definitions,new diagnostic and therapeutic approaches[J].J Glob Antimicrob Resist,2017,10(1):204-212.
[9]许国振,许源.从瘀热证论治脓毒血症的理论及临床研究[J].中国中医急症,2016,25(11):2069-2071.
[10]樊楚明,杨欣悦,任靖宇,等.乌司他丁对脓毒症大鼠血管内皮细胞损伤保护作用及机制研究[J].中国临床药理学杂志,2016,32(8):723-726.
[11]曹超,柴艳芬,寿松涛,等.乌司他丁对脓毒症小鼠调节性T细胞凋亡及细胞因子分泌的影响[J].中华危重症医学杂志:电子版,2017,10(3):149-152.
[12]王丁超,苏秀平,高翔,等.扶正败毒颗粒对脓毒血症大鼠外周血白细胞及中性粒细胞比率的影响[J].山西中医,2011,27(9):46-47.
[13]林玲.降钙素原及C反应蛋白检测在重度脓毒血症患者预后判断中的价值分析[J].医药前沿,2016,6(18):158-159.
[14]龙涛,白蓉蓉,李智,等.降钙素原与C反应蛋白对术后重度脓毒血症患者预后的影响[J].中华医院感染学杂志,2015,12(13):2881-2883.
[15]信淑珍,王爱芹,李燕燕,等.脓毒血症患者炎症因子水平与疾病严重程度的关系分析[J].中华医院感染学杂志,2016,26(16):3616-3618.
[16]戴凌燕,章义利,程碧环.T淋巴细胞亚群变化与脓毒症发病的关系[J].中华全科医学,2014,12(5):715-716.
