补肾活血方加减对膝骨关节炎大鼠模型疼痛及软骨损伤的影响*
2018-06-02季卫锋童培建
李 胜 刘 魏 季卫锋 钟 莹 童培建
(浙江中医药大学,浙江 杭州 310053)
膝骨关节炎(KOA)在临床上较为常见,临床表现主要为疼痛及关节功能障碍。现多数学者认为KOA病变的核心是关节软骨退行性改变致软骨丢失、破坏伴有关节周围骨质增生性反应[1]。由于关节软骨缺乏自我修复能力,故治疗比较困难。目前对早期KOA患者,临床治疗的原则是减轻患者疼痛,改善患者生活质量,缓解关节软骨破损。常用方法包括口服非甾体类抗炎药,虽能缓解患者疼痛,但胃肠道等副作用颇多[2];自体干细胞关节腔注射,虽有不错的临床疗效,但费用昂贵、提取设备无法普及,血制品监管程序繁杂等限制其临床的推广应用。补肾活血方为伤科经典方,有补肾壮筋,活血止痛之功效[3-4]。本研究运用补肾活血方加减对KOA大鼠模型进行干预,探讨补肾活血方加减对KOA大鼠模型疼痛及软骨损伤的影响。现报告如下。
1 材料与方法
1.1 实验动物 雄性SD大鼠50只,由浙江中医药大学动物实验中心提供,动物许可证号:SCKK(沪)2007-0005。 体质量(230±20)g,动物观察室温度(25±1) ℃,相对湿度(60±10)%。适应性喂养训化1周后进行实验。
1.2 试药与仪器 中药制备:补肾活血方加减由浙江中医药大学门诊部提供,组成:熟地黄12 g,杜仲3 g,蜈蚣 1 g,菟丝子 9 g,当归尾 3 g,桃仁 3 g,山茱萸肉6 g,红花 3 g,独活 3g,川牛膝 3 g,枸杞 3 g。 中药饮片均来自浙江中医药大学药厂,煎液浓缩成1 g/mL(浙江中医药大学骨研所制备)。试剂与仪器:碘乙酸(SIGMA-ALDRICH);YLS-3E电子压痛仪(安徽省淮北正华生物仪器设备有限公司),37370足底热测痛仪(浙江中医药大学骨研所实验室提供),AXiovert200荧光倒置显微镜。
1.3 分组与造模 为避免灌胃时所致的应激影响,于实验前1周开始每日灌胃针训化处理。取50只SD大鼠随机分为空白组、模型组、补肾活血方低、中、高剂量组,每组10只。空白组不进行造模处理,其余4组大鼠通过向双侧膝关节关节腔注射25 mg/mL碘乙酸50 μL 进行 KOA 造模[3]。
1.4 干预方法 造模后第2日开始给药,空白组和模型组按10 mL/kg予0.9%氯化钠注射液灌胃,补肾活血方低、中、高剂量组根据《实验动物与人体表面积等效量换算比例》[4]进行给药,中剂量给药相当于正常成人量。按正常人(70 kg)每日1剂的药物量(49 g),大鼠(200 g)与成人(70 kg)的剂量折算系数 6.3,则 230 g大鼠的等效剂量为(49÷70)×6.3×0.23=1 g,低剂量为中剂量的一半为0.5 g,高剂量为中剂量+(0.65×中剂量)=1.7 g。综上可得,补肾活血汤低剂量组每日灌胃0.5 mL,中剂量每日灌胃1 mL,高剂量组每日灌胃1.7 mL,连续灌胃4周。
1.5 观察指标 1)大鼠压痛阈值测定:分别于造模后后第2日和第4周采用YLS-3E电子压痛仪测定各组大鼠的压痛阈值(以动物疼痛后的嘶鸣作为痛阈指标)。2)大鼠热痛阈值测定:每次压痛阈值测定后6 h,采用足底热痛测试仪测定各组大鼠双侧后足趾热痛阈值。每只大鼠测定3次,取平均值,每次间隔5~10 min。3)大鼠膝关节软组织病理学观察:连续灌胃4周,最后一次热痛阈值测定结束后,所有大鼠麻醉后断颈处死。取大鼠双侧膝关节标本放入4%多聚甲醛中溶液固定,硝酸脱钙、冲洗、梯度酒精脱水、二甲苯透明、石蜡包埋、切片(沿膝关节矢状面将胫骨内侧平台软骨下松质骨和股骨内侧髁软骨下松质骨沿下肢纵轴方向切片,厚度约5 μm),番红O染色。光镜下观察软骨组织病理学改变,按软骨损伤 Mankin′s 评分标准[5],从软骨结构、细胞改变、基质染色、潮线完整性评价软骨的病变程度,所得分数叠加后,得出评分结果。
1.6 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠压痛阈值测定结果比较 见表1。造模后第2日,与空白组比较,模型组、补肾活血方低、中、高剂量组大鼠压痛阈值均偏低,差异有统计学意义(均P<0.05),而模型组与补肾活血方低、中、高剂量组大鼠压痛阈值比较无明显差异(均P>0.05)。连续灌胃4周后,模型组大鼠压痛阈值低于空白组、补肾活血方低、中、高剂量组(均P<0.05),补肾活血方高剂量组大鼠压痛阈值高于低、中剂量组(均P<0.05),补肾活血方中剂量组大鼠压痛阈值高于低剂量组(P<0.05)。
表1 各组大鼠压痛阈值测定结果比较(kPa,±s)

表1 各组大鼠压痛阈值测定结果比较(kPa,±s)
与模型组比较,*P<0.05;与空白组比较,△P<0.05;与补肾活血方高剂量组比较,▲P<0.05;与补肾活血方中剂量组比较,#P<0.05。下同。
组 别 n 造模后第2日 造模后4周空白组 10 446.13±20.89 453.21±26.48*模型组 10 174.09±19.63△ 164.23±21.32补肾活血方低剂量组 10 171.01±19.30△ 221.49±19.38*▲#补肾活血方中剂量组 10 173.45±18.69△ 273.78±12.96*▲补肾活血方高剂量组 10 168.55±9.06△ 373.31±32.52*
2.2 各组大鼠热痛阈值测定结果比较 见表2。造模后第2日,与空白组比较,模型组、补肾活血方低、中、高剂量组大鼠热痛阈值均偏低,差异有统计学意义(P<0.05),而模型组与补肾活血方低、中、高剂量组大鼠热痛阈值比较无明显差异(均P>0.05)。连续灌胃4周后,模型组大鼠热痛阈值低于空白组、补肾活血方中、高剂量组(均P<0.05),补肾活血方低剂量组大鼠热痛阈值与模型组比较差异无统计学意义(P>0.05),补肾活血方高剂量组大鼠热痛阈值高于低、中剂量组(均P<0.05),补肾活血方中剂量组大鼠热痛阈值高于低剂量组(P<0.05)。
表2 各组大鼠热痛阈值测定结果比较(s,±s)
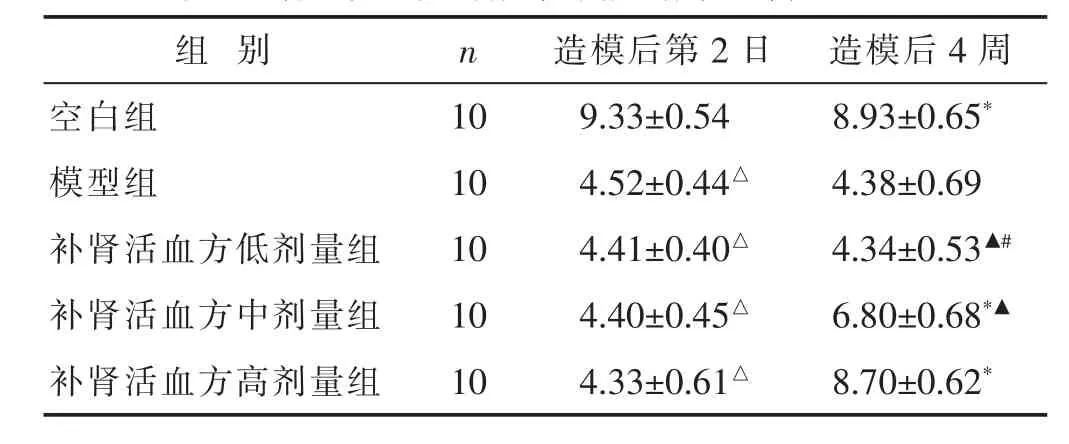
表2 各组大鼠热痛阈值测定结果比较(s,±s)
组 别 n 造模后第2日 造模后4周空白组 10 9.33±0.54 8.93±0.65*模型组 10 4.52±0.44△ 4.38±0.69补肾活血方低剂量组 10 4.41±0.40△ 4.34±0.53▲#补肾活血方中剂量组 10 4.40±0.45△ 6.80±0.68*▲补肾活血方高剂量组 10 4.33±0.61△ 8.70±0.62*
2.3 大鼠膝关节软组织病理学观察 见图1。空白组大鼠软骨表面平整,潮线连续完整,细胞排列规则,软骨基质染色均匀,呈现红色;模型组大鼠软骨表面明显缺损,软骨基质染色明显减轻、不均,细胞排列紊乱,潮线紊乱不连续紊乱。连续灌胃4周后,补肾活血方低、中、高剂量组软骨形态较模型组改变,软骨基质染色也有不同程度加深,潮线也有不同程度改变。其中以补肾活血方加减高剂量组改善最为明显,软骨表面基本恢复正常,可见少许肥大软骨细胞,潮线清晰,软骨基质染色加深最为明显,均匀;中剂量组软骨表面仍有缺损,软骨细胞大量存活,软骨基质染色加深,但不及高剂量组,欠均匀;低剂量组软骨组织缺损轻度改善,软骨细胞丢失,肥大化,潮线欠清晰,软骨基质染色加深,不及高、中剂量组。
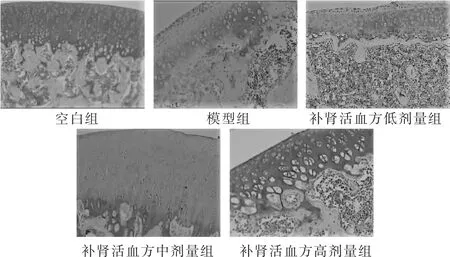
图1 各组大鼠膝关节软组织病理切片(番红O染色,100倍)
2.4 各组软骨损伤Mankin′s评分比较 见表3。与空白组大鼠比较,其余4组大鼠软骨损伤Mankin′s评分均偏高,差异有统计学意义(P<0.05)。其中补肾活血方中剂量组大鼠软骨损伤Mankin′s评分低于低剂量组(P<0.01),补肾活血加减高剂量组软骨损伤Mankin′s评分低于中、低剂量组,差异有统计学意义(P<0.01)。
表3 各组大鼠软骨损伤Mankin′s评分比较(分,±s)

表3 各组大鼠软骨损伤Mankin′s评分比较(分,±s)
组 别 n Mankin′s评分空白组 10 1.20±0.79模型组 10 8.50±1.58△补肾活血方低剂量组 10 6.70±1.34△▲#补肾活血方中剂量组 10 4.60±0.97△▲补肾活血方高剂量组 10 2.60±1.26△
3 讨 论
KOA患者早期常以膝关节疼痛为主,伴或不伴活动受限,Stoppiello认为这可能与软骨细胞完整性的丢失和软骨形态改变有关[6]。临床上X线片可见骨赘形成,膝关节间隙可疑变窄(以内侧间隙变窄为多见)。目前治疗KOA所遵循的原则是保护软骨细胞外基质成分和调节软骨细胞功能[7]。常用药物氨基葡萄糖、硫酸软骨素,但美国国立卫生研究院资助的研究显示氨基葡萄糖在减轻膝关节疼痛方面并没有明显优于安慰剂[8],Franse M 等[9]经研究认为硫酸软骨素在改变膝关节软骨方面也没有明显疗效。
KOA属于中医“痹证”范畴。在国内,中医治疗早期KOA具有很明显的特色和优势,副作用少,疗效确切。膝关节痹证是由邪气滞留于经络,导致膝关节疼痛、肿胀的症状,“正气不存,邪气可干”,正气不足是膝关节痹证的内在因素,夹杂风、瘀、痰、湿等实证。临床大样本研究显示KOA以肝肾亏虚多见[10];亦有学者采用聚类分析法研究表明KOA以脾肾阳虚、肝肾亏虚、气滞血瘀多见[11],另有流行病学结果表明肾虚夹瘀夹湿为KOA重要发病原因[12]。由此笔者认为KOA患者主要以肝肾亏虚伴或不伴血瘀气滞为多见。补肾活血方原方源于《伤科大成》,现代医家以该方为基础进行不断增减演变,运用于临床疾病的治疗,目前该方已成为中医药学者研究的热门。现笔者运用补肾活血方加减对KOA大鼠模型进行干预,观察模型大鼠的疼痛及膝关节的软骨变化。
本研究之大鼠压痛和热痛阈值结果显示,连续灌胃补肾活血方加减4周后,模型组大鼠压痛阈值低于空白组、补肾活血方低、中、高剂量组(P<0.05),补肾活血方高剂量组大鼠压痛阈高于低、中剂量组(P<0.05),补肾活血方中剂量组大鼠压痛阈值高于低剂量组(P<0.05)。模型组大鼠热痛阈值低于空白组,补肾活血方中、高剂量组(P<0.05),补肾活血方低剂量组大鼠热痛阈值与模型组比较差异无统计学意义,补肾活血方高剂量组大鼠、中剂量组大鼠热痛阈值,补肾活血方加减中剂量组大鼠热痛阈值高于低剂量组(P<0.05)。补肾活血方低、中、高剂量组软骨损伤Mankin′s评均低于模型组(P<0.05),其中中、高剂量组均较低,提示补肾活血方加减能修复大鼠软骨损伤,并与药物剂量呈正相关性。结果证明,补肾活血方加减能提高膝骨关节炎大鼠模型疼痛阈值,修复其膝关节软骨损伤,并与药物剂量呈正相关性。
近年来,在膝关节炎发病机制研究中,细胞因子的介导作用日趋受到重视。TNF-α既有协同细胞介素(IL-1)的作用,又可激活IL-6基因、诱导IL-6生成,在膝骨关节炎(OA)的发生、发展中起到决定性作用[13]。亦有研究证实IL-1是骨性关节炎(OA)病理过程中介导关节软骨破坏最重要的细胞因子,在OA的软骨细胞、关节滑液及滑膜组织均能检测较高水平的IL-Iβ和TNF-α。国外研究亦证实,IL-1β在软骨细胞的降解及退变起重要的分解作用,加重关节的炎症反应,增加破骨细胞的活性,促进骨质吸收[14]。国内中医学者应用补肾活血方对体外培养的滑膜细胞及软骨细胞进行干预,发现该方可以抑制滑膜细胞分泌IL-Iβ和TNF-α,同时还可以增强软骨细胞的增殖能力[15]。综上所述,补肾活血方加减能提高膝骨关节炎大鼠模型疼痛阈值,修复其膝关节软骨损伤,其作用机制可能与该方能够抑制膝关节滑膜细胞分泌IL-Iβ和TNF-α,进而控制膝关节炎症的进展,同时增强膝关节软骨细胞增殖能力,加速关节修复有关。
[1]Brooks PM.The burden of musculoskeletal disease-a global perspective[J].Clin Rheumatol,2006,25(6):778-781.
[2]Kongtharvonskul J,Anothaisintawee T,Mce-voy M,et al.Efficacy and safely of glucosamine,diacerein,and NSAIDs in osteoarthritis knee:a systematic review and network metaanalysia[J].Med Res,2015,20(1):24.
[3]Pomonis JD,Boulet JM,Gottshall SL,et al.Development and pharmacological characterization of a rat model of osteoarthritis pain[J].Pain,2005,114: 339-346.
[4]魏伟,吴希美,李元建.药理实验方法学[M].北京:人民卫生出版社,2010.1721.
[5]Krampla WW,Newrla SP,Kroener AH,et al.Changes on magnetic resonance tomography in the knee joints of marathon runner:a 10-year longitudinal study[J].Skeletal Radiol,2008,37(7):619-626.
[6]Stoppiello L,Mapp P,Wilson D,et,al.Structural associaations of symptomatic knee asteoarthritis[J].Arthritis Rheumatol,2014,2066(2011):3018-2017.
[7]Laslett L,Kingsbury S,Hensor E,et al.Effect of bisphosphonate use in patients with symptomaticand radiographic knee osteoarthritis:data from the osteoarthritis initiative[J].Ann Rheum Dis,2014,2073:824-830.
[8]Clegg D,Reda D,Harris C,et al.Glucosamine,chondroitin sulfate,and the two in combination for painfu lknee osteoarthritis[J].N Engle J Med,2006,2354:795-808.
[9]Fransen M,Agaliotis M,Nairn L,et al.Glucosamine and chondroitin for knee osteoarthritis:a double-blind randomized placebo-controlled clincal trial evaluating single and combination regimens[J].Ann Rheum Dis,2015,2074:851-888.
[10]李兆福,狄朋桃.昆明市膝骨关节炎中医症候研究[J].中医正骨,2014,26(6):24-27.
[11]郭跃,杨青梅,鲁超,等.膝骨关节炎的中医症候特点研究[J].中医临床研究,2015,7(4):1-4.
[12]向珍蛹,茅建春.膝骨关节炎中医证候分布的流行病学研究[J].上海中医药杂志,2012,46(12):5-8.
[13]Pelletier JP,DiBattista JA,Routhley P,et al.Cytokines and inflammation in carilage degradation[J].Rheum Dis Clin North Am,1993,19(3):545-568.
[14]Man lukazewski.Osteoarthritis,current and future management options[J].Arthitis&rhaenatism,2002,24:151-154.
[15]肖志锋,王德刚,许传勇,等.补肾活血方对Wnt/β-catenin信号通道介导的人滑膜细胞与正常软骨细胞共培养体系的调控作用[J].中国中医骨伤科杂志,2016,24(4):1-6.
