特异性Aurora激酶抑制剂对人乳腺癌原代细胞增殖、周期、自噬、凋亡的影响及其机制
2018-06-01张月孙光源姜伟华孙健范敬静宋文丽信国峰张志生
张月,孙光源,姜伟华,孙健,范敬静,宋文丽,信国峰,张志生
(河北北方学院附属第一医院,河北张家口075000)
近年乳腺癌发病率越来越高,已居女性恶性肿瘤发病率首位,且发病年龄趋于年轻化。手术治疗后的辅助化疗是目前乳腺癌的主要治疗手段,但不良反应较大,严重影响患者身体健康。靶向治疗是目前肿瘤治疗的研究热点,曲妥珠单抗是常用的乳腺癌靶向治疗药,但是只针对Her-2阳性的患者,治疗靶点单一,对Her-2阴性的患者无治疗作用。Aurora激酶家族是由AuroraA、AuroraB、AuroraC组成的丝/苏氨酸蛋白激酶,Aurora 激酶A、B在肺癌、白血病、甲状腺癌等肿瘤中均呈过表达,且与染色体的不稳定性、致癌的转变、肿瘤增殖和化学抗性都有关,是目前抗肿瘤药物中最具发展前途的作用靶点[1~3]。AT9283是一种新型的小分子Aurora激酶抑制剂,可特异性抑制AuroraA、AuroraB。文献[3]报道AT9283可诱导肺癌、甲状腺癌细胞凋亡、抑制细胞增殖。目前关于其在乳腺癌原代细胞中的作用相关研究报道较少。2015年5月~2016年8月,我们观察了AT9283对乳腺癌原代细胞增殖、周期、自噬、凋亡的影响,并探讨其可能作用机制。
1 材料与方法
1.1 细胞、试剂及仪器 人乳腺癌瘤组织来自河北北方学院附属第一医院乳腺外科,采用细胞培养法培养原代细胞。在无菌条件下收集乳腺癌原发病灶标本,去除坏死组织,用含有青霉素和链霉素的PBS漂洗2~3次,将组织剪碎,1 000 r/min离心5~10 min,弃上清液,加入含200 mL/L胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM培养液,37 ℃恒温培养箱常规培养,定期换液,传代培养。AT9283购自美国Selleck公司;DMEM培养基购自美国Gibco公司;胎牛血清购自Hyclone公司;BCA蛋白分析试剂盒购自美国Pierce公司; p-Aurora A、磷酸化的组蛋白H3(p-Histone H3)、Aurora A、Histone H3、p21、p53、Bcl-2、Bax一抗购于美国Cell Signaling Technology公司;FITC-Annexin Ⅴ凋亡试剂盒购于BD公司(美国);DAPI染液、荧光标记二抗、小鼠超敏二步法免疫组化检测试剂购自北京中杉金桥生物技术有限公司;β-tubulin一抗及二抗购自Santa Cruz公司;吖啶橙染料购于Sigma公司;FACScan流式细胞仪购自美国BD公司。
1.2 AT9283对乳腺癌原代细胞细胞核和纺锤体的影响观察 取适对数生长期乳腺癌原代细胞,消化、计数,调整细胞密度至103/mL,37 ℃、5% CO2孵箱中培养过夜使其贴壁。加入1 μmol/L的AT9283,培养48 h,弃上清,预冷的PBS洗三次(5 min/次),4%多聚甲醛固定、0.2%Triton-X100破膜、1%BSA封闭后,孵一抗β-tubulin(1∶200)4 ℃湿盒过夜,孵二抗鼠抗1∶200室温2 h ,DAPI着色5~10 min,1×PBS洗三次后封片,荧光显微镜下观察,共聚焦显微镜下采图, 观察AT9283对乳腺癌原代细胞细胞核和纺锤体的影响。
1.3 AT9283对乳腺癌原代细胞增殖、细胞周期的影响观察取适量对数生长期乳腺癌细胞,1×104/mL细胞浓度接种于 96 孔板,每孔 0.1 mL,将细胞分为实验组(1、2、3、4、5组)和对照组,1、2、3、4、5组分别加入2 mL的 0.001、0.01、0.1、1、10 μmol/LAT9283,对照组不做任何处理。①分别于培养24 、48 h时取各组细胞 ,每孔加入20 μL 5 g /L的 MTT,培养 4 h后弃上清,每孔加入二甲基亚砜 200 μL,震荡 10 min充分溶解显色,酶标仪波长 570 nm处检测各孔光密度值(OD值) ,计算实验组细胞增殖抑制率。细胞增殖抑制率=(1-OD实验组/OD对照组)×100%。②培养24 h时取各组细胞,调整细胞数至1×106/mL,冷PBS洗涤细胞,1 000 r/min离心,5 min两次,预冷的95%乙醇固定,离心乙醇固定的细胞,弃去乙醇,加入PI(50 μg/mL)与RNase(1 μg/mL)混合物500 μL作用15 min,流式细胞仪上机分析,检测1×104个细胞,并用multicycle软件分析各组细胞周期。③培养24 h时取各组细胞,提取蛋白样品30 μg,分别行10%SDS-聚丙烯酰胺凝胶电泳,37 mA恒流1 h将蛋白电转移至PVDF膜上,5%牛奶TBST封闭纤维素膜0.5 h,加入一抗4 ℃过夜,TBST洗涤 3次,然后与二抗(辣根过氧化物酶标记)室温孵育1 h后TBST洗涤3次, ECL显影,曝光。抗Aurora A、Histone H3、p-AuroraA、p-Histone H3、p21、p53、Bcl-2、Bax,抗体稀释比例为1∶1 000,β- actin抗体稀释比例为1∶10 000,二抗稀释比例1∶10 000。用图像分析系统分析,以积分光密度值表示相应目的蛋白的相对表达量。
1.4 AT9283对乳腺癌原代细胞自噬、凋亡的影响观察 将乳腺癌原代细胞接种于6孔板,细胞贴壁后分为A、B、C、D四组,A、B、C组分别加入0.1、1、10 μmol/L的AT9283,D组不做任何处理,共培养24 h。①取各组细胞,加入吖啶橙(1 mg/L)避光染色30 min。采用流式细胞仪测算细胞自噬率(橙红色荧光阳性的细胞占总细胞比例),实验重复3次,取平均值。②取各组细胞,调整细胞数至 1 × 106/mL,冷PBS洗涤两次。加入Binding 缓冲液100 μL、FITC Annexin-Ⅴ 5 μL、PI(50 μg/mL)10 μL,室温避光孵育15 min后加入Binding 缓冲液400 μL细胞悬液中加入孵育20~30 min 。采用流式细胞仪FACScan测定,经计算机软件处理计算凋亡细胞百分率。

2 结果
2.1 AT9283对乳腺癌原代细胞细胞核和纺锤体的影响 未处理乳腺癌原代细胞的细胞核和纺锤体没有改变,AT9283处理的乳腺癌原代细胞镜下可见细胞核形态改变,出现核分叶现象,产生多核细胞,纺锤体由双极变为单极, 出现纺锤体紊乱。
2.2 AT9283对乳腺癌原代细胞增殖、细胞周期的影响
2.2.1 实验组细胞增殖抑制率比较 1、2、3、4、5组细胞增殖抑制率均升高,且呈浓度依赖性(P均<0.05)。见表1。
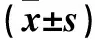
表1 培养24、48 h实验组细胞增殖抑制率
2.2.2 各组细胞周期比较 与对照组比较,各组G2/M期细胞所占比例降低,G0/G1、S期细胞比例升高(P均<0.05),且呈浓度依赖性。见表2。
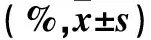
表2 各组细胞周期分布情况
2.2.3 各组细胞AuroraA、Histone H3、p-AuroraA、p-Histone H3、p21、p53、Bcl-2、Bax蛋白相对表达量比较 见表3、4。
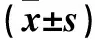
表3 各组细胞AuroraA、Histone H3、p-AuroraA、p-Histone H3相对表达量比较
注:与对照组比较,*P<0.05。
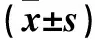
表4 各组细胞p21、p53、Bcl-2、Bax相对表达量比较
注:与对照组比较,*P<0.05。
2.3 AT9283对乳腺癌原代细胞自噬、凋亡的影响
2.3.1 各组细胞自噬率比较 A、B、C、D组自噬率分别为1.03%±0.01%、5.02%±0.31%、10.11%±0.31%、14.52%±0.21%,组间两两比较,P<0.05。见图1。
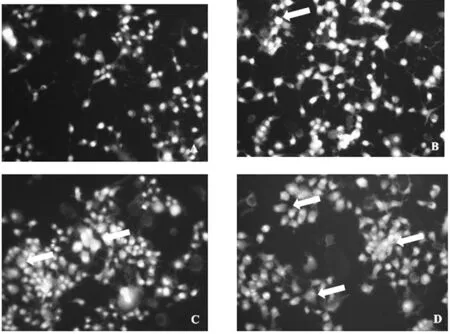
注:箭头所指为发生自噬的细胞
图1各组细胞自噬情况
2.3.2 各组细胞凋亡情况比较 培养24 h时A、B、C、D组凋亡率分别为3.03%±0.14%、8.25%±0.31%、12.15%±0.31%、44.52%±1.34%,组间两两比较,P<0.05。
3 讨论
Aurora激酶家族成员包括AuroraA、Aurora B、AuroraC[4~6],它们的功能主要是参与调节中心体、微管功能,保证染色体精确分离和有效的胞质分离[7],通常都在G2/M期表达达到高峰,调节着细胞周期G2/M期转换,是推动M期进展的关键因子[8~10]。Aurora激酶与乳腺癌的关系密切,AuroraA基因最初从乳腺癌中分离出来,AuroraA可诱导乳腺癌发生,乳腺癌中AuroraA和AuroraB的表达比较常见,表达率为26%~94%[11~13]。本研究前期研究发现,正常乳腺组织AuroraA呈低表达,而浸润性乳腺癌组织AuroraA呈高表达,二者比较, 差异具有统计学意义。AuroraA高表达是乳腺癌患者的独立预后指标,并且与预后相关[14]。AuroraA主要负责中心体的繁殖和分离,双极纺锤体的聚集,有丝分裂的进入与退出,对中心体的成熟和纺锤体的装备起着重要的作用。AuroraB在有丝分裂中期参与调节染色体的双定位及其分离。AuroraA、B转化为磷酸化的AuroraA、B才能发挥活性[15]。
AuroraA和AuroraB在C末端催化区域有71%的相似性,其高度保守性对底物和抑制剂的特异性很重要, 可以通过竞争性结合ATP抑制Aurora激酶结构域的自身磷酸化,从而阻断下游信号的传递,此通路的抑制会激活乳腺癌原代细胞的自噬[16]。Aurora A转化为磷酸化Aurora A才能发挥活性,p53的表达需要激活DNA周期检查点基因和凋亡基因,磷酸化Aurora A 为p53的上游效应分子,p21为p53的下游效应分子,G2/M期细胞周期进展受p53的调控,因而干扰磷酸化的Aurora A形成会影响到G2/M细胞周期的运行及p53的表达[17]。自噬是一种溶酶体依赖性降解途径,涉及细胞内长寿蛋白和受损伤细胞器的降解,其既是细胞保守的自我防御机制,又是一种程序性细胞死亡机制,与机体的多种疾病有密切关系,自噬具有独特的形态改变和特有的调控通路[18],Aurora激酶通路的抑制,从而激活乳腺癌原代细胞的自噬发生,使细胞发生凋亡。
近几年AuroraA和AuroraB作为抗肿瘤的靶点被广泛应用,但是在乳腺癌细胞中研究并不多。AT9283是小分子多靶点Aurora激酶抑制剂,同时抑制AuroraA和AuroraB, Aurora激酶通过与其底物(p53、BRCA-1等)结合,发生自身磷酸化从而被激活,其与Aurora激酶抑制剂的平衡关系对正常有丝分裂至关重要[19],抑制AuroraA可引起G2/M期阻滞,磷酸化组蛋白H3的减少,导致细胞凋亡,抑制AuroraB引起细胞核分裂失败,多核细胞形成,从而形成多倍体细胞,细胞发生凋亡[20],此通路受抑制后,细胞发生自噬现象,加速细胞的凋亡,本研究以人乳腺癌原代细胞为研究对象,检测AT9283对乳腺癌原代细胞的增殖抑制以及对细胞周期和凋亡的影响,对其分子机制进行了初步探讨。乳腺癌原代细胞未贴壁时可见大量的成簇肿瘤细胞、单个肿瘤细胞或细胞碎片,培养3~5 d后只见少量的肿瘤细胞贴壁,12~14 d可见大量肿瘤细胞贴壁,在正常乳腺癌组织中AuroraA低表达或无表达,在乳腺癌组织中高表达,可作为乳腺癌的特有标志,为乳腺癌诊疗提供依据,本研究中MTT显示10 μmol/L AT9283 作用于乳腺癌原代细胞24、48 h抑制率均较高,流式细胞术显示细胞周期在加药组出现了明显的G2/M期阻滞,G0/G1期、S期细胞比例降低,G2/M期细胞比例升高,且在1 μmol/LAT9283作用于乳腺癌原代细胞48 h可见多倍体形成,实验组与对照组比较差异均有统计学意义。本研究中Western blotting结果显示磷酸化AuroraA和磷酸化组蛋白H3的表达随着浓度的增加逐渐减少。随着AT9283药物浓度的增加伴随p53的蛋白表达量增加,这说明细胞的增殖抑制可能与上调p53的表达,不能有效调节G2/M期细胞周期的进展有关。乳腺癌原代细胞经过不同浓度AT9283处理后Bcl-2与Bax的表达呈相反趋势,即促凋亡蛋白Bax表达量增加,抗凋亡蛋白Bcl-2表达量减少,细胞进入凋亡。
综上所述,AT9283可抑制乳腺癌原代细胞的增殖,使G2/M期细胞所占比例降低,G0/G1、S期细胞比例升高,促进细胞自噬、凋亡,且作用呈剂量依赖性。其机制可能为AT9283抑制乳腺癌原代细胞p-AuroraA、p-Histone H3、Bcl-2表达,促进p21、p53、Bax表达。
参考文献:
[1] Anqun T, Keyu G, Laili C,et al.Aurora kinases: novel therapy targets in cancers[J].Oncotarget, 2017, 8(14): 23937-23954.
[2] Zaytsev AV, Segura PD, Godzi M,et al.Bistability of a coupled Aurora B kinase-phosphatase system in cell division[J].Elife, 2016 ,14(5):10644.
[3] Barisic M, Silva e SR, Tripathy SK,et al. Microtubule detyrosination guides chromosomes during mitosis[J].Science, 2015,348(6236):799-803.
[4] Benjamin G, John DC.The Aurora Kinases in Cell Cycle and Leukemia[J] .Oncogene, 2015,34(5):537-545.
[5] Sarah LL, Christina WY, Anne VL,et al. Aurora kinase B is important for antiestrogen resistant cell growth and a potential biomarker for tamoxifen resistant breast cancer[J] .BMC Cancer, 2015,15(2):239.
[6] Kazuharu K, Kimie K, Wang XP,et al.Antitumor Activity of KW-2450 Against Triple-Negative Breast Cancer by Inhibiting Aurora A and B Kinases[J].Mol Cancer Ther, 2015 ,14(12):2687-2699.
[7] Zhang YQ, Jiang CL,Li HL,et al.Elevated Aurora B expression contributes to chemoresistance and poor prognosis in breast cancer [J].Int J Clin Exp Pathol, 2015,8(1):751-757.
[8] John JT, Anastasia I, Aik CT,et al.p53 Family Members Regulate Phenotypic Response to Aurora Kinase A Inhibition in Triple-Negative Breast Cancer[J].Mol Cancer Ther, 2015,14(5):1117-1129.
[9] Vassilios B, Spiros L. Aurora Kinase Inhibitors: Current Status and Outlook[J].Front Oncol, 2015,11(5):278.
[10] Archana B, Arpita V, Kaivalya D,et al. Pharmacological cyclin dependent kinase inhibitors: Implications for colorectal cancer[J].World J Gastroenterol, 2016, 22(7):2159-2164.
[11] Emad Y. Optimizing and predicting the in vivo activity of AT9283 as a monotherapy and in combination with paclitaxel[J].J Gastrointest Can, 2015,46(4):380-389.
[12] Qi QR, Zhao XY, Zuo RJ, et al. Involvement of atypical transcription factor E2F8 in the polyploidization during mouse and human decidualization [J]. Cell Cycle, 14(12):1842-1858.
[13] Min-Jun W, Fei C, Joseph TYL,et al.Hepatocyte polyploidization and its association with pathophysiological processes[J].Cell Death Dis, 2017,8(5): 2805.
[14] William P, Jingbo L, Liang Y,et al. Dasatinib suppression of medulloblastoma survival and migration is markedly enhanced by combining treatment with the aurora kinase inhibitor AT9283[J].Cancer Lett,2014,354(1):68-76.
[15] James F, Farhad R, Hucmg MD, et al. A Phase I and pharmacodynamic study of AT9283, a small molecule inhibitor of aurora kinases in patients with relapsed/refractory leukemia or myelofibrosis[J].Clin Lymphoma Myeloma Leuk, 2014,14(3):223-230.
[16] Ding YH, Zhou ZW, Ha CF, et al. Alisertib, an Aurora kinase A inhibitor, induces apoptosis and autophagy but inhibits epithelial to mesenchymal transition in human epithelial ovarian cancer cells[J].Drug Des Devel Ther, 2015,59(9):425-464.
[17] Paschalis G, Alexandros G, Dimitrios G,et al.Aurora Kinases and Potential Medical Applications of Aurora Kinase Inhibitors: A Review[J].J Clin Med Res, 2015,7(10):742-751.
[18] Iqra C, Paul MB, Jonathan F,et al.Recent advances in the development of Aurora kinases inhibitors in hematological malignancies[J].Ther Adv Hematol, 2015,6(6):282-294.
[19] Zhao HS, Sioned O, Eleri LD,et al.The Effect of Aurora Kinase Inhibitor on Adhesion and Migration in Human Breast Cancer Cells and Clinical Implications[J].World J Oncol, 2017,8(5):151-161.
[20] Chuankui W, Luo QF,SunXG,et al. microRNA-497 induces cell apoptosis by negatively regulating Bcl-2 protein expression at the posttranscriptional level in human breast cancer[J].Int J Clin Exp Pathol, 2015,8(7):7729-7739.
