红色毛癣菌、犬小孢子菌生物被膜模型构建及其对特比萘芬敏感性观察
2018-06-01林浩琪刘雪萍郑银丽沈志滨江涛唐春萍
林浩琪,刘雪萍,郑银丽,沈志滨,江涛,唐春萍,2
(1广东药科大学中药学院,广州510006;2 广东省局部精准药物递药制剂工程技术研究中心;3 广东药科大学实验动物中心)
自然界95%的微生物能形成生物被膜[1]。皮肤癣菌是一种侵袭人或者动物角质层的真菌,包括毛癣菌属、小孢子菌属和絮状表皮菌属[2,3]。皮肤癣菌生物被膜[4]是皮肤癣菌菌体细胞被自身产生的细胞外基质包裹后所形成的聚合物,可导致皮肤癣菌耐药。真菌种类[5]、基质、 碳源、 酸碱环境和其他条件因素等[6]均可影响真菌生物被膜的形成。目前,关于真菌生物被膜的研究主要集中在白色念珠菌,而皮肤癣菌生物被膜形成的研究较少[7,8]。白色念珠菌属假丝酵母菌,皮肤癣菌属丝状真菌,两者生物学特性不同,且不同菌种之间孢子初黏附的时间与能力不同[8,9]。例如白色念珠菌成熟生物被膜的形成时间一般是24~48 h[9]、而红色毛癣菌成熟生物被膜的形成时间一般是72~96 h[7]。本研究以红色毛癣菌和犬小孢子菌为研究对象,构建体外生物被膜模型,观察其对特比萘芬(TERB)的敏感性。现将结果报告如下。
1 材料与方法
1.1 实验菌株、试剂与仪器 红色毛癣菌标准株CMCC(F)T1d;犬小孢子菌标准株CMCC(F)M3h, 近平滑念珠菌ATCC-22019均购于中国医学科学院皮肤病研究所(南京),前期研究发现,红色毛癣菌和犬小孢子菌生物被膜生长最适培养基为含胎牛血清培养基,初黏附时间分别为6、3 h。燕麦培养基依据文献配制[10];含胎牛血清1640培养基依据文献配制[11]。噻唑蓝(MTT)广州瑞舒生物科技有限公司;XTT 钠盐(XTT)SIGMA-ALDRICH公司;盐酸特比萘芬(TBF)美仑生物,批号:0726A; PB-10台式数显 PH 计(赛多利斯科学仪器(北京)有限公司);BA310正置显微镜(麦克奥迪实业集团有限公司);AE2000倒置显微镜(麦克奥迪实业集团有限公司)。iMark酶标仪 (美国BIO-RAD公司);DHP-9032B电热恒温培养箱(上海一恒科学仪器有限公司);E-1010离子溅射仪 (日本株式会社日立高新科技那珂事业所);S-3400N扫描电镜 (日本株式会社日立高新科技 那珂事业所);CHA-S恒温振荡器 (江苏省金坛市荣华仪器制造有限公司)。
1.2 红色毛癣菌、犬小孢子菌体外生物被膜模型构建及其生长情况观察 取红色毛癣菌、犬小孢子菌标准菌分别接种于OCA和PDA培养基上,置于温箱培养中培养两代得到实验菌株,然后加入无菌PBS,用血细胞计数板计数,用胎牛培养基将菌悬液浓度调至适当浓度,备用。将红色毛癣菌和犬小孢子菌的菌液(1×106CFU/mL)分别接种到孔板中,分别在35 ℃温箱中静置孵育6、3 h(前期的研究结果表明红色毛癣菌、犬小孢子菌生物被膜生长最适条件是在含胎牛血清的培养基中,初黏附时间分别为6、3 h),弃培养基,0.01 mmol/L PBS冲洗2次,加入适量培养基,制作红色毛癣菌、犬小孢子菌体外生物被膜模型。分别于培养24、48、72、96 h时取出培养的红色毛癣菌生物被膜模型;于培养24、48、72、96 h时取出犬小孢子菌生物被膜模型,在倒置显微镜下用400倍观察不同时间段生物被膜的生长状况。加入100 μL XTT/menadione 溶液,35 ℃避光培养2 h。用酶标仪测定红色毛癣菌和犬小孢子菌的光密度OD490值。不同时间点的光密度值即代表不同时间点被膜中孢子相的代谢程度,也就是生物被膜的生长状况。
1.3 红色毛癣菌和犬小孢子菌成熟生物被膜中细胞外基质(ECM)检测及形态观察 培养96 h时取红色毛癣菌生物被膜模型,培养72 h时取犬小孢子菌生物被膜模型,弃培养基,室温干燥,分别加入50 μL的番红精溶液,反应5 min 后,弃去染液,加入PBS溶液冲洗直至上清液无色,分别在酶标仪上测定红色毛癣菌和犬小孢子菌的OD492值。以OD492值代表红色毛癣菌和犬小孢子菌成熟生物被膜中ECM的相对表达量。培养96 h时取红色毛癣菌生物被膜模型,将爬片标本取出,于预冷2.5%的戊二醛溶液中避光固定4~6 h,用PBS浸洗 2 次,梯度乙醇( 30%、50%、70%、80%、90%、95%、100%)进行脱水,每次10 min,过夜干燥镀金,使用扫描电镜观察红色毛癣菌成熟生物被膜的形态。
1.4 红色毛癣菌和犬小孢子菌生物被膜对特比萘芬(TERB)的敏感性观察 参照文献[12]比较红色毛癣菌、犬小孢子菌生物被膜对TERB的敏感性。
1.4.1 TERB对于红色毛癣菌和犬小孢子菌浮游菌最低抑菌浓度的测定 分别将100 μL 用普通培养基稀释的红色毛癣菌和犬小孢子菌菌液(2×104CFU/mL)接种于96孔板中,分为10组,每组5个复孔,分别加入100 μL终浓度为8、4、2、1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 6 μg/mL的TERB,并设未加药的对照组,35 ℃培养96 h后取出,肉眼观察无菌生长的浓度即为MIC。用近平滑念珠菌ATCC22019作为质控菌株,氟康唑作为质控菌的药物,氟康唑对近平滑念珠菌ATCC22019的MIC为2 μg/mL,符合CLSI质控要求。实验重复3次,取平均值。
1.4.2 TERB抑制红色毛癣菌、犬小孢子菌50%和80%生物被膜浓度的测定 培养96 h时取红色毛癣菌成熟生物被膜模型;培养72 h时取犬小孢子菌生物被膜模型,弃去培养基,分为10组,每组5个复孔。分别加入100 μL终浓度为256、128、64、32、16、8、4、2、1、0.5 μg/mL的TERB,并设未加药的对照组,继续在35 ℃温箱中培养48 h后,0.01 mmol/L PBS冲洗以除去药液本身颜色对光密度值的影响;加入100 μL XTT/menadione 溶液,35 ℃避光培养2 h。用酶标仪测定OD490值。以OD490值代表TERB对于红色毛癣菌和犬小孢子菌生物被膜的SMIC。实验重复3次,取平均值。

2 结果
2.1 红色毛癣菌和犬小孢子菌生物被膜生长情况 不同培养时间红色毛癣菌和犬小孢子菌生物被膜形态比较见图1。培养48 h时两种菌株酵母相细胞与其延伸所形成的菌丝开始密集交织,培养72 h时两种菌株开始大量形成ECM并沿着菌丝形成团块聚集,可见多层膜状结构,表明两种皮肤癣菌体外生物被膜构建成功。

注:红色毛癣菌:(a)培养24 h;(b)培养48 h;(c)培养72 h;(d)培养96 h 犬小孢子菌:(e)培养24 h;(f)培养48 h;(g)培养72 h;(h)培养96 h。
图1红色毛癣菌、犬小孢子菌生物被膜形态(400×)
不同培养时间红色毛癣菌和犬小孢子菌的OD490值比较见表1。红色毛癣菌和犬小孢子菌形成成熟生物被膜的时间分别为96 、72 h。
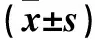
表1 不同培养时间红色毛癣菌和犬小孢子菌的OD492值比较
注:与同培养时间犬小孢子菌比较,*P<0.05。
2.2 红色毛癣菌、犬小孢子菌成熟生物被膜OD492值比较
镜下可见红色毛癣菌和犬小孢子菌成熟生物被膜OD492值分别为1.925±0.111和1.173±0.157。
红色毛癣菌成熟生物被膜菌丝相互缠绕连接,形成精密的被膜网,菌丝外围清晰可见细胞外基质,见图2。
2.3 TERB对红色毛癣菌和犬小孢子菌的MIC及SMIC50、SMIC80比较 TERB对红色毛癣菌和犬小孢子菌浮游菌MIC分别是0.125、1 μg/mL,而TERB对于红色毛癣菌和犬小孢子菌成熟生物被膜的SMIC50、SMIC80值均大于256 μg/mL。
3 讨论

注:a为扫描电镜下红色毛癣菌成熟生物被膜形态,b、c、d箭头所指为红色毛癣菌成熟生物被膜ECM。
图2红色毛癣菌成熟生物被膜形态
由于生物被膜本身结构的复杂性以及对真菌生物被膜的研究较少,因此目前临床上对真菌引起相关疾病仍缺少高效的治疗药物[13]。一般情况下,成熟的生物被膜能够产生大量的细胞外基质,其组成成分很复杂,通常包括多糖、蛋白质、核酸等,其中多糖为生物被膜的主要成分[14]。目前对真菌生物被膜的研究主要集中在白色念珠菌上,但由于皮肤癣菌和白色念珠菌之间的生物学特性存在着较大的差异,由此研究皮肤癣菌生物被膜的特性对于后期筛选具有抗皮肤癣菌活性及抗耐药性药物具有重要的意义。
文献[6]报道须癣毛癣菌生物被膜的成熟时间为72 h;白色念珠菌生物被膜的成熟时间为24~48 h[9]。本文用XTT法、倒置显微镜法探究红色毛癣菌、犬小孢子菌生物被膜的生长动态,结果表明,红色毛癣菌和犬小孢子菌生物被膜的指数生长期都在48~72 h,而其生物被膜完全成熟的时间分别是96、72 h。因此,生物被膜成熟时间因菌株不同而不同,可能的原因是不同菌种之间孢子初黏附的时间与能力不同,也可能是由于不同菌种之间生态差异和所含酶不同[8]。
文献[5,7,15]报道,番红精能够对ECM中含量最高的有机多糖进行染色,不同的菌种之间生物被膜的生成总量与ECM的生成量呈正相关。本研究采用了番红精染色法分别对成熟期两种菌株进行染色,结果显示红色毛癣菌、犬小孢子菌均能产生较多有机多糖,即产生较多的ECM。本研究中,在扫描电镜下观察到红色毛癣菌能在聚苯乙烯材料的表面形成成熟的生物被膜,成熟期的生物被膜菌丝之间相互交错,结合紧密,同时在某些区域上能观察到内嵌着菌丝的ECM。
按照M38-A2方案,测定氟康唑对质控菌近平滑念珠菌的MIC结果在参考范围内。本研究中测得TERB对红色毛癣菌和犬小孢子菌浮游菌的MIC分别为0.125、1 μg/mL。接着探究TERB对形成产生成熟的生物被膜菌株的敏感性,结果显示其SMIC50和SMIC80均>256 μg/mL。成熟的生物被膜对抗菌药物的敏感性降低,降低的倍数往往是几十倍甚至是几百上千倍[16,17]。本研究结果发现,红色毛癣菌、犬小孢子菌均能生成成熟生物被膜,TERB对红色毛癣菌和犬小孢子菌的成熟生物被膜敏感性低,说明皮肤癣菌对TERB的耐药性大大的增强,这也能从侧面证明了本文已经成功的构建了皮肤癣菌的生物被膜体外模型。
本文通过研究毛癣菌属和小孢子菌属体外生物被膜的构建方法和生物学特性,为进行抗皮肤癣菌药物的筛选、疗效的评价和皮肤癣菌生物被膜的耐药性提供了实验依据。
参考文献:
[1] Sardi D CO, Pitangui NDS, Rodríguez-Arellanes G, et al. Highlights in pathogenic fungal biofilms[J]. Rev Iberoam Micol, 2014,31(1):22-29.
[2] Renan MS,Marcus V, Dias S. Effectiveness of five antidandruff cosmetic formulations against planktonic cells and biofilms of dermatophytes[J]. Saudi J Biol Sci, 2017,24(2):331-337.
[3] Allen HB. Diseases with occluded sweat ducts other than eczema (tinea pedis, axillary granular parakeratosis, and seborrheic dermatitis)[M].Springer London :The Etiology of Atopic Dermatitis, 2015:75-95.
[4] Heiby N. A short history of microbial biofilms and biofilm infections[J]. APMIS, 2017,125(4):272-275.
[5] Sánchez-Vargas LO, Estrada-Barraza D, Pozos-Guillen AJ, et al. Biofilm formation by oral clinical isolates of Candida species[J]. Arch Oral Biol, 2013,58(10):1318-1326.
[6] Kucharíková S, Tournu H, Lagrou K, et al. Detailed comparison of Candida albicans and Candida glabrata biofilms under different conditions and their susceptibility to caspofungin and anidulafungin[J]. J Med Microbiol, 2011,60(9):1261-1269.
[7] Costa-Orlandi CB, Sardi JCO, Santos CT, et al. In vitro characterization of Trichophyton rubrum and T. mentagrophytes biofilms[J]. Biofouling, 2014,30(6):719-727.
[8] Brilhante RSN, Correia EEM, de Melo Guedes GM, et al. Quantitative and structural analyses of the in vitro and ex vivo biofilm-forming ability of dermatophytes[J]. J Med Microbiol, 2017,66(7): 1045-1052.
[9] 邵菁, 汪长中, 汪天明,等. 白念珠菌生物膜体内外模型研究进展[J].中国真菌学杂志,2012,7(6):380-384.
[10] 王端礼, 李若瑜, 王爱平. 医学真菌学实验室检验指南[M]. 北京: 人民卫生出版社,2005:178-185.
[11] Vila TVM, Quintanilha NS, Rozental S. Miltefosine is effective against Candida albicans and Fusarium oxysporum nail biofilms in vitro[J]. J Med Microbiol, 2015,64(11):1436-1449.
[12] 陆克乔, 张梦翔, 施高翔,等. 云南重楼正丁醇提取物对白念珠菌生物膜形成的抑制作用[J]. 中草药, 2016, 47(3):440-446.
[13] Gupta AK, Daigle D, Carviel JL. The role of biofilms in onychomycosis.[J]. J Am Acad Dermatol, 2016,74(6):1241-1246.
[14] Zarnowski R, Westler WM, Lacmbouh GA, et al. Novel Entries in a Fungal Biofilm Matrix Encyclopedia[J]. Mbio, 2014,5(4):133-138.
[15] Seidler M, Salvenmoser S, Müller FM. In vitro effects of micafungin against Candida biofilms on polystyrene and central venous catheter sections[J]. Int J Antimicrob Agents, 2006,28(6):568-573.
[16] Bhatia VK, Sharma PC. Determination of minimum inhibitory concentrations of itraconazole, terbinafine and ketoconazole against dermatophyte species by broth microdilution method[J]. Indian J Med Microbiol, 2015,33(4):533-538.
[17] Ramage G,Rajendran M, Ranjith S, et al. Fungal Biofilm Resistanc[J]. Int J Microbiol,2012,115(10):1-14.
