紫杉醇及其衍生物的半合成概述
2018-06-01邓夏萌沈海伟钟光祥夏春年
邓夏萌,曹 辉,沈海伟,钟光祥,夏春年*
(1.浙江工业大学药学院,浙江 杭州 310014;2.宁波绿之健药业有限公司,浙江 宁波 315505)
紫杉醇(Paclitaxel,TaxolR,图 1)的发现在天然产物的研究中是具有里程碑意义的重大事件。1966年,Wani等[1]从太平洋红豆杉树皮中首次提取分离得到紫杉醇,Schiff等[2]发现其促进微管蛋白的聚合以及防止解聚。1992年,FDA批准百时美施贵宝BMS公司生产的紫杉醇作为治疗晚期或转移性卵巢癌的新药上市,主要用于治疗转移性乳腺癌;两年后,批准用于治疗非小细胞肺癌;后续研究表明,紫杉醇对食道癌、头颈部癌、白血病、黑色毒瘤和结肠癌等均有一定疗效。1996年,法国罗纳普朗克乐安公司开发出了多西紫杉醇(Docetaxel, TaxotereR, 图 1),制剂称为“泰素帝”或“多西他赛”。多西他赛是紫杉醇类似物,在体外抗癌活性测试条件下,活性是紫杉醇的10倍左右;与紫杉醇相比,水溶性更好、毒副作用更小;临床上用于治疗肺癌、乳腺癌、膀胱鳞状癌、前列腺癌、头颈癌等[3-4]。2010年,FDA批准卡巴他赛(Cabazitaxel,JevtanaR)用于治疗晚期前列腺癌,与多西他赛相比,其与P-gp的亲和力较弱,多重耐药性更低[5]。
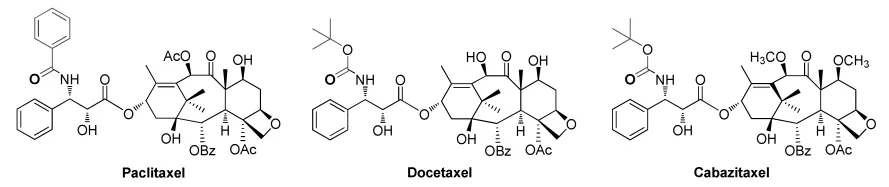
图1 紫杉醇及其衍生物Fig.1 Taxol and Its analogues
紫杉醇是一种天然产物,最初是从太平洋短叶红豆杉中的树皮中提取出来的。红豆杉生长缓慢,且从树皮中提取出来的紫杉醇含量特别低(一般<0.5%),直接提取会对自然环境产生非常大破坏性。虽然人们在替代资源的开发研究方面做了许多尝试,如紫杉醇的其他植物资源、紫杉烷植物细胞悬浮培养、生物合成、真菌培养、全合成等[6],但是还是不能达到工业化要求以满足市场的需求。
目前,紫杉醇及其衍生物的主要的获取方式还是以半合成为主。其中,半合成主要是两种方法:一种是以10-去乙酰基巴卡丁III(10-DABIII)为前体,经过选择性保护、与侧链缩合、脱保护和开环后得到紫杉醇及其衍生物;另外一种是以10-去乙酰基紫杉醇为前体,经过乙酰化后得到紫杉醇及其衍生物,但是10-去乙酰基紫杉醇也需要从红豆杉的树皮或树叶中提取,产量非常有限。10-DABIII在红豆杉树叶中的含量可以达到1%,规模化种植后对自然环境影响有限,且产量有保障。因此,紫杉醇及其衍生物采用半合成方法生产;半合成中主要采用了直链侧链法、四元环侧连法和五元环侧链法三种方法。
1 直链侧链法
1988年,Potier等[7]从欧洲紫杉中分离得到10-DABIII,并成功合成紫杉醇(图2),这为后来紫杉醇的半合成提供了研究方向。
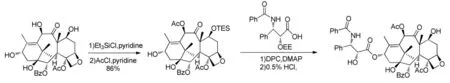
图2 Greene-Potier通过苯基异丝氨酸侧链合成紫杉醇Fig.2 Greene-Potier synthesizes Paclitaxel by phenylisoserine side chain
直链侧链法是首次用于半合成紫杉醇和多烯紫杉醇的方法[8]。被保护后的母核和直链侧链酯化得到紫杉醇前体,并在酸性条件下脱保护基得到紫杉醇或其衍生物(图3),同类合成方法统计如表1[9-15]。
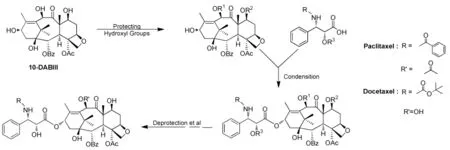
图3 紫杉醇及其衍生物的直链合成路线Fig.3 Synthetic route of Paclitaxel and Docetaxel using linear synthon
此路线的优点是直链侧链本身性质较为稳定,合成比较容易;但其缺点是与母核发生酯化反应时,需要使用多个当量的直链侧链,而且反应条件比较苟刻,转化率低(<50%),分离纯化比较困难。另外,在反应过程中如条件控制不当会产生大量C-2’差向异构体。
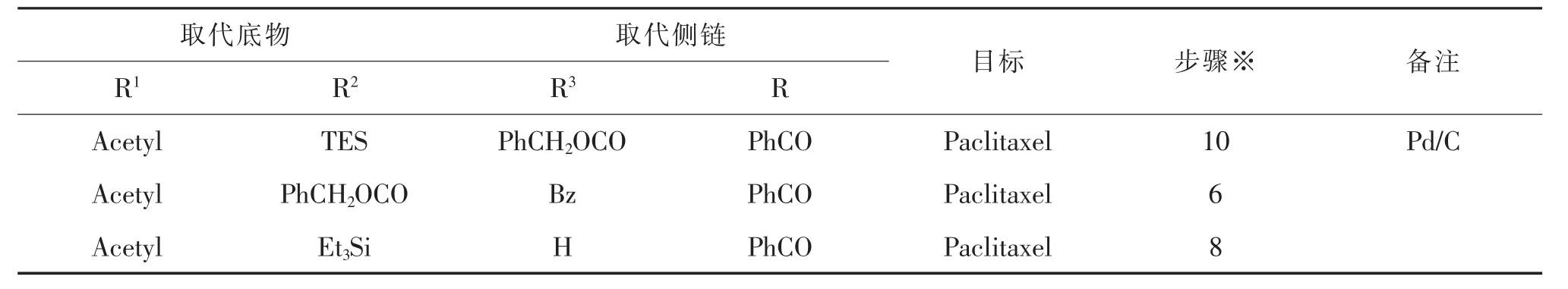
表1 紫杉醇及其衍生物的直链合成方法Tab.1 Synthetic methods of Paclitaxel and Docetaxel using linear synthon
2 四元环侧链法
BMS公司[16]工业化生产紫杉醇的方法 (图4),后续的研究者围绕四元环侧链进行了大量的研究。
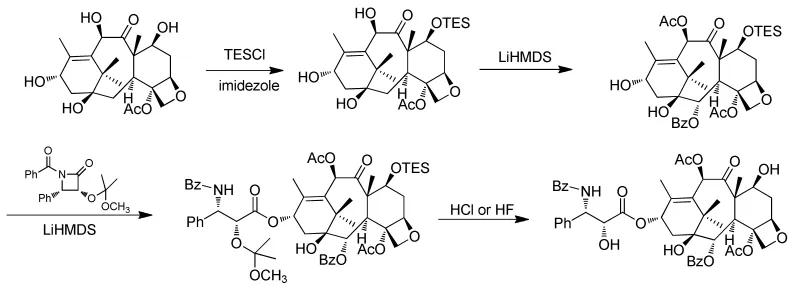
图4 BMS公司的紫杉醇合成路线Fig.4 BMS Company’s synthetic route of Paclitaxel
四元环(β-内酰胺型)侧链法是在改进“直链法”不足时而发展起来的有效方法之一。四元环刚性较大,在与保护的10-DABIII发生酯化时同时开环,反应较容易进行,但是往往也会有一定量的C-2’差向异构体产生。而且需要在比较严苛的条件下进行侧链与母核的偶合。合成典型路线(图5)和同类合成方法统计如表2[17-22]。
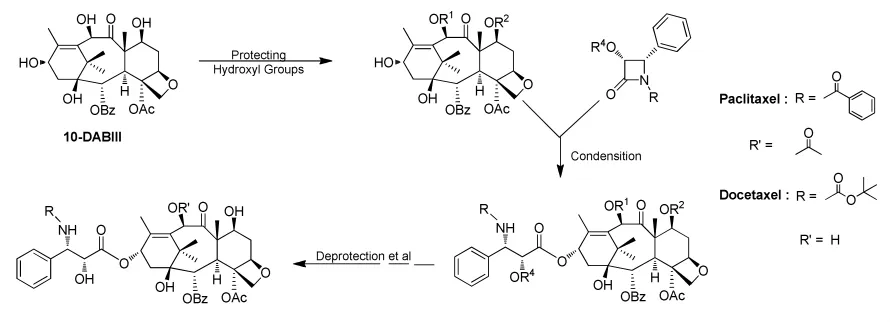
图5 紫杉醇及其衍生物的四元环合成路线Fig.5 Synthetic route of Paclitaxel and Docetaxel using β-lactam synthon
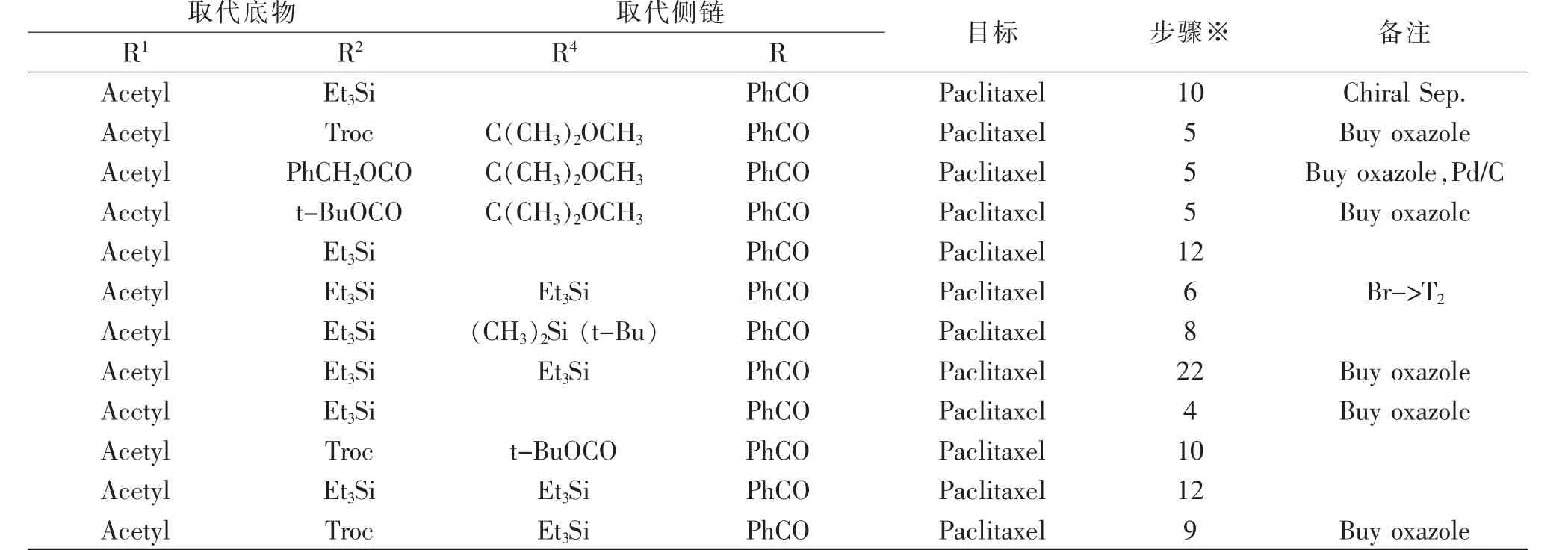
表2 紫杉醇及其衍生物的四元环合成方法Tab.2 Synthetic methods of Paclitaxel and Docetaxel using β-lactam synthon
3 五元环侧链法
1994年,Kingston[23]等首次用噁唑啉与母核酯化合成了紫杉醇(图6)。后续的研究者围绕五元环侧链进行了大量的研究。
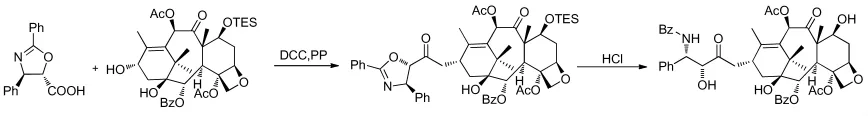
图6 Kingston通过噁唑啉合成紫杉醇Fig.6 Kingston’s synthesis of Paclitaxel through oxazoline
五元环(噁唑环)侧链法也是在改进“直链法”不足而发展起来的有效方法之一。手性氨基和羟基通过取代基的成环有效地保护起来,得到的噁唑环更稳定,而游离出来的羧基位阻降低,能直接参与10-DABIII的酯化反应,经过开环、脱保护后得到紫杉醇及其衍生物。合成典型路线(图7和图8)和同类合成方法统计如表3[24-38]。
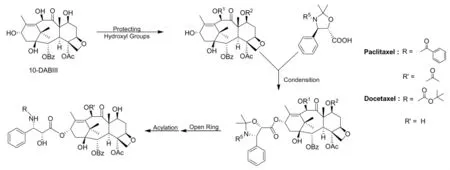
图7 紫杉醇及其衍生物的恶唑烷环法合成路线Fig.7 Synthetic route of Paclitaxel and Docetaxel using oxazole synthon
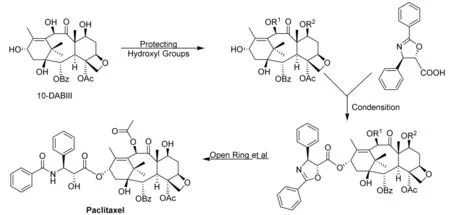
图8 紫杉醇及其衍生物噁唑环方法合成路线Fig.8 Synthetic route of Paclitaxel and Docetaxel using oxazole synthon
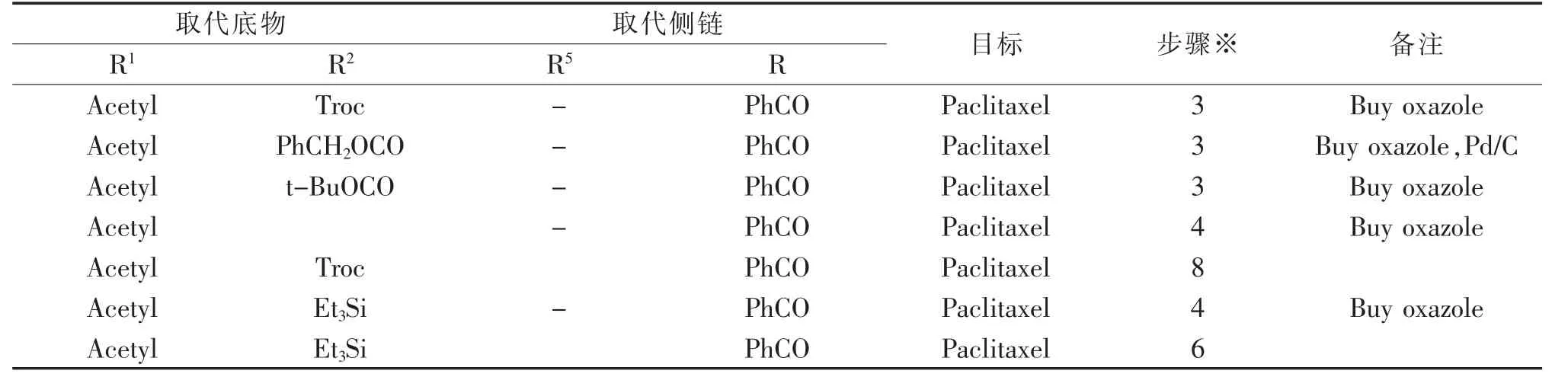
表3 紫杉醇及其衍生物噁唑环方法合成方法Tab.3 Synthetic methods of Paclitaxel and Docetaxel using oxazole synthon
4 卡巴他赛的半合成
卡巴他赛是紫杉醇的衍生物,其合成关键是7,10位上甲基、缩合、开环最终得到卡巴他赛。
Bouchard等[39]等以10-DABIII为起始原料,用三乙基氯硅烷对7位上的羟基进行保护后,与碘甲烷反应生成7-甲氧基10-DABIII,在氢氟酸和三乙胺的作用下脱去7位的保护,再与碘甲烷反应,生成 7,10-甲氧基 10-DABIII,接着与侧链缩合、开环得到卡巴他赛(图9)。该工艺路线分步引入甲氧基,比较繁琐,且用到氢氟酸,给工业化带来不便。
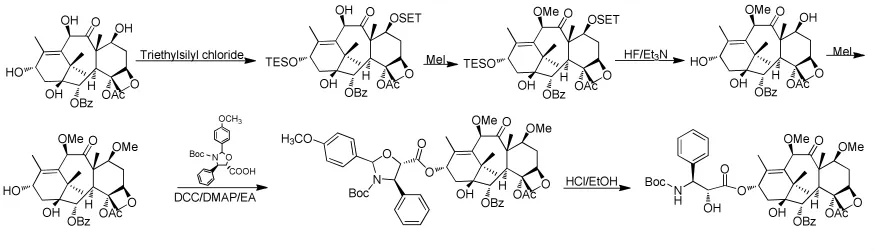
图9 Bouchard合成卡巴他赛的路线Fig.9 Bouchard’s synthesis route of Cabazitaxel
Simo等[40]以硫酸二甲酯或者碘甲烷直接与10-DABIII双甲基化,与四元环侧链缩合,对甲基苯磺酸催化下开环,得到卡巴他赛(图10)。该路线中使用了剧毒试剂硫酸二甲酯,安全和环保压力巨大。
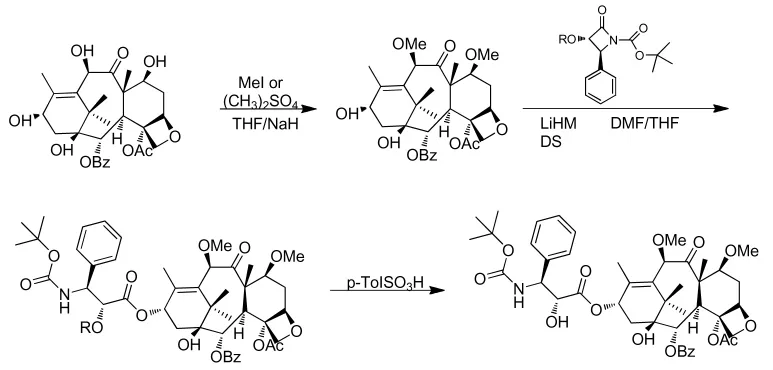
图10 Simo合成卡巴他赛的方法Fig.10 Simo’s synthesis route of Cabazitaxel
罗红等[41]以碘甲烷作为甲基化试剂,通过三步反应得到了卡巴他赛,双甲基化的母核与多西紫杉醇侧链在温和的条件下缩合、开环、酯化得到卡巴他赛(图11)。但是7,10位甲基化这一步收率偏低,不到40%。
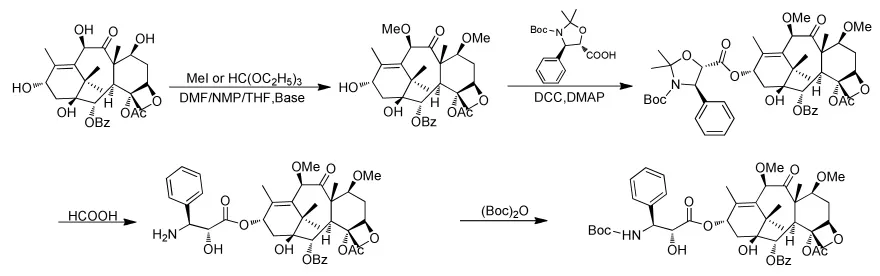
图11 罗红合成卡巴他赛的路线Fig.11 Luo Hong’s synthesis route of Cabazitaxel
5 结语
紫杉醇及其衍生物的半合成是最有效、最经济的方法,已经实现了工业化应用,为人类健康做出了重大贡献。随着合成技术的发展,将会有更便捷、更高效、更绿色的方法被应用到生产中。
[1] Wani M C,Talor H L,Wall M E,et al.Plant antitumor agents.VI.The isolation and structure of taxol,a novel and leukemic and antitumor agent from Taxus brevifolia[J].J.Am.Chem.Soc., 1971, 93: 2325-2327.
[2] Schiff P B,Fant J,Horwitz S B.Promotion of microtubule assembly in vitro by taxol[J].Nature, 1979, 277: 665-667.
[3] Williamson K A, Fenton C.Docetaxel: A review of its use in metastatic breast cancer[J].Drugs,2005, 65 (17):2513-2531.
[4] 姚和际.多烯紫杉醇研究进展及市场分析.中国制药信息,2001, 17(5):29-30.
[5]Galsky M D,Dritselis A,Kirkpatrick P,et al.Cabazitaxel[J].Nature reviews.Drug discovery, 2010, 9(9): 677.
[6] Kingston D G I.Taxol and its analogs[M].CRC Press:Boca Raton,FL,2005.
[7] Ojima I, Habus I, Zhao M, et al.New and efficient approached to the semisynthesis of taxol and its C13 synthon analogs by means of β-lactam synthon method[J].Tetrahedron, 1992, 48 (34): 6985-7012.
[8] Agat C B,Siddhartha G J,Joshodeep B,et al.A highly efficient synthesis of the C13 side-chain of Taxol using Shibasaki's asymmetric Henry reaction[J].Tetrahedron Lett., 2004, 45(18) :3689-3691.
[9] 郑云满,唐志军,杨会春,等.新的异丝氨酸酯衍生物及其制备方法:CN,101289432[P].2008-10-22.
[10]Holton R A,Beidiger R J.Certain alkoxy substituted taxanes and pharmaceutical compositions containing them:US,5243045[P].1993-09-07.
[11]Holton R A.Metal alkoxides: US, 5274124[P].1993-12-28.
[12]Zygmunt.C-2 hydroxyl protected-N-acyl (2R,3S)-3-phenylisoserine activated esters and methods for production thereof: US, 6143902[P].2007-11-07.
[13]Sisti.Methods and useful intermediates for paclitaxel synthesis from C-7, C-10 di-cbz 10-deacetylbaccatin III:US,6448417[P].2002-09-10.
[14]Sisti S.C-2'hydroxyl-benzyl protected,N-carbamate protected (2R,3S) -3-phenylisoserine and production process therefor: US, 6350887[P].2002-02-26.
[15]Sisti S.Method for paclitaxel synthesis:WO,1998013360[P].1998-04-02.
[16]阎家麒.紫杉醇手性侧链合成与紫杉醇半合成[J].精细与专用化学品, 2005, 18:1-6,11.
[17]Singh A K.Trifluoroacetic acid-mediated cleavage of a triethylsilyl protecting group:Application in the final step of the semisynthetic route to paclitaxel (Taxol).Org Process Res Dev., 2003, 7(1): 25-27.
[18]Kucera D J, Li W S, Thottathil J K, et al.Beta-lactams,methods for the preparation of taxanes,and sidechainbearing taxanes: US, 6350887[P].2002-02-26.
[19]Holton R A.Method for preparation of taxol using (beta)-lactam:US,5175315[P].1992-12-29.
[20]Nicolaou K C, Nantermet P G.Transformations of taxol:US,5504222[P].1996-04-02.
[21]Kung L R,Chang S S.Process for preparing taxoids from baccatin derivatives using lewis acid catalyst: US,2012149925[P].2012-06-14.
[22]VemishettiP.Semi-synthesis ofpaclitaxelusing orosilanes:WO,2000073293[P].2000-12-07.
[23]Kingston D G, Chaudhary A G, Gunatilaka, et al.Synthesis of taxol from baccatin III via an oxazoline intermediate[J].Tetrahedron Letters., 1994, 35(26):4483-4484.
[24]Cesare C,Michela C ,Monica D,et al.Taxol semisynthesis:A highly enantio and diastereoselective synthesis of the side chain and a new method for ester formation at c-13 using thioesters[J].J Org Chemistry, 1996, 28(49):4746-4755.
[25]Kanazawa A M,Denis J N,Greene A E,et al.Direct stereoselective synthesis of the protected paclitaxel (Taxol)side chain and high-yield transformation to paclitaxel[J].J Chem Soc Chem, Comm., 1994 (22): 2591-2592.
[26]康立涛,王刚,王涛,等.一种紫杉醇和多西紫杉醇的合成方法:CN,101088994[P].2007-12-19.
[27]付翠花,马回民.一种工业半合成紫杉醇的方法:CN,101863862[P].2010-10-20.
[28]冯虓,周志成,崔英杰.抗肿瘤药物紫杉醇的半合成方法:CN,103130753[P].2013-06-05.
[29]Bombardelli E.Intermediates and methods useful in the semisynthesis of paclitaxel and analogs: US, 5917062[P].1999-06-29.
[30]Gabetta B,Ciceri D.Process for the preparation of a taxane derivative: US, 7232916[P].2007-06-19.
[31]Sharma A P,Sarkar S,Mahanty JS.Method of preparation of anticancer taxanes using 3-[(substituted-2-trialkylsilyl)ethoxycarbon1]-5-oxazolidine carboxylic acids: US,20080064887[P].2008-06-26.
[32]Sharma A P,Sarkar S.Anticancer taxanes such as paclitaxel, docetaxel and their structural analogs, and a method for the preparationthereof: US, 2004073044[P].2004-04-15.
[33]Bombardelli E.A process for the preparation of taxanes from 10-deacetylbaccatin III: WO, 0052003[P].2000-09-08.
[34]Vemishetti P, Gibson F S, Dillon J L.Semi-synthesis of paclitaxel using dialkyldIchl orosilanes:WO,0073293[P].2000-12-07.
[35]Chai K B, Kim K.Process for preparing paclitaxel: WO,9808832[P].1998-03-05.
[36]Zamir L,Caron G,Zheng Y F.A family of canadensol taxanes,the semi-synthetic preparation and therapeutic use thereof: WO, 9817656[P].1998-04-30.
[37]Kim N D.Method of preparing taxane derivatives and intermediates used therein:WO,08075834[P].2008-06-26.
[38]ThottathilJK, Trifunovich ID.Methodsforthe preparation of taxanes using oxazolidine intermediates:EP,0735036[P].1996-03-19.
[39]Bouchard H, Bourzat J D, Commerçon A.Taxoids, their preparation and pharmaceutical compositions containing them:US,5847170[P].1998-12-08.
[40]Rampalli S, Purohit P, Pothana P, et al.Process for preparing amorphous cabazitaxel: US,14650296[P].2013-12-18.
[31]罗红,丁兆,孙朝园.一种卡巴他赛的合成方法:CN,104292188[P].2015-01-21.
