不同植物油水包油型乳状液物理特性及氧化稳定性研究
2018-05-31宁UNing崔俊杰金昱辰陈倩楠代春吉
刘 宁U Ning 崔俊杰 - 金昱辰 - 李 骋 陈倩楠 - 代春吉 -
(1. 陕西科技大学食品与生物工程学院,陕西 西安 710021;2. 陕西文冠果实业集团有限公司,陕西 淳化 711200)
乳状液是食品加工业中最重要的体系之一,一般指一相以液滴形式均匀分散在另一种与其互不相溶的液体中形成的体系。乳状液是热力学不稳定体系,在贮存过程中会出现失稳现象,包括聚结、奥氏熟化、絮凝和相转化[1]等。很多常见食品都涉及到乳化体系,且体系中含有大量多不饱和脂肪酸,如香肠和火腿肠、冷冻食品、植物蛋白饮料、乳饮料、面包、蛋糕、调味汁和调味酱等,这些产品制造、贮存和销售过程中常见的一个难题即是产品的氧化问题[2],油脂的氧化会降低产品的营养价值。
植物油含有不同的脂肪酸组成,在制备乳状液后的物理特性及氧化稳定性上存在差异。陈先鑫等[3]研究了乳清蛋白浓度对以玉米油为原料的乳状液的物理稳定性和氧化稳定性的影响,研究结果表明乳状液的物理稳定性和氧化稳定性随乳状液界面蛋白浓度的增加而增强。但其只选取了一种植物油,玉米油中不饱和脂肪酸含量较为丰富,未研究在乳清蛋白作用下,饱和脂肪酸含量较多的油脂为原料的乳状液的性质。为揭示不同植物油对乳状液稳定性的影响,本研究选取了4种脂肪酸组成差异较大的食用油,即葵花籽油、紫苏油、棕榈油和橄榄油,对其制备乳状液的物理特性进行了研究,评价了体系中的油脂氧化情况,以期为高质量、高稳定性的乳状食品开发提供参考。
1 材料与方法
1.1 材料与试剂
葵花籽油、橄榄油:中粮集团有限公司;
紫苏油:辽宁长白仙子生物科技有限公司;
棕榈油:南海油脂工业有限公司;
据油脂包装标签显示,以上油脂均未添加抗氧化剂。
乳清分离蛋白:美国格兰比亚乳品公司;
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、1,1,3,3-四乙氧基丙烷:分析纯,上海伯奥生物技术有限公司;
其他试剂均为分析纯。
1.2 主要仪器与设备
高压均质机:TTDF Basic型,英国TTDF公司;
分散机:FA25型,上海弗鲁克科技发展有限公司;
粒径分布仪:Mastersizer 2000型,英国Malvern Instruments公司;
电位分析仪:Mastersizer ZS型,英国Malvern Instru-ments公司;
荧光光谱仪:FS5型,英国 Edinburgh Instruments公司;
分光光度计:UV 2300型,上海天美科学仪器有限公司。
1.3 方法
1.3.1 乳状液样品的制备 参照文献[4]。具体步骤为:将准确称量的乳清分离蛋白溶于10 mmol/L磷酸缓冲液,配制浓度为1 g/100 mL的乳清分离蛋白分散液,室温下搅拌2 h,充分溶解后于4 ℃下过夜水化。次日,将蛋白分散液从冰箱取出,放至室温,调pH至7.0,待用。
向上述乳清分离蛋白分散液中分别加入10 g/100 mL植物油。将两相混合液在50 ℃下搅拌(600 r/min,30 min),再用分散机在10 000 r/min下剪切30 s,得到预乳状液。室温下(25 ℃)用高压均质机对样品先用50 MPa均质一次,然后在10 MPa下均质一次。最终制得乳清分离蛋白含量1%,油相分别为葵花籽油、紫苏油、棕榈油和橄榄油的新鲜O/W型乳状液。
1.3.2 粒径分布和平均粒径的测定 乳状液的粒径分布和平均粒径采用粒径分布仪进行测定,以蒸馏水或1 g/100 mL SDS溶液作为分散介质,设置参数颗粒折射率为 1.456,连续相的折射率为1.330,吸收参数0.001[5]。
1.3.3ζ-电位的测定 将乳状液用10 mmol/L磷酸缓冲溶液(pH 7.0)稀释100倍,采用电位分析仪测定乳状液的ζ-电位,参数设定:测定温度为25 ℃,散射角度为173°[6]。
1.3.4 絮凝指数的测定 根据 Puppo等[7]的方法测定新制乳状液/贮存24 h后乳状液的油滴絮凝指数(Flocculation index,FI),计算公式为:
(1)
式中:
FI——油滴絮凝指数,%;
D4,3-water、D4,3-1% SDS——乳状液在水和 1 g/100 mL SDS 分散剂中的体积平均粒径,μm。
1.3.5 初级氧化产物(POV值)的测定 根据Wan等[8]的方法,修改如下:将乳状液置于具塞试管中于50 ℃烘箱中氧化12 d,每天测定油脂ROOH浓度。取0.3 mL样品,与1.5 mL 异辛醇/异丙醇(3∶1,体积比)溶液混合,大力涡旋3次,每次10 s。3 000 r/min离心5 min,取200 μL上层有机相溶液与2.8 mL甲醇/1-丁醇(2∶1,体积比)混合液混合,加入50 μL 3.94 mol/L硫氰酸铵溶液和50 μL亚铁离子溶液(由0.132 mol/L氯化钡溶液和0.144 mol/L硫酸亚铁溶液按照体积比1∶1混合而成),振荡混合20 min,在510 nm下测吸光度。通过异丙苯氢过氧化物标准曲线计算样品中过氧化物浓度。
1.3.6 次级氧化产物(TBARS)的测定 根据程菁菁[9]的方法,修改如下:取2 mL TBA混合试剂于试管中,加入1 mL样品,混合后,95 ℃水浴加热15 min,然后冷却至室温,5 000 r/min 离心20 min,静置10 min后于532 nm下测定吸光值。通过1,1,3,3-四乙氧基丙烷标准曲线计算乳状液中TBARS浓度。
1.3.7 内源性荧光的测定 采用荧光光谱法测定,根据仇超颖[10]13-15的方法,修改如下:取100 μL乳状液,用pH 7.0的磷酸缓冲液(10 mmol/L)稀释到5 mL之后用4 mL的石英比色皿测定发射波长,扫描范围300~400 nm,激发波长283 nm,狭缝宽度10 nm。
1.4 数据分析
每个数据均为3次测定的平均值,采用Minitab 16进行数据分析,结果以均值±标准差表示。
2 结果与分析
2.1 乳状液的粒径分布及体积平均粒径分析
不同的植物油乳状液在经过高速剪切和两次均质后,大的脂肪球被破碎成小的脂肪球,并被乳清分离蛋白所包裹,使其更加均匀地分散在水介质中。乳状液中油滴的粒径大小是影响乳状液稳定性的一个重要指标,能直观地展示乳状液中油滴的分散状态[11]。SDS是一种良好的抗絮凝剂,可将乳状液中絮凝的油滴分散于水相中。一般地,乳状液中的油滴在1 g/100 mL SDS分散剂中的D4,3越小,乳状液的物理稳定性越好。
图1展示了不同植物油乳状液在1 g/100 mL SDS分散剂中的粒径分布。由图1可知,棕榈油、橄榄油、葵花籽油、紫苏油制备乳状液的粒径分布曲线主峰依次向横坐标左侧偏移,粒径逐渐减小,相同制备条件下,紫苏油可更好地形成均匀分散的乳状液。
不同乳状液样品在水和1 g/100 mL SDS分散剂中的D4,3值列于表1。由表1可知,在4种不同植物油的新鲜乳状液(0 h)中,以紫苏油制备乳状液的粒径最小,为0.824 μm(蒸馏水中测定);棕榈油的粒径最大,为1.845 μm;葵花籽油、橄榄油制备乳状液的粒径介于二者之间,可能与不同的植物油脂肪酸构成有关。经24 h贮存后,各样品的D4,3均有一定程度的增大。
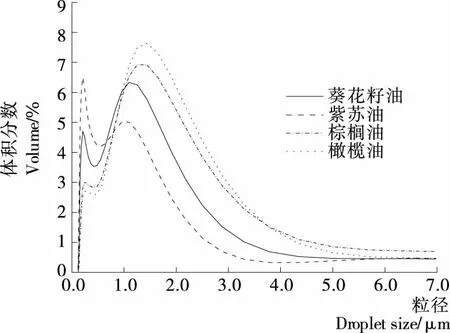
图1 乳状液的粒径分布Figure 1 Droplet size distribution of emulsions
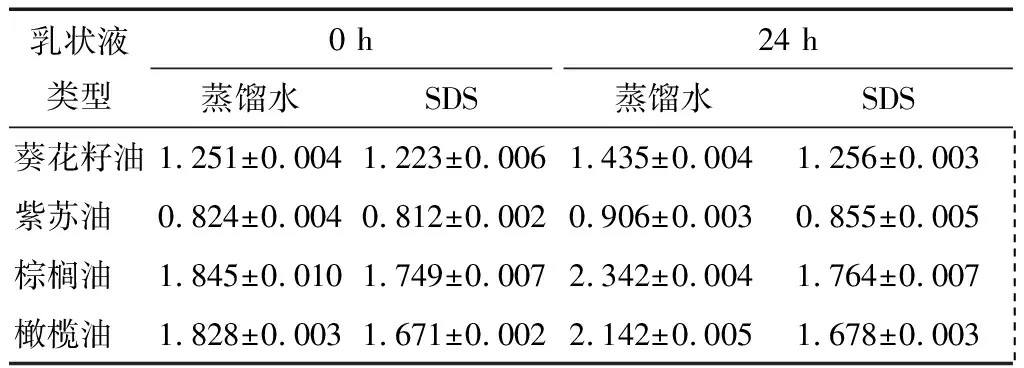
表1 乳状液的体积平均粒径D4,3Table 1 D4,3of emulsions μm
2.2 ζ-电位分析
油滴间排斥力的大小主要由油滴的表面电荷量所决定,而油滴表面电荷的多少可通过ζ-电位来反映,一般来说,对于电荷稳定的乳状液,其ζ-电位的绝对值越大,体系越稳定[12]。
图2为不同植物油制备新鲜乳状液的ζ-电位。由图2可知,所有样品中油滴均带有负电,这是因为乳状液的pH值(7.0)高于蛋白质的等电点,蛋白质带负电。4种不同植物油乳状液体系的ζ-电位的绝对值都较高,表明新鲜乳状液体系均比较稳定,其ζ-电位都在-30 mV以下。其中紫苏油乳状液的电位绝对值较大(-37.5 mV),而橄榄油和棕榈油相对较小,葵花籽油的电位值居于紫苏油和橄榄油之间。
2.3 絮凝指数分析
表2为新鲜乳状液和经24 h贮存后不同类型的乳状液絮凝指数变化。由表2可知,不同植物油新鲜乳状液的絮凝指数值均比较小,表现出一定的抗絮凝稳定性。室温环境下放置24 h后,乳状液絮凝指数均有所增大,其中棕榈油乳状液的絮凝指数变化最大,从5.489%增至32.766%,表明含棕榈油体系易发生絮凝。紫苏油乳状液的絮凝指数则变化较小,仅从1.478%增长到5.965%,体现了良好的抗絮凝稳定性。
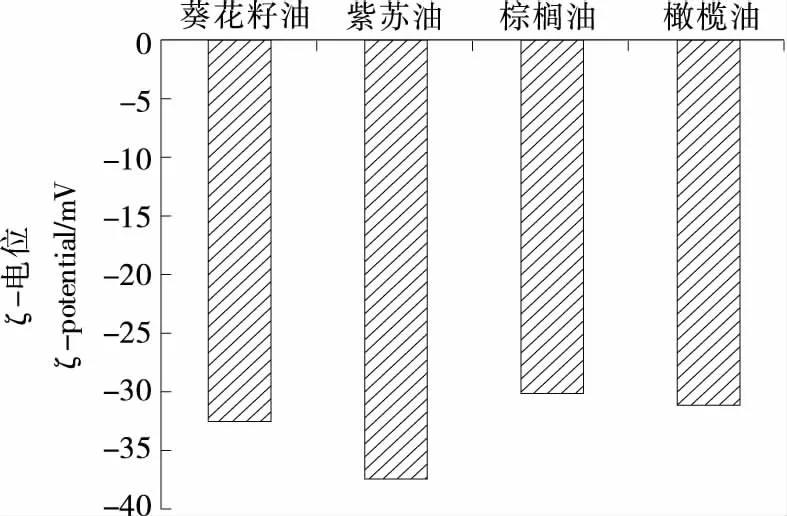
图2 乳状液的ζ-电位Figure 2 ζ-potential of emulsions
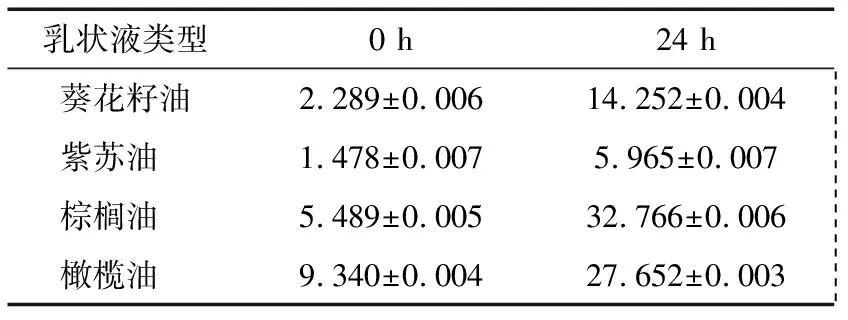
表2 乳状液的絮凝指数Table 2 Flocculation index of emulsions %
2.4 贮存稳定性分析
食品乳状液的贮存稳定性反映了体系中不相溶的油、水两相在乳化剂的作用下达到平衡的一种稳定状态。图3显示了不同类型乳状液(加入0.02%叠氮钠)在室温条件下放置 3周后的外观状态。可以发现,部分样品已经出现乳析现象。3周后,紫苏油样品未发生分层,仍为均匀乳白色分散的状态;棕榈油和橄榄油乳状液则出现了严重的分层现象,脂肪层上浮,水层清晰可见,有明显的分层界限;葵花籽油体系则介于它们之间,出现了一定程度的分层现象。这一现象与不同样品的粒径分布及ζ-电位大小趋势类似。陈振家等[13]的研究结果也表明,乳状液中油滴的粒径越大,则越容易发生聚结分层;粒径越小,乳状液越稳定,乳状液的分层程度与粒径具有相关性。另一方面,乳状液的物理稳定性还取决于油滴间的静电排斥力和相互吸引力之间的平衡,ζ-电位的绝对值越大,体系越稳定。

图3 乳状液在室温存放3周后的外观状态Figure 3 Appearance status of emulsions after 3 weeks storage at room temperature
2.5 乳液油脂的氧化稳定性分析
2.5.1 初级氧化分析 乳状液体系中油脂的氧化程度是衡量乳状液食品质量的一项重要指标,氢过氧化物(POV值)可以直观地反映乳状液中油脂的初级氧化情况[14]。图4为不同植物油的乳状液在贮存7 d内(50 ℃恒温)氢过氧化物浓度的变化情况。由图4可知,4种不同类型乳状液在贮存期间POV值都呈现出明显的增长趋势,其中紫苏油乳状液的增长最为明显,棕榈油的增长则稍缓慢,其他样品的氧化程度则介于二者之间。这可能与油相的脂肪酸组成有关。经测定,选取的4种植物油中,紫苏油的多不饱和脂肪酸——亚麻酸含量最高,为65.34%;而棕榈油的饱和脂肪酸——棕榈酸含量最高,为40.96%。试验结果整体表现为,多不饱和脂肪酸含量越高,体系越易被氧化;饱和脂肪酸含量越高,则越稳定。这与纯油体系的油脂氧化规律基本一致。
从图4还可发现,橄榄油乳状液的氧化程度仅次于紫苏油,而强于葵花籽油;但其脂肪酸组成中多不饱和脂肪酸占比相对葵花籽油更低。可能是由于橄榄油乳状液较大的脂肪球粒径,导致脂肪在贮存的过程中发生了部分聚结,失去了黏弹性蛋白层的保护,使油滴暴露了出来,加速了氧化。
2.5.2 次级氧化分析 乳状液油脂的次级氧化是指初级氧化产物进一步分解成小分子产物的过程,这些小分子具有难闻气味,是乳状液中油脂酸败产生油哈味的内在根源[15]。图5是乳状液在恒温贮存期间生成油脂次级氧化产物的情况。可以发现,油脂次级氧化速率的变化趋势与初级氧化基本一致,但在次级氧化中,紫苏油的氧化趋势更加迅猛,说明次级氧化产物的生成速率与初级产物的积累有关。
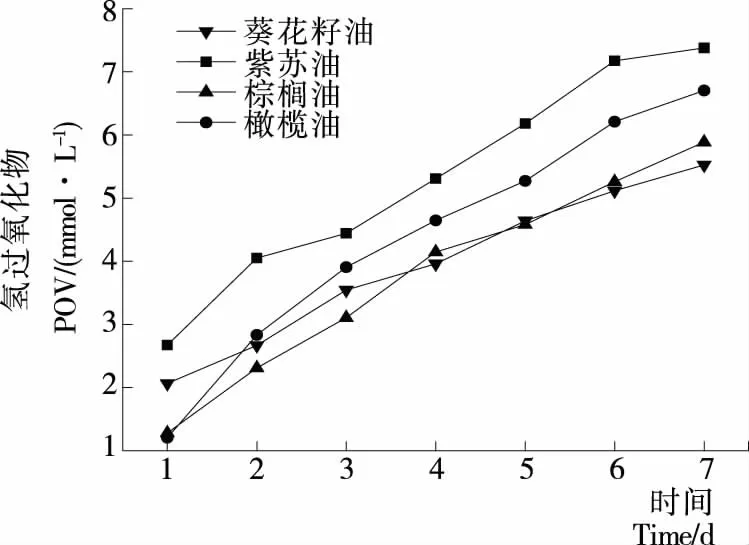
图4 乳状液在贮藏7 d内油脂氢过氧化物的生成情况
Figure 4 Evolution of lipid hydroperoxides in emulsions upon accelerated storage up to 7 days
2.6 乳液中蛋白质氧化分析
蛋白质中的色氨酸荧光吸收光谱强度的变化可以反映蛋白质的氧化情况[16]。色氨酸荧光强度的变化主要是在脂质氧化初级阶段生成的自由基导致色氨酸降解,蛋白质氧化的羰基反应产物又参与到蛋白质氨基与脂肪氧化产物(醛类)的损伤交联形成席夫碱的反应过程[17]。
从图6可以看出,不同植物油乳状液在贮存7 d后,色氨酸荧光强度均有下降,表明均有蛋白质的氧化情况发生。其中紫苏油和橄榄油乳状液发生了大幅度的下降,棕榈油下降程度较小,而葵花籽油的变化程度介于紫苏油和橄榄油之间。上述不同体系的蛋白氧化结果与图5、6中脂肪氧化结果相一致,表明乳状液中蛋白质氧化和脂质氧化之间具有相关性。这一结论与仇超颖[10]34-35在脱酰胺醇溶蛋白乳状液的氧化稳定性研究结果相近。
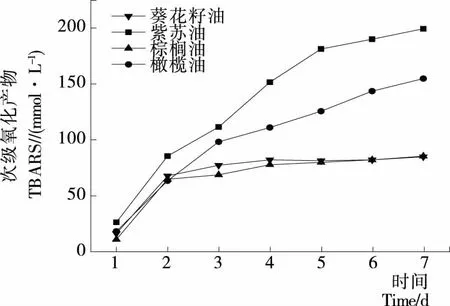
图5 乳状液在贮藏7 d内TBARS生成情况
Figure 5 Evolution of thiobarbituric acid reactive substances (TBARS) in emulsions upon accelerated storage up to 7 days

图6 乳状液在存贮过程中色氨酸荧光吸收波长的变化Figure 6 Changes of fluorescence absorption wavelength of tryptophan in emulsions during storage
3 结论
本试验制备了以4种植物油(葵花籽油、紫苏油、橄榄油、棕榈油)为油相的乳化体系,探究不同植物油乳状体系的性质。结果发现,紫苏油乳状液的D4,3最小,ζ-电位绝对值最高,呈现良好的物理稳定性;但由于油相中有较高的不饱和脂肪酸,乳液氧化稳定性最差。棕榈油含有较多的饱和脂肪酸,体系表现出良好的氧化稳定性,但其D4,3在4种乳状液中最大,ζ-电位绝对值最低,导致其物理稳定性较差。通过对贮存过程中乳状液油脂氧化程度和蛋白氧化程度的分析,发现二者存在着一定的相关性,一般来说,体系油脂氧化程度越高,其相应的蛋白氧化程度也越显著。
[1] FALKEBORG M, GUO Zheng. Dodecenyl succinylated alginate (DSA) as a novel dual-function emulsifier for improved fish oil-in-water emulsions[J]. Food Hydrocolloids, 2015, 46(4): 10-18.
[2] 余辉, 陈洁, 代衍峰. 大豆油乳状液体系氧化稳定性影响因素的研究[J]. 食品与机械, 2007, 23(2): 43-46.
[3] 陈先鑫, 马晓宇, 朱雯婷, 等. 乳清蛋白乳液界面性质及其物理稳定性和氧化稳定性的研究[J]. 食品工业科技, 2016, 37(4): 155-164.
[4] 邵云. 大豆蛋白稳定乳状液的物化性质及油脂氧化稳定性研究[D]. 广州: 华南理工大学, 2014: 11-13.
[5] TANG Chuan-he, CHOI Siu-mei, MA Ching-yun. Study of thermal properties and heat-induced denaturation and aggregat-ion of soy proteins by modulated differential scanning calorime-try[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104.
[6] 李群英, 廖红梅, 方正, 等. 牛至精油-白藜芦醇乳液的制备及抑菌活性研究[J]. 食品与机械, 2017, 33(3): 110-120.
[7] PUPPO M C, BEAUMAL V, SPERONI F, et al.β-Conglycinin and glycinin soybean protein emulsions treated by combined temperature-high-pressure treatment[J]. Food Hydrocolloids, 2011, 25(18): 389-397.
[8] WAN Zhi-li, WANG Jin-mei, WANG Li-ying, et al. Complexation of resveratrol with soy protein and its improvement on oxidative stability of corn oil/water emulsions[J]. Food Chemistry, 2014, 161(6): 324-331.
[9] 程菁菁. WPI与表面活性剂相互作用对水包核桃油乳液的影响[D]. 西安: 陕西科技大学, 2015: 14-16.
[10] 仇超颖. 脱酰胺小麦醇溶蛋白结构、界面性质及其乳浊液稳定性的研究[D]. 广州: 华南理工大学, 2014.
[11] 沈兰, 王昌盛, 唐传核. 高压微射流处理对大豆分离蛋白构象及功能特性的影响[J]. 食品科学, 2013, 33(3): 72-76.
[12] 王金梅, 夏宁, 杨娟, 等. 天然和热处理大豆蛋白稳定乳状液的性质研究[J]. 中国粮油学报, 2012, 27(9): 16-20
[13] 陈振家, 郝利平. pH值和离子强度对大豆分离蛋白功能特性的影响[J]. 农产品加工·学刊, 2008(4): 8-12.
[14] SHAO Yun, TANG Chuan-he. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions:Influ-ence of ionic strength and heat pretreatment[J]. Food Hydrocolloids, 2014, 37(2): 149-158.
[15] HORN A F, NIELSEN N S, ANDERSEN U, et al. Oxidative stability of 70% fish oil-in-water emulsions: Impact of emulsifiers and pH[J]. European Journal of Lipid Science and Technology, 2011, 113(10): 1 243-1 257.
[16] RAMPON V, LETHUAUT L, MOUHOUS-RIOU N, et al. Interface characterization and aging of bovine serum albumin stabilized oil-in-water emulsions as revealed by front-surface fluorescence[J]. Journal of Agricultural and Food Chemistry, 2001, 49(26): 4 046-4 051.
[17] ESTEVEZ M, KYLLI P, PUOLANNE E, et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science, 2008, 80(32): 1 290-1 296.
