发酵麦麸对面包面团生化特征及烘焙学特性的影响
2018-05-31杨文丹Wendan杨紫璇郑建仙黄卫宁
杨文丹 Wen-dan - 庄 靓 杨紫璇 - 蒋 慧 徐 岩 郑建仙 - 黄卫宁 -
(1. 江南大学食品科学与技术国家重点实验室, 江苏 无锡 214122;2. 江南大学生物工程学院工业生物技术教育部重点实验室, 江苏 无锡 214122;3. 华南理工大学轻工与食品学院,广东 广州 510640)
膳食纤维能预防多种现代病,如糖尿病、肥胖症等[1],因此越来越受到消费者的关注[2],作为西方主流食品的烘焙食品是膳食纤维的良好载体[3]。麸皮是一种成本较低且富含膳食纤维的烘焙原料,而将麸皮应用到面包生产中存在巨大的挑战[4-5]。严晓鹏等[6]发现复配型酶制剂通过协同作用降解麸皮中的纤维素和木聚糖,可减少其对面团的劣化作用,强化面筋结构,提高面团柔软度;熊俐等[7]提出纤维素主要影响新鲜面包品质,而木聚糖酶可以延缓麸皮面包老化。由此可见,酶在高膳食纤维面包制作过程中起着重要的作用[8]。
马克斯克鲁维酵母(MarxKluyveromyces)是一种新型的食品安全级酵母,相比传统酿酒酵母,它除了具有生长快,生物量高,耐高温等特点[9],还可以利用麸皮、玉米浆等发酵生产酶类、乙醇及其它活性成分[10]。有研究表明马克斯克鲁维酵母在底物诱导下能够分泌木聚糖酶、葡聚糖酶[11]及β-葡萄糖苷酶[10]等纤维素水解酶,在工业发酵领域存在巨大的应用潜力。面包面团中富含多糖、蛋白等多种成分,这些分子在面包制作过程中发生复杂的相互作用,面团体系的化学组分及流变学特性都会发生相应变化[12]。目前,关于马克斯克鲁维酵母发酵麦麸作为功能配料在烘焙产品中的应用未见报道。
本研究选用马克斯克鲁维酵母发酵麦麸制得富含天然酶的功能配料,分析麦麸发酵过程中的生化变化,并将其用于高膳食纤维面包制作中,旨在评估马克斯克鲁维酵母发酵麦麸中的天然酶对面包面团品质的影响,为开发天然、营养的高膳食纤维面包功能配料提供一定的理论依据。
1 材料与方法
1.1 材料和仪器
麦麸:河北省辛集市福之园面业有限公司;
高级面包粉:中粮面业(秦皇岛)鹏泰有限公司;
马克斯克鲁维酵母(MarxKluyveromyces):ATCC36534,上海一研生物科技有限公司;
羧甲基纤维素钠(CMC-Na):化学纯,国药集团化学试剂有限公司;
福林酚试剂:分析纯,国药集团化学试剂有限公司;
木聚糖:优级纯,美国Sigma公司;
搅面缸:SM-25型,新麦机械(无锡)有限公司;
数显恒温水浴锅:HHS-21-4型,上海博讯实业有限公司医疗设备厂;
混合实验仪:Mixolab2型,法国Chopin公司;
发酵流变仪:F3型,法国Chopin公司;
质构仪:CT3型,美国Brookfield公司;
冷场发射扫描电子显微镜:SU8220型,日本HITACHI公司;
物性测试仪:TA·XT2i型,英国Stable Micro System公司。
1.2 试验方法
1.2.1 发酵麦麸的制作 将马克斯克鲁维酵母在YM培养基中活化至对数后期,于4 000 r/min离心10 min,收集菌泥并洗涤2次;用无菌生理盐水将菌泥配制成4×107CFU/mL悬浮液。取100 g麦麸,接种12 mL菌悬液调制成DY190的麦麸面团,在30 ℃培养箱连续培养48 h,每6 h取样,直接用于酸度、菌落数和酶活测定。
1.2.2 面包面团的制作
(1) 麦麸面包面团(bran dough, BD):80%高筋粉和20%麦麸。
(2) 马克斯克鲁维酵母发酵麦麸面包面团(fermented bran dough, FBD):80%高筋粉和20%发酵24 h的麦麸。
(3) 木聚糖酶改良面包面团(bran dough with xylanase, XBD):80%高筋粉,20%麦麸和木聚糖酶(60 U/100 g)。
(4) 复合面包面团(fermented bran dough with xylanase, FXBD):80%高筋粉,20%发酵24 h的麦麸和木聚糖酶。面团搅拌后(10 min),醒发后(2 h)及焙烤后(冷却2 h)分别取样,进行冷冻干燥及磨粉处理,过80目筛用于化学分析。
1.2.3 pH及总可滴定酸度(TTA)的测定 根据AACC方法(2000)02-52,分别取10 g发酵麦麸于锥形瓶中,加入90 mL 蒸馏水,磁力搅拌30 min,静置10 min,测定pH。用0.1 mol/L的NaOH 滴定至 pH 8.6,消耗的NaOH体积即为TTA,每个样品至少重复操作3次。
1.2.4 酵母菌数的测定 按GB 4789.15—2010执行。
1.2.5 酶活测定 取5 g发酵麦麸于离心管中,加入20 mL醋酸钠缓冲液(0.5 mol/L、pH 5.0)混合均匀,于30 ℃摇床提取60 min,并在4 ℃、10 000 r/min离心20 min,取上清液4 ℃ 储藏备用。根据DNS法,分别以木聚糖[13]和羧甲基纤维素(CMC)[14]为底物测定木聚糖酶和纤维素酶活力。1个酶活力单位(U)定义为:每分钟底物转化为1 μmol木糖/葡萄糖所需的酶量。分别以木糖/葡萄糖标准曲线计算酶活。参照Espinoza等[15]的方法,将500 μL粗酶液加入到600 μL预热的阿魏酸甲酯溶液(2 mg/mL)中,在45 ℃下保温10 min,将1 mL反应混合物加入到2.5 mL终止剂(10 mmol/L 甘氨酸缓冲液,用NaOH调节pH至10)中,空白组以缓冲液代替酶液。在325 nm下测定吸光值,以1 000~1 500 mmol/L阿魏酸绘制标准曲线;1个酶活力单位定义为:每分钟产生1 μmol 阿魏酸所需的酶量。
1.2.6 可溶性糖含量变化 采用间苯三酚法[16]测定面包面团中可溶性阿拉伯木聚糖(WEAX)含量。称取0.1 g粉,加入30 mL去离子水超声提取20 min,沸水提取30 min,提取液4 000 r/min离心10 min,收集上清液到100 mL容量瓶;用30 mL去离子水洗涤沉淀,室温震荡10 min,离心并合并上清液,定容至100 mL。采用苯酚-硫酸显色法[17]测定样品中可溶性碳水化合物含量。
1.2.7 游离酚的释放量 称取面包面团样品5.0 g,加入70 ℃ 预热的70%甲醇溶液25 mL,玻璃棒搅拌均匀,70 ℃下浸提10 min,不断搅拌,冷却后于4 000 r/min离心20 min,残渣重复提取1次,合并上清液定容至50 mL,锡纸包好备用。取0.5 mL提取液,加入2.5 mL福林酚试剂,迅速加入2.0 mL 7.5% Na2CO3溶液,室温避光反应60 min,在765 nm处测定吸光值[16]。
1.2.8 面团表观黏度 将1.2.1中松弛后的适量面团放进质构仪专用盒中,盒盖穿孔可调底。样品通过盖子挤压抬高底部直至被挤压到1 mm厚。挤压停止后,通过降低顶部释放压力。1 min松弛后,玻璃探头下降挤压面团表面。将探头从面团表面分离所需要的力记录下来。每个样品重复10次及以上,面团的黏度即读取的面团黏度平均值。
1.2.9 面团热机械学特性 采用混合试验仪对面包面团搅拌性能进行测定。采用Chopin+协议对5个面团的吸水率、面团形成时间和稳定时间进行测定。
1.2.10 面团发酵特性 采用发酵流变仪测定面包面团延伸特性和持气能力。取面团250 g放入发酵篮中,测试条件:温度38 ℃,面团重量250 g,砝码2 000 g,测试时间3 h。每个样品至少重复3次,取平均值。
1.2.11 扫描电镜 挑取2 g醒发后(2 h)的面团置于青霉素瓶中进行固定(3%戊二醛),用磷酸盐缓冲液(0.1 mol/L)漂洗3次后,再次进行固定(1%四氧化二锇),用磷酸缓冲液(0.1 mol/L)进行反复冲洗后,再用不同浓度的乙醇(30%,50%,70%,90%,100%)进行梯度洗脱,最后用醋酸异戊酯对乙醇进行置换,再经过干燥、离子溅射喷金等处理后,用扫描电镜进行观察。
1.2.12 面包烘焙品质分析 将1.2.1中的4种面团在38 ℃/85% 条件下醒发100 min,放进烤箱(170 ℃/210 ℃)焙烤20 min,冷却2 h后,采用菜籽替代法对面包比容进行测定,按式(1)计算比容;用切片机将面包切成1 cm的均匀薄片,取中央完整均匀的两片面包进行全质构测定。
(1)
式中:
s——比容,mL/g;
v——面包体积,mL;
m——面包质量,g。
1.2.13 数据分析 采用 SPSS 17.0 及Excel 2016 分析软件进行数据统计分析,运用方差分析法(ANOVA) 进行显著性分析,显著差异水平取P≤0.05。
2 结果与讨论
2.1 麦麸发酵过程中酸度变化及酵母菌生长情况
由图1可知,发酵前期(0~18 h)马克斯克鲁维酵母经过短暂停滞期后即进入对数增长期,活菌数量从1.7×106CFU/g 增长至1.3×108CFU/g,产酸量也不断积累;发酵中期(18~30 h),酵母菌生长处于稳定期,活菌数保持在108CFU/g;发酵后期(30~48 h),酵母菌发生明显衰败,可能还伴随着杂菌的生长。发酵过程中,样品中可滴定酸(TTA)含量从7.8 mL(0 h)上升至18.8 mL(48 h),增加了141%,而pH值仅下降了7.81%,说明马克斯克鲁维酵母在发酵过程中释放了有机酸,且麦麸具有较强缓冲能力[18]。值得一提的是,发酵麦麸酸度增加主要发生在发酵前期(0~18 h)和发酵后期(30~48 h),可能是前期酵母菌生长旺盛,释放或激活多种水解酶类产生大量有机酸;而后期产酸主要是腐败菌导致的,与菌落生长情况保持一致。
马克斯克鲁维酵母通过改变环境pH值影响了各种水解酶活力,有学者认为酸面团低pH(3.9~4.1)环境会激活面粉中蛋白酶和淀粉酶活力[19],而阿魏酸酯酶和β-葡萄糖苷酶最适pH为5.0~7.0[20]。纤维素降解酶(内切、外切β-葡聚糖酶)最适作用pH值相对较低(5.0)[21],植物内源性木聚糖酶最适pH 6.0~6.5[22]。当然,发酵麦麸的pH值受到菌株来源、发酵条件及原料组成的影响。
2.2 麦麸发酵过程中酶活力变化
纤维素酶可以破坏纤维素非结晶区,随机水解β-1,4-糖苷键将较长的纤维素分子链降解成具有还原性末端的小分子片段及单糖[23-24]。如图2所示,随着发酵时间的延长,纤维素酶活力先增加后下降,发酵6 h时纤维素酶活力增加至3倍,发酵后期(30~48 h)纤维素酶活力保持在较低水平(0.300 U/g),可能与酶底物抑制有关[25]。麦麸本身具有较高的内源性木聚糖酶活力(0.238 U/g),与Gurpreet等[14]研究结果相近。发酵前期(0~12 h),发酵麦麸面团中木聚糖酶活力发生明显的上升,酶活力最高达0.354 U/g。伴随着发酵时间的延长,木聚糖酶活力受到抑制,发酵后期(30~48 h)木聚糖酶活力低于0.100 U/g。

图1 发酵麦麸pH、TTA和酵母菌数量的变化Figure 1 pH, TTA and microbial counts during fermented process of wheat bran
由图2还可以看出,随着发酵时间的延长,阿魏酸酯酶活力略有提高随后降低;发酵36 h时,发酵麦麸中阿魏酸酯酶活水平最高为0.16 U/g,相比发酵0 h酶活提升了39%。但是,在本研究中马克斯克鲁维酵母发酵麦麸代谢的阿魏酸酯酶活力远低于黑曲霉[26]等。研究[27]表明,阿魏酸酯酶活性与体系pH值密切相关。酵母菌发酵麦麸时酸化作用较弱且麦麸具有较强缓冲能力,体系pH值维持在6.0左右[图1(a)],接近肉桂酰酯酶最适pH值(7.0),而乳酸菌发酵产生大量的有机酸(pH 4.0左右)抑制了肉桂酰酯酶活性。

图2 发酵麦麸中纤维素酶、木聚糖酶和阿魏酸酯酶活力的变化
Figure 2 Cellulase, xylanase and feruloyl esterase activities during fermented process of wheat bran
2.3 面包制作过程中可溶性糖和游离酚含量变化
表1、2中显示了原料、面团及面包中WEAX含量的变化情况。小麦粉、麦麸中WEAX含量分别为3.24,8.01 mg/g,经过24 h发酵的麦麸中WEAX含量增加了2.23倍(P≤0.05)。在和面阶段强烈的机械搅拌作用下,面团中各组分得以充分混匀,木聚糖酶与底物充分接触反应。富含天然酶的发酵麦麸面团(FBD)和木聚糖酶面团(XBD)中WEAX含量分别比BD高出45%和36%,FXBD面团中WEAX含量最高,达到6.68 mg/g,说明发酵过程代谢的木聚糖酶和添加的木聚糖酶对WEAX含量增加具有协同作用。醒发及焙烤后,4种面团中WEAX含量都有明显增加(醒发后增加范围为11%~34%;焙烤后增加范围为45%~62%),这是由在醒发过程中和焙烤初期,麦麸内源性木聚糖酶和微生物来源木聚糖酶持续作用引起的,尤其在焙烤初期,木聚糖酶的活力与其耐热性密切相关[28]。Priscilla等[29]研究表明,大部分的水不溶性阿拉伯木聚糖(WUAX)在搅拌和醒发过程中发生溶解,焙烤过程中部分WEAX会与其他组分通过化学链接或物理缠绕变得不可溶。
水溶性碳水化合物包括可溶性淀粉、纤维素、半纤维素、果胶等糖类物质,WF中主要的碳水化合物是淀粉,且含量远高于WB。经过马克斯克鲁维酵母发酵,FB中可溶性碳水化合物含量略有上升(表1)。相比BD,FBD和FXBD具有较高的可溶性碳水化合物含量,这是因为发酵促进难溶性纤维素的降解。木聚糖占碳水化合物比例较低,因此木聚糖酶对水溶性碳水化合物含量影响非常小。醒发后,面团中可溶性膳食纤维含量有所降低,可能是可发酵糖类作为酵母碳源被利用。但是不可否认的是,醒发过程中面团中纤维素降解酶类仍然会发生作用。焙烤后,面包中水溶性碳水化合物进一步降低,可能是由于还原糖类和氨基化合物发生了美拉德反应生成一些难溶性聚合物。
表1小麦粉、麦麸及发酵麦麸中可溶性糖和游离酚含量†
Table 1 The content of soluble sugar and free phone of wheat flour, wheat bran and fermented wheat ran
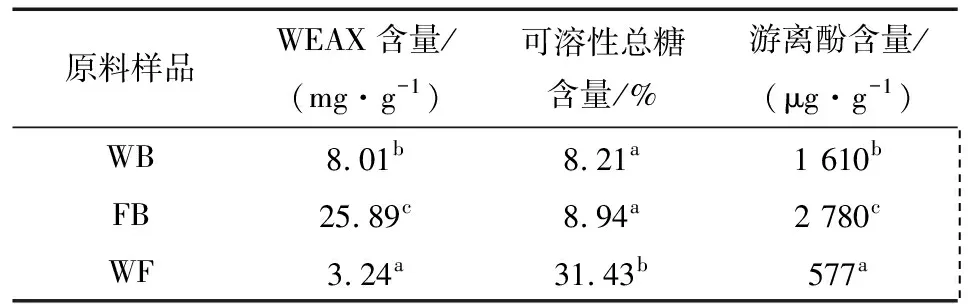
原料样品WEAX含量/(mg·g-1)可溶性总糖含量/%游离酚含量/(μg·g-1)WB8.01b8.21a1 610b FB25.89c8.94a2 780c WF3.24a31.43b577a
† WB为麦麸;FB为马克斯克鲁维酵母发酵24 h的麦麸;WF为小麦粉。同一列数据中标有不同小写字母表示组间差异显著(P≤0.05)。
由表1可知,麦麸(WB)中游离酚酸含量高达1 610 μg/g(约是WF的2.8倍),经过24 h发酵麦麸(FB)中游离总酚含量增加至1.7倍。面团面包制作过程中游离总酚含量与WEAX含量变化趋势相同,这都归因于内源或者外源纤维素酶对细胞壁的广泛降解作用[30]。

表2 面团搅拌、醒发和焙烤过程中可溶性糖和游离酚含量的变化†Table 2 The change of the content of soluble sugar and free phone of dough during bread making
† 同一列数据中标有不同小写字母表示组间差异显著(P≤0.05)。
2.4 面团微观结构
4种麦麸面团(BD、FBD、XBD和FXBD)经过2 h醒发后分别在不同放大倍数的扫描电镜下观察,结果见图3。从BD面团中可以观察到明显的粗纤维片段,这些片段从空间位置上阻断了面筋的连续性,面筋结构呈现出断裂、稀疏且不均匀。这可能是由于大量的难溶性阿拉伯木聚糖与面筋蛋白竞争水分子,导致面筋水合不充分[31]。木聚糖酶处理对面团中面筋结构的影响并不明显,但是较大纤维素片段数量显著减少。从FBD和FXBD面团中可以观察到明显的片状面筋蛋白,在其之间有粗细不同的面筋束相互交联,几乎看不到断裂的面筋碎片和粗纤维片段。
面团发酵过程中,酵母产生大量的CO2充斥在面筋网络中形成气孔,这些气孔多为中小尺寸且分布均匀[31]。如图3所示,BD面团结构致密,几乎没有看到明显的气孔; XBD面团含有少量不规则孔隙,而FBD和FXBD面团中气孔分布均匀且边缘平滑。这都归因于发酵麦麸中富含多种纤维素水解酶类促进纤维素溶解[15],有利于酵母产气及面团持气。微观结构分析显示,马克斯克鲁维酵母发酵麦麸制作的面包面团中面筋网络结构更加均匀、连续;面团产气和持气性能较好。
2.5 面包面团流变发酵特性及烘焙学特性
表面胶黏的面团对于现代工业化生产加工非常不利,这些面团不仅容易粘住加工设备而导致食品生产线受阻,还会造成产品质量下降和货架期缩短[12]。搅拌后XBD面团中WEAX含量与FBD相当(表2),但是前者表面更加胶黏。这可能与木聚糖酶的底物偏好性有关,Verjans等[29]研究认为外源木聚糖酶更倾向作用于可溶性木聚糖,生产较多的小分子木聚糖片段增加面团黏度。令人惊讶的是,FXBD面团表观黏度与FBD面团相近,并未受到添加的木聚糖酶影响(表3)。
相比BD面团,FBD面团的吸水率降低了5.64%,形成时间和面团稳定时间分别增加了46.17%和44.85%。这是由于发酵麦麸中的天然酶(图2)影响了麦麸中阿拉伯木聚糖的溶解性,进而改变了面团中水分子分布状态。由表3可知,与BD相比,FBD和FEBD最大程度提升了面团的发酵高度(23.60%~26.73%)和持气率(18.77%~18.91%),且仅添加木聚糖酶对面团的发酵特性影响较小。这可能是发酵麦麸中的多种水解酶促进难溶性纤维素溶解,面筋网络结构呈现出连续性;而仅添加木聚糖酶倾向作用于可溶性木聚糖,对面筋网络影响较小,与面团微观结构(图3)和WEAX含量变化(表2)结果保持一致。
富含天然酶的发酵麦麸和木聚糖酶对面包比容的影响与面团发酵特性保持一致(表3)。正如微观结构所示(图3),BD面团面筋断裂且气孔稀少,面包比容只有4.49 mL/g。相比BD面团面包,FBD和XBD面包比容分别提高了10.69%和2.90%,而FXBD面包提高了17.15%。除了面团膨胀体积,面包比容也受到面包水分含量(质量)的影响[32]。值得一提的是,FXBD面包芯硬度非常小,表明FXBD面包具有较柔软的面包芯结构。这都归因于马克斯克鲁维酵母发酵麦麸中麸皮内源酶,酵母代谢酶及添加的木聚糖酶活力[31]的影响。

图3 马克斯克鲁维酵母发酵麦麸对面团微观结构的影响Figure 3 Effects of fermented bran with Marx Kluyveromyces on microstructure of doughs.

表3 马克斯克鲁维酵母发酵麦麸对面包面团流变发酵特性和烘焙学特性的影响†Table 3 Effects of fermented bran with Marx Kluyveromyces on dough rheology, fermentation and baking characteristics
† 同一列数据中标有不同小写字母表示组间差异显著(P≤0.05)。
3 结论
马克斯克鲁维酵母在麦麸基质中生长良好,发酵过程中可滴定酸含量(TTA)显著增加,而pH值维持在6.0左右,使这些天然酶(纤维素酶、木聚糖酶和阿魏酸酯酶)在面包制作过程中保持活力;在面团醒发和焙烤初期可溶性糖和游离酚含量显著增加,赋予面包较好的营养价值。扫描电镜(SEM)观察发现:相比仅添加木聚糖酶的麦麸面团,富含天然酶的发酵麦麸面团中面筋网络结构更加均匀、连续,气孔更加细腻光滑。与麦麸面包面团相比,添加发酵麦麸的面团稳定时间长、持气率高且比容较大。值得关注的是,富含天然酶的发酵麦麸和木聚糖酶结合使面包比容进一步提高,且面包芯硬度显著(P≤0.05)降低。马克斯克鲁维酵母在高膳食纤维面包体系中有良好的应用潜力。
[1] 黄卫宁, 邹奇波, 王凤, 等. 一种含有高磷脂酶活性脂肪酶和半纤维素酶的高膳食纤维健康面包及其生产方法: 中国, 201410485786.0[P]. 2015-01-21.
[2] 钟京, 王凤, 刘娜, 等. 乳酸菌发酵麸皮酸面团对高纤维面包面团流变发酵学及烘焙特性的影响[J]. 食品工业科技, 2013, 34(9): 49-54, 57.
[3] ZHU Hui-yan, WANG Feng, HUANG Wei-ning, et al. Rheofermentometer fermentation and breadmaking characteristics of dough containing xylo-oligosaccharide hydrolyzate from wheat bran[J]. J Agric Food Chem, 2010, 58(3): 1 878-1 883.
[5] 孙银凤, 徐岩, 黄卫宁, 等. 不同发酵基质的酸面团对酵母面团体系面包烘焙及老化特性的影响[J]. 食品科学, 2015, 36(13): 37-42.
[6] 严晓鹏, 王璋, 许时婴. 酶制剂对于麸皮面包的改良研究[J]. 食品添加剂, 2007(1): 206-209.
[7] 熊俐, 曹新志, 吕开斌, 等. 复合菌和酶制剂在麸皮面包品质改良上的应用[J]. 食品研究与开发, 2013, 34(16): 22-25.
[8] 黄卫宁, 王晓燕, 郑建仙, 等, 新型高膳食纤维法式发酵面包及其生产方法: 中国, 201110423119.6[P]. 2012-06-27.
[9] 吴玥, 周峻岗, 吕红. 信号肽对木聚糖酶在马克斯克鲁维酵母中分泌表达的影响[J]. 复旦学报, 2017, 56(4): 446-454.
[10] FONSECA G G, HEINZLE E, WITTMANN C, et al. The yeast Kluyveromyces marxianus and its biotechnological potential[J]. Appl Microbiol Biotechnol, 2008, 79(3): 339-354.
[11] 陈成, 汪洪涛, 陈宝宏, 等. 马克斯克鲁维酵母发酵产β-葡聚糖工艺优化[J]. 食品工业, 2015, 36(1): 133-136.
[12] 黄卫宁, 贾春利, 李先玉, 等. 食品(面团)体系表面胶粘性的流变学机理及其表征[J]. 食品与生物技术学报, 2006, 25(2): 120-126.
[13] ZHANG Hui, SANG Qing. Production and extraction optimization of xylanase andβ-mannanase by Penicillium chrysogen-um QML-2 and primary application in saccharification of corn cob[J]. Biochemical Engineering Journal, 2015, 97: 101-110.
[14] DHILLON G S, OBEROI H S, KAUR S, et al. Value-addition of agricultural wastes for augmented cellulase and xylanase production through solid-state tray fermentation employing mixed-culture of fungi[J]. Industrial Crops and Products, 2011, 34(1): 1 160-1 167.
[15] FIGUEROAESPINOZA M C, POULSEN C, BORCH S J, et al. Enzymatic solubilization of arabinoxylans from isolated rye pentosans and rye flour by different endo-xylanases and other hydrolyzing enzymes: Effect of a fungal caccase on the flour extracts oxidative gelation[J]. Journal of Agricultural & Food Chemistry, 2002, 50(22): 6 473-6 484.
[16] ZHAO Hui-min, GUO Xiao-na, ZHU Ke-xue. Impact of solid state fermentation on nutritional, physical and flavor properties of wheat bran[J]. Food Chemistry, 2017, 217: 28-36.
[17] 祝义伟, 周令国, 叶宸志, 等. 香菇柄中可溶性糖的测定[J]. 农产品加工, 2015(1): 43-45.
[18] QIN Meng-zhen, SHEN Yi-xin. Effect of application of a bacteria inoculant and wheat bran on fermentation quality of peanut vine ensiled alone or with corn stover[J]. Journal of Integrative Agriculture, 2013, 12(3): 556-560.
[19] WU Chao, LIU Ruo-shi, HUANG Wei-ning, et al. Effect of sourdough fermentation on the quality of Chinese Northern-style steamed breads[J]. Journal of Cereal Science, 2012, 56(2): 127-133.
[20] ANDREASEN M F, KROON P A, WILLIAMSON G, et al. Esterase activity able to hydrolyze dietary antioxidant hydroxycinnamates is distributed along the intestine of mammals[J]. J. Agric. Food Chem, 2001, 49: 5 679-5 684.
[21] WANG Yu-guo, WANG Xiao-nan, TANG Ren-tao, et al. A novel thermostable cellulase from Fervidobacterium nodosum[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 66(3/4): 294-301.
[22] KUGE T, WATANABE A, HASEGAWA S, et al. Functional analysis of arabinofuranosidases and a xylanase of Corynebacterium alkanolyticum for arabinoxylan utilization in Corynebacterium glutamicum[J]. Appl Microbiol Biotechnol, 2017, 101(12): 5 019-5 032.
[23] XUE Dong-sheng, LIANG Long-yuan, ZHENG Gang, et al. Expression of Piromyces rhizinflata cellulase in marine Aspergillus niger to enhance halostable cellulase activity by adjusting enzyme-composition[J]. Biochemical Engineering Journal, 2017, 117: 156-161.
[24] LYND L R, WEIMER P J, VAN ZYL W H, et al. Microbial cellulose utilization: Fundamentals and biotechnology[J]. Microbiology and Molecular Biology Reviews, 2002, 66(3): 506-577.
[26] 赵浩源, 张迎亚, 蒋侃侃, 等. 黑曲霉固态发酵产阿魏酸酯酶及酶解麸皮制备阿魏酸[J]. 林业工程学报, 2016, 32(5): 52-57.
[27] BOSKOV HANSEN H, ANDREASEN M, NIELSEN M, et al. Changes in dietary fibre, phenolic acids and activity of endogenous enzymes during rye bread-making[J]. European Food Research and Technology, 2014, 214(1): 33-42.
[28] DORNEZ E, VERJANS P, ARNAUT F, et al. Use of psychrophilic xylanases provides insight into the xylanase functionality in bread making[J]. J Agric Food Chem, 2011, 59(17): 9 553-9 562.
[29] VERJANS P, DORNEZ E, DELCOUR J A, et al. Selectivity for water-unextractable arabinoxylan and inhibition sensitivity govern the strong bread improving potential of an acidophilic GH11 Aureobasidium pullulans xylanase[J]. Food Chemistry, 2010, 123(2): 331-337.
[30] KATINA K, SALMENKALLIO-MARTTILA M, PARTAN-EN R, et al. Effects of sourdough and enzymes on staling of high-fibre wheat bread[J]. LWT-Food Science and Techno-logy, 2006, 39(5): 479-491.
[31] MESSIA M C, REALE A, MAIURO L, et al. Effects of pre-fermented wheat bran on dough and bread characteristics[J]. Journal of Cereal Science, 2016, 69: 138-144.
[32] DAMEN B, POLLET A, DORNEZ E, et al. Xylanase-mediated in situ production of arabinoxylan oligosaccharides with prebiotic potential in whole meal breads and breads enriched with arabinoxylan rich materials[J]. Food Chemistry, 2012, 131(1): 111-118.
