破碎方式对白鲢鱼糜凝胶结构的影响
2018-05-31蕾WANGLei范大明黄建联赵建新闫博文周文果张文海
王 蕾WANG Lei 范大明,4 -,4 黄建联 - 赵建新,4 -,4 闫博文 - 周文果 - 张文海 - 张 灏,4 ,4
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学国家功能食品工程技术研究中心,江苏 无锡 214122;3. 江南大学食品学院,江苏 无锡 214122;4. 江苏省食品安全与质量协同创新中心,江苏 无锡 214122;5. 福建安井食品股份有限公司,福建 厦门 361022)
鱼糜制品因营养健康、食用方便快捷等优点很受现代大众的欢迎,也是目前发展比较快的水产食品[1]。影响鱼糜制品品质的主要因素有内在因素和外在因素。内在因素主要是鱼种,海水鱼的凝胶品质一般优于淡水鱼,但淡水鱼鱼糜的凝胶特性除因品种的不同存在显著的差异[2],还受到诸多外在因素如加热条件、机械力作用[3]和外源添加物[4]等的影响。目前有关加热条件和外源添加物对鱼糜品质影响的相关研究都趋于成熟,但机械力作用对鱼糜凝胶特性的影响研究尚未见报道。在加工鱼糜制品时,机械外力主要体现在鱼糜制品加工过程中的斩拌或擂溃工序,尤其在工业化生产鱼糜制品过程中较常使用斩拌工艺。斩拌主要是以刀头的高速剪切力作用为主[5],而擂溃是借助杵头对鱼肉蛋白进行挤压、碾磨和捶打[6]。但是斩拌的刀头转速过快会使得局部过热,使鱼肉蛋白变性,影响鱼糜制品的品质;擂溃作用时间过长,工业化生产效率低。目前在鱼糜制品的加工中还没有关于适度加工破碎方式的相关研究,搅拌破碎强度低于斩拌,作用方式是通过挤压以及非牛顿流体湍流,作用时间比擂溃短。为保留鱼肉糜原有的营养和口感的同时提高其凝胶强度,本试验拟研究不同破碎方式和强度对白鲢鱼糜的质构和蛋白结构的影响,旨在为掌握和提高鱼糜制品加工工艺提供理论依据。
1 材料与方法
1.1 原料
白鲢鱼:购于无锡华润万家;
聚乙烯肠衣:福建安井食品有限公司;
食盐:市售。
1.2 试剂
氯化钾、三羟甲基氨基甲烷(Tris)、顺丁烯二酸(Mal)、尿素、碳酸钠、氢氧化钠、磷酸二氢钠、乙二胺四乙酸、十二烷基磺酸钠、磷酸氢二钠等:分析纯,国药集团化学试剂有限公司;
二硫代硝基苯甲酸(DTNB)、2-硝基-5-硫代磺基苯甲酸酯(NTSB):分析纯,美国Sigma公司。
1.3 主要仪器设备
斩拌机:Tuny, ZB20型,福建安井食品股份有限公司;
厨师机:KMM040型,邑隆贸易(上海)有限公司;
莫菲绞肉机:MO-385型,佛山桃花岛电器有限公司;
双槽恒温水浴锅:MP-15 型,南京先欧仪器制造公司;
手摇式灌肠机:SZ200型,南京威利朗食品机械有限公司;
手动式U型封口机:SU504型,河北衡水鸿昊企业有限责任公司;
物性分析仪:TA-XTplus型,英国SMS 公司;
紫外-可见光分光光度计:UV-1800型,日本岛津公司;
高速落地离心机:Sorvall LYNX6000型,德国Thermo公司。
1.4 试验方法
1.4.1 鱼糜凝胶的制备 将新鲜的白鲢鱼的头、鳞、皮以及内脏去除后进行手工采肉,用绞肉机剔除鱼骨。将采集好的鱼肉用按肉水比1∶5 (g/mL)的比例加4 ℃以下的自来水漂洗,漂洗5 min,静置3 min,重复漂洗2次,再用含质量体积分数为0.3% NaCl的4 ℃以下的自来水漂洗第3次[7]。用脱水机脱水至水分质量分数为(80.0±0.5)% ,完成新鲜鱼糜的制备,在4 ℃条件下备用。分别称取500 g制备好的新鲜鱼糜,置于斩拌机和厨师机中,① 斩拌组:放入斩拌机中的鱼糜在1 500 r/min转速下先空斩2 min,分别加入1%,2%,3%的食盐,再在3 000 r/min转速下盐斩3 min,最后在1 000 r/min 转速下混合斩拌2 min;② 搅拌组:放入厨师机中的鱼糜用K字搅拌桨在160 r/min搅拌速度下空搅2 min,再分别加入1%,2%,3%的食盐,搅拌3 min,最后混合搅拌2 min。用灌肠机将鱼糜浆灌至直径为2.5 cm的塑料肠衣中,用封口机将鱼肠两端进行封口。将鱼肠放置已经调好温度的水浴锅中进行加热,先在4 ℃条件下加热30 min后置于90 ℃加热20 min[8]。将熟化后的鱼肠立即放置冰水中冷却,待冷却至室温后,4 ℃冰箱中放置12 h待测。
1.4.2 凝胶强度的测定 将熟化好的鱼肠在4 ℃平衡12 h后从冰箱取出,切成高25 mm厚的圆柱体,待其温度上升至室温后,放置在TA-XT plus型物性分析仪的测试台上,选用P/5s球形探头(直径为5 mm的球形探头)进行测定。以1.00 mm/s 速度进行穿刺,最大穿刺距离为15 mm,感应力为5 g[9]。每组试验重复4次,鱼肠的凝胶强度用破断强度(g)与凹陷深度(cm)的乘积表示[10]。
1.4.3 全质构的测定 将切成25 mm后的鱼肠凝胶放在TA-XT Plus型物性分析仪载物台上,通过TPA程序对样品进行二次压缩,设置参数:测试前速率2 mm/s,测试速率1 mm/s,测试后速率1 mm/s,压缩程度20%,停留间隔时间5 s[11]。测试结果显示各属性值,每次试验做6次平行,结果取均值。
1.4.4 持水力的测定 将鱼肠样品切成2 mm左右薄片,称取5 g,用滤纸将其包裹4层后放入50 mL的离心管中,于4 ℃、5 000 r/min离心20 min,称取离心后的鱼肠样品质量。每次试验做5次平行,取均值[12]。按式(1)计算持水力。
(1)
式中:
WHC——持水力,%;
M1——离心前的重量,g;
M2——离心后的重量,g。
1.4.5 白度的测定 参考文献[13],采用标准测色仪测定鱼糜凝胶的L*(Lightness)、a*(Redness)、b*(Yellowness)值。按式(2)计算白度。
(2)
式中:
WH——样品的白度;
L*——样品的亮度,其值从0 到100 变化,0 表示黑色,100 表示白色;
a*——从红到绿的值,正值代表红色程度,负值代表绿色程度;
b*——从黄到蓝的值,正值表示黄色程度,负值表示蓝色程度。
1.4.6 盐溶蛋白含量的测定 取10 g生鱼糜样品研碎后,加入100 mL低盐缓冲液(0.05 mol/L的KCl,0.02 mol/L的Tris-Mal),用落地离心机将肉糜在27 200×g、4 ℃条件下离心30 min。取沉淀加入100 mL高盐缓冲液(0.6 mol/L的KCl,0.02 mol/L的Tris-Mal),充分匀浆后置于4 ℃静置1 h,静置完毕用高速落地离心机在27 200×g、4 ℃条件下离心30 min,取上清后用Lowery法测定蛋白质含量[14]。
1.4.7 肌动球蛋白的制备 参照文献[15]。
1.4.8 巯基含量的测定 取1 mL肌原纤维蛋白溶液于20 mL 试管中,加入9 mL 0.2 mol/L的Tris-Mal缓冲液(pH 7.0),其中含有质量体积分数为2%的SDS和10 mmol/L 的EDTA,将其充分混匀后从中取出4 mL,加入0.04 mL的质量体积分数为0.1%的DTNB溶液(溶剂为0.2 mol/L 的Tris-Mal缓冲液,pH 8.0)。在40 ℃水浴加热25 min,冷却到室温后测定其在412 nm处的吸光值,空白组以0.6 mol/L 的KCl溶液代替。按式(3)计算巯基含量。
(3)
式中:
SH——巯基含量,μmol/g;
A——吸光值;
n——稀释倍数;
M——TNB2-的摩尔消光系数,13 600 L/(mol·cm);
c——蛋白为肌原纤维蛋白浓度,g/mL[16]。
1.4.9 二硫键含量的测定 参考文献[17]。
1.4.10 化学作用力的测定 取样品各2 g(4个平行),分别与10 mL的0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L 尿素(SC)、0.6 mol/L NaCl+8 mol/L 尿素(SD)混合并均质,4 ℃静止1 h,10 000×g离心15 min。用Lowry法测定上清液中蛋白质的含量。蛋白分子间离子键的贡献以溶解于SB溶液与SA溶液中蛋白质含量之差来表示;氢键的贡献以溶解于SC溶液与SB溶液中蛋白质含量之差来表示;疏水性相互作用的贡献以溶解于SD溶液与SC溶液中蛋白质含量之差来表示[17]。
1.4.11 浊度的测定 先将肌动球蛋白溶液的浓度调整到1 mg/mL,进行处理后立即置于40 ℃控温分光光度计中,设置分光光度计每隔1 min测定一次,测定时间为30 min,测定波长为350 nm,每次试验至少重复3次[18]。
1.4.12 扫描电镜 将鱼肠样品中心部分切成2~3 mm厚的小块,经5%戊二醛(0.1 mol/L磷酸缓冲液,pH 7.2)前固定,0.1 mol/L磷酸缓冲液漂洗;再经1%锇酸(0.1 mol/L磷酸缓冲液,pH 7.2)后固定,0.1 mol/L磷酸缓冲液漂洗;然后依次用体积分数为50%,70%,80%,90%的乙醇进行梯度脱水,各梯度脱水时间均为15 min,最后再经无水乙醇脱水30 min。临界点干燥后将样品粘贴在样品台上,离子溅射仪镀膜后置于扫描电子显微镜下观察[19]。
1.4.13 数据分析 试验数据和图形处理采用Excel 2013软件,对试验测定数据的差异显著性分析采用SPSS 16.0软件中Duncan法评价。
2 结果与讨论
2.1 破碎方式对白鲢鱼糜凝胶强度的影响
凝胶强度是评价鱼糜凝胶品质的重要指标之一[20]。从图1可以看出:斩拌和搅拌这2种不同的破碎方式和盐添加量对鱼糜的凝胶强度都有显著影响。随着盐含量的增加,2种破碎方式处理的鱼糜的凝胶强度显著增加(P<0.05),其中添加3%盐的搅拌样品的凝胶强度最高;在盐添加量2%和3%的条件下,搅拌破碎方式对鱼糜制品的质构改善效果显著,凝胶强度分别提高了70.2%,66.7%。

*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图1 破碎方式对白鲢鱼糜凝胶强度的影响
Figure 1 Effects of different broken methods on gel strength of silver carp surimi
盐可以溶解鱼糜中的盐溶蛋白以增加水合作用,最终改善鱼糜的品质[21]。在相同盐添加量下,搅拌样品的凝胶强度显著高于斩拌样品的(P<0.05)。添加2%盐的搅拌样品比添加3%盐的斩拌样品的凝胶强度高,意味着搅拌破碎可以在一定程度上降低盐添加量,同时得到比斩拌品质更好的鱼糜。
2.2 破碎方式对白鲢鱼糜全质构的影响
由表1可看出,2种破碎方式对鱼糜的全质构硬度、黏附性、弹性、咀嚼性、胶黏性影响性较为显著,内聚性整体影响不大。盐添加量对斩拌样品的硬度、弹性、胶黏性和内聚性影响不大,但是对搅拌样品的硬度、黏附性、弹性、咀嚼性和胶黏性影响较为显著(P<0.05)。在同一盐添加量条件下,搅拌样品比斩拌样品的硬度、咀嚼性、胶黏性都要好,表明搅拌破碎能够提高鱼糜的凝胶质构。

表1 破碎方式对白鲢鱼糜全质构的影响†Table 1 Effects ofdifferent broken methods on the texture of silver carp surimi
† 1、2、3、4、5、6分别表示添加1%盐的斩拌样品,添加2%盐的斩拌样品,添加3%盐的斩拌样品,添加1%盐的搅拌样品,添加2%盐的搅拌样品,添加3%盐的搅拌样品;同列不同字母代表组内差异显著(P<0.05)。
2.3 破碎方式对白鲢鱼糜白度和持水力的影响
由图2可以发现,不同的破碎方式和盐添加量对鱼糜凝胶的白度值没有显著影响。
持水力是鱼糜制品中的重要特征和物理参数,可直观地反映鱼糜蛋白保留水分的能力,保留的水分越多,鱼糜凝胶的质构越好[22]。由图3可知:在低水平盐的添加量下可以显著提高鱼糜凝胶的持水力,搅拌样品的持水力在相同的盐添加量下显著高于斩拌样品的(P<0.05),其中在添加1%的盐时差异极显著(P<0.01)。搅拌破碎可以更好地保留鱼糜中的水分,提高鱼糜凝胶的品质,与图1和表2的结果一致。

图2 破碎方式对白鲢鱼糜白度的影响Figure 2 Effects of different broken methods on whiteness of silver carp surimi

*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图3 破碎方式对白鲢鱼糜的持水力的影响
Figure 3 Effects of different broken methods on water-holding capacity of silver carp surimi
2.4 破碎方式对白鲢鱼糜盐溶蛋白含量的影响
盐溶蛋白含量是反映鱼糜制品蛋白质结构变化的有效指标之一[23]。鱼糜凝胶的形成实质上是盐溶蛋白发生交联逐渐转化为不溶蛋白的过程,是热诱导凝胶的重要组成部分[24]。由于盐可以引起肌原纤维蛋白的溶胀、细丝的解聚和肌动蛋白复合物的解离[25],所以随着盐添加量的增加,盐溶蛋白的含量也会有相应的提高。由图4可知,在高水平的盐添加量下,加工方式对鱼糜凝胶的盐溶蛋白含量有着显著的影响(P<0.05),且斩拌样品的盐溶蛋白含量显著高于搅拌样品的。

*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图4 破碎方式对白鲢鱼糜盐溶蛋白的影响
Figure 4 Effects of different broken methods on salt-soluble protein of silver carp surimi
一般认为,有较高含量的盐溶蛋白会使鱼糜凝胶的品质提高。但是有研究[26]表明,高含量的盐溶蛋白并不是总是与肌原纤维蛋白的良好质地有关。在有更多肌球蛋白单体存在的条件下,在低盐溶蛋白含量下也可以获得良好的凝胶网络结构[27]。搅拌破碎方式主要以K字搅拌桨对鱼肉糜进行挤压、研磨,都没有斩拌刀轴的转速和强度高,可能在一定程度上保留了部分结缔组织和肌球蛋白单体,而这种肌球蛋白有着更好的持水性,从而有更好的凝胶质构。
2.5 破碎方式对白鲢鱼糜活性巯基含量的影响
巯基是肌原纤维蛋白中大量功能基团的重要组成部分,具有很强的反应活性[28]。活性巯基含量的变化在一定程度上反映了肌球蛋白的变性程度[29]。活性巯基含量的增加表明蛋白结构越伸展预示着二硫键的形成[30]。
由图5可以看出,斩拌与搅拌样品的活性巯基含量随着盐添加量的增加分别从4.41 μmol/g增加到4.93 μmol/g,4.92 μmol/g 增加到5.51 μmol/g。在添加相同的盐含量的条件下,搅拌处理的样品活性巯基含量显著高于斩拌处理的样品(P<0.05),表明搅拌破碎方式也会引起鱼糜肌动球蛋白分子结构的变化。活性巯基含量的增加表明鱼糜凝胶蛋白质分子内部有更多的巯基暴露,氧化后形成更多的二硫键,促使蛋白质交联形成三维的凝胶网络结构从而提高鱼糜凝胶的品质。
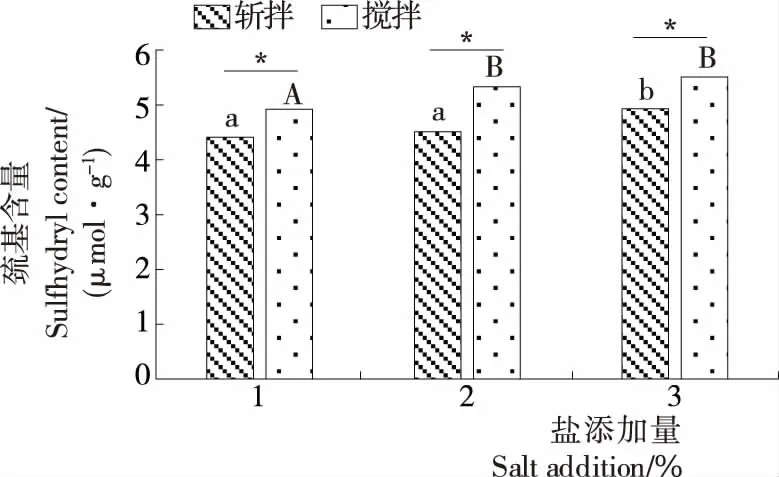
*表示差异显著(P<0.05);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图5 破碎方式对白鲢鱼糜肌动球蛋白活性巯基含量的影响
Figure 5 Effects of different broken methods on active sulfhydryl group of silver carp surimi actomyosin
2.6 破碎方式对白鲢鱼糜凝胶过程中化学作用力的影响
肌原纤维蛋白凝胶网络的形成是一个复杂的物理化学过程,蛋白质分子通过蛋白间的各种化学作用力相互结合,其分子结构和功能特性发生变化进而形成结构稳定的凝胶体。蛋白质产生相互结合的作用力主要有以下4种:氢键、离子键、疏水作用、二硫键[31]。
由图6、7可知,随着盐含量的增加,2种破碎方式处理样品的氢键、二硫键和疏水相互作用显著增加(P<0.05),但是离子键呈相反的趋势。有研究表明,离子键和氢键不是维持鱼糜凝胶稳定构象的主要化学作用力[4],疏水相互作用在鱼糜蛋白加热凝胶过程中发挥了重要作用,二硫键在鱼糜凝胶形成中也发挥了至关重要的作用[32-33],因此疏水相互作用和二硫键是维持鱼糜凝胶稳定构象的主要化学作用力。
由图8、9可知,在同一盐添加量下,搅拌样品比斩拌样品有更多包埋在内部的巯基暴露于表面,活性巯基增加,氧化成更多的二硫键,分布在蛋白质分子内部的疏水性氨基酸残基逐渐暴露,提高疏水相互作用力,增加分子间的聚集。
2.7 破碎方式对白鲢鱼糜浊度的影响
浊度反映了溶液中不溶悬浮粒子的大小和数量,在蛋白的研究中,常作为蛋白聚集的重要指标,蛋白聚集后,颗粒直径变大,浊度升高[18]。由图10可知,随着盐含量的增加,2种破碎方式处理样品的浊度都有显著的增加(P<0.05)。特别是盐添加量在3%时,搅拌样品的浊度极显著高于斩拌样品的(P<0.01)。表明搅拌破碎会使得更多活性巯基暴露从而氧化形成二硫键,同时使得更多的蛋白解旋伸展,疏水相互作用增强。这些化学作用力使肌动球蛋白分子之间相互聚集,导致浊度增加。
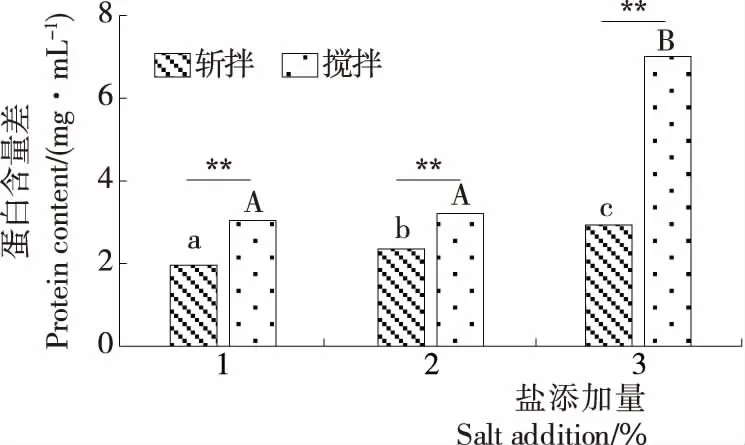
*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图6 破碎方式对白鲢鱼糜肌动球蛋白氢键含量的影响
Figure 6 Effects of different broken methods on hydrogen bonds of silver carp surimi actomyosin
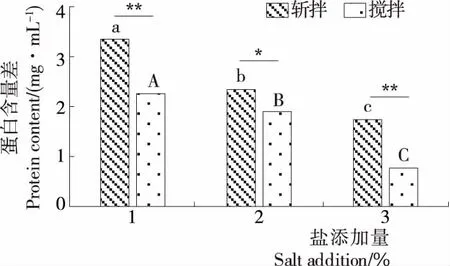
*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图7 破碎方式对白鲢鱼糜肌动球蛋白离子键含量的影响
Figure 7 Effects of different broken methods on ion bonds of silver carp surimi actomyosin

*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图8 破碎方式对白鲢鱼糜的肌动球蛋白二硫键含量的影响
Figure 8 Effects of different broken methods on disulfide bonds of silver carp surimi actomyosin

*表示差异显著(P<0.05);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图9 破碎方式对白鲢鱼糜肌动球蛋白疏水相互作用的影响
Figure 9 Effects of different broken methods on hydrophobic interactions of silver carp surimi actomyosin

*表示差异显著(P<0.05),**表示差异极显著(P<0.01);小写字母表示斩拌方式的组间差异,大写字母表示搅拌方式的组间差异
图10 破碎方式对白鲢鱼糜肌动球蛋白浊度的影响
Figure 10 Effects of different broken methods on turbidity of silver carp surimi actomyosin
2.8 破碎方式对白鲢鱼微观结构的影响
不同盐添加量的斩拌和搅拌熟制样品的微观网络结构见图11。随着盐含量的增加,斩拌样品的网络结构不断生成,但是盐添加量为3%的样品有着较大并且致密交联的孔径。搅拌样品的微观结构在盐添加量为1%,2%时表面光滑平整,无明显差异;3%时明显出现致密的三维网络结构,并且保留部分光滑的鱼肉组织。以上结果表明:盐的添加量和破碎方式对鱼糜的微观结构都有一定程度的影响,可能是由蛋白质分子间的相互缠绕而形成的聚集体形态造成。但是在高水平的盐添加量下,搅拌样品比斩拌样品有着更均匀致密的组织结构。

图11 破碎方式处理的鱼糜扫描电镜图(4 000×)
Figure 11 Scanning electron micrographs of silver carp gels by different broken methods
3 结论
搅拌破碎方式可对鱼糜进行适度加工,既能提高鱼糜的凝胶特性,又能保留其原有的营养和口感。不同于斩拌的高速刀盘剪切,搅拌以对鱼肉纤维的挤压、碾磨,能够使得包埋在内部的巯基暴露于表面,提高活性巯基的含量,氧化成更多的二硫键,提高疏水相互作用,导致浊度增加,使得更多的蛋白分子交联,三维凝胶网络结构更致密,从而增强了鱼糜凝胶的品质。对于搅拌和斩拌2种方式的优点,可采用先斩拌后搅拌的联合破碎方法进行更深入的研究,找出最佳的工艺条件,得到品质更好的鱼糜制品。
[1] 李贤. 破碎方式对鱼糜凝胶特性的影响[D]. 武汉: 华中农业大学, 2014: 1-2.
[2] 吴汉民, 王海洪, 韩素珍, 等. 几种淡水鱼鱼糜特性的研究[J]. 食品科学学院, 1999, 20(9): 15-19.
[3] 陈申如, 刘阳, 李燕杰. 擂溃条件对鱼糜制品弹性的影响[J]. 大连工业大学学报, 2004, 23(3): 194-197.
[4] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.
[5] 张磊. 淡水鱼方便食品斩拌设备的设计研究[D]. 南京: 河海大学, 2002: 2-5.
[6] 郑晓. 擂溃机杵头的运动及力学分析[J]. 武汉食品工业学院学报, 1996(4): 29-34.
[7] KONG Bao-hua, GUO Yuan-yuan, XIA Xiu-fang, et al. Cryoprotectants reduce protein oxidation and structure deterioration induced by freeze-thaw cycles in common carp (Cyprinus carpio) surimi[J]. Food Biophysics, 2013, 8(2): 104-111.
[8] ALVAREZ C, COUSO I, TEJADA M. Thermal gel degradation (modori) in sardine surimi gels[J]. Journal of Food Science, 1999, 64(4): 633-637.
[9] BENJAKUL S, VISESSANGUAN W. Transglutaminase-mediated setting in bigeye snapper Surimi[J]. Food Research International, 2003, 36(3): 253-266.
[10] 陈海华, 薛长湖. 钙盐溶液漂洗对竹荚鱼鱼糜凝胶特性的影响[J]. 食品与机械, 2009, 25(5): 5-9.
[11] 崔雁娜. 养殖大黄鱼蛋白质冷冻变性及抑制的研究[D]. 杭州: 浙江工商大学, 2009: 13-14.
[12] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70.
[13] BENJAKUL S, VISESSANGUAN W, SRIVILAI C. Porcine plasma protein as proteinase inhibitor in bigeye snapper (Priacanthus tayenus) muscle and surimi[J]. Journal of the Science of Food & Agriculture, 2001, 81(10): 1 039-1 046.
[14] KANG Zhuang-li, ZOU Yu-feng, XU Xing-lian, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (kung-wan): a physico-chemical and textural study[J]. Meat Science, 2014, 96(1): 147-152.
[15] LIAN P Z, LEE C M, HUFNAGEL L. Physicochemical properties of frozen red hake (Urophycis chuss) mince as affected by cryoprotective ingredients[J]. Journal of Food Science, 2000, 65(7): 1 117-1 123.
[16] CHEN Ching-san, HWANG D C, JIANG S T. Effect of storage temperatures on the formation of disulfides and denaturation of milkfish myosin (Chanos chanos)[J]. Journal of Food Science, 1988, 53(5): 1 333-1 335.
[18] 付湘晋, 许时婴, 王璋, 等. 酸碱处理对鲢鱼肌原纤维蛋白热变性、聚集、胶凝性质的影响[J]. 食品科学, 2008, 29(6): 100-103.
[19] 苏赵, 胡强, 李树红, 等. 海藻糖对草鱼鱼糜冻藏品质的影响[J]. 食品与机械, 2017, 33(7): 139-144.
[20] SAKAMOTO H, KUMAZAWA Y, TOIGUCHI S, et al. Gel strength enhancement by addition of microbial transglutaminase during onshore surimi manufacture[J]. Journal of Food Science, 1995, 60(2): 300-304.
[21] DESMOND E. Reducing salt: A challenge for the meat industry[J]. Meat Science, 2006, 74(1): 188-196.
[22] MAJUMDAR R K, SAHA A, DHAR B, et al. Effect of garlic extract on physical, oxidative and microbial changes during refrigerated storage of restructured product from Thai pangas (pangasianodon hypophthalmus) surimi[J]. Journal of Food Science & Technology, 2015, 52(12): 1-10.
[23] BADII F, HOWELL N K. A comparison of biochemical changes in cod (Gadus morhua) and haddock (Melanogrammus aeglefinus) fillets during frozen storage[J]. Journal of the Science of Food & Agriculture, 2002, 82(1): 87-97.
[24] 刘海梅. 鲢鱼糜凝胶及形成机理的研究[D]. 武汉: 华中农业大学, 2007: 1-5.
[25] DAVENPORT M P. Structure/function relationship of channel catfish (Ictalurus punctatus) muscle proteins subjected to ph-shift processing[J/OL]. [2017-11-02]. https://www.researchgate.net/publication/266039755_STRUCTUREFUNCTION_RELATIONSHIP_OF_CHANNEL_CATFISH_Ictalurus_punctatus_MUSCLE_PROTEINS_SUBJECTED_TO_pH-SHIFT_PROCESSING.
[26] POOWAKANJANA S, PARK J W. Biochemical characterisa-tion of Alaska pollock, Pacific whiting, and threadfin bream surimi as affected by comminution conditions[J]. Food Chemistry, 2013, 138(1): 200-207.
[27] KAMINER B, BELL A L. Myosin filamentogenesis: Effects of pH and ionic concentration[J]. Journal of Molecular Biology, 1966, 20(2): 391-401.
[28] 潘锦锋, 沈慧星, 尤娟, 等. 草鱼肌原纤维蛋白加热过程中理化特性的变化[J]. 中国农业大学学报, 2009, 14(6): 17-22.
[29] 周爱梅, 龚杰, 邢彩云, 等. 罗非鱼与鳙鱼鱼糜蛋白在冻藏中的生化及凝胶特性变化[J]. 华南农业大学学报, 2005, 26(3): 103-107.
[30] KO W C, YU Chi-cheng, HSU K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. LWT-Food Science and Technology, 2007, 40(8): 1 316-1 320.
[31] WAN J, KIMURA I, SATAKE M, et al. Effect of calcium ion concentration on the gelling properties and transglutaminase activity of walleye pollack surimi paste[J]. Fisheries Science, 1994, 60(1): 107-113.
[32] GILL T A, CONWAY J T. Thermal aggregation of cod (Gadus morhua) muscle proteins using l-ethyl-3-(3-dimethylaminopropyl) carbodiimide as a zero length cross-linker[J]. Journal of the Agricultural Chemical Society of Japan, 1989, 53(10): 2 553-2 562.
[33] WONNOP Visessanguan, MASAHIRO Ogawa, SHURYO Nakai A, et al. Physicochemical Changes and Mechanism of Heat-Induced Gelation of Arrowtooth Flounder Myosin[J]. Journal of Agricultural & Food Chemistry, 2000, 48(4): 1 016-1 023.
