大鼠骨髓间充质干细胞的分离、鉴定与冻存及对细胞活性的影响
2018-05-31谢晶晶张平超
谢晶晶,李 博,姚 兵,宋 烜,张平超,陆 骅
骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)是一种多分化潜能细胞,在骨量维持和骨修复中起了极其重要的作用。然而,随着年龄增加,骨髓MSCs向成骨、成软骨细胞分化的能力减弱,是造成骨质疏松和骨折延缓愈合的直接原因[1]近年来,我国骨质疏松症发病率上升,由此发生的骨折、骨折并发症及重要关节功能丧失的患者增多;自体骨髓MSCs移植治疗骨折不愈合的效果已得到肯定[2-3],其效果与MSCs数量和活性直接相关;但应用于骨质疏松或骨质疏松骨折治疗的研究尚不多见。本研究以SD大鼠为载体,先采集大鼠MSCs冻存,再制备骨质疏松模型,将采集的MSCs回输至大鼠体内发挥抗骨质疏松作用,主要观察MSCs的分离、鉴定及冻存时间对细胞活性的影响,从而为该类疾病的治疗提供新方向。
1 材料与方法
1.1实验动物 SPF级3周龄雄性SD大鼠6只,体重(50±10)g,由中科院上海动物房提供,许可证号:SCXK(沪)2013-0005。
1.2实验仪器与试剂 胎牛血清、双抗、淋巴细胞分离液、胰蛋白酶、RPMI 1640培养液均购自美国Gibco公司;CD29,CD90,CD11B,CD45抗体均购自美国Invitrogen公司;终末期糖基化牛血清白蛋白、牛血清白蛋白均购自美国CALBIOCAM公司;甲基噻唑基四唑(MTT)、二甲基亚砜(DMSO)均购自美国SIGMA公司;大鼠骨髓MSCs成骨诱导分化培养基和成脂诱导分化培养基购自赛业生物。
1.3实验方法
1.3.1大鼠骨髓MSCs的分离培养:将3周龄SD雄性大鼠6只全部断颈处死,取股骨和胫骨,并剪去两端,露出骨髓腔,使用含体积分数为10%的胎牛血清+双抗的培养液,冲洗骨髓腔,反复2次,打散细胞悬液后,使用70 μm细胞筛过滤,去除细胞团块。用相对密度1.077的淋巴细胞分离液做梯度离心(2000 r/min,离心30 min)。收集单核细胞界面层,再次离心(1000 r/min,离心10 min),弃上清后,使用原代细胞培养液打散重悬细胞。细胞悬液接种于100 mm细胞培养皿中,在37℃,体积分数为5%的CO2,饱和湿度条件下培养48 h,然后去除未贴壁细胞,每48 h换液1次。
1.3.2流式细胞法鉴定MSCs表面标志物:原代细胞生长至培养皿95%左右体积时,开始传代培养;以移液器吸取第2代细胞若干,用胰蛋白酶消化、含体积分数为5%胎牛血清的PBS重悬,并调整细胞浓度至1×106/ml;鉴定MSCs表面标记物CD29和CD90及造血干细胞(HSCT)表面标记物CD11B和CD45的阳性表达情况,合格的MSCs应表达CD29和CD90,而不表达CD11B和CD45。主要步骤:每个流式管各取100 μl细胞混悬液,加入待测抗体;设立对照组,取100 μl细胞混悬液加入同型对照抗体;4℃避光孵育30 min,漂洗2次后移除去上清,控干后每管加入0.5 ml固定液,上机检测。先检测同型对照管,调整电压至阴性区范围,再测实待测抗体管[4]。
1.3.3MSCs的冻存:配置MSCs冻存体系,体系构成为10%DMSO+30%胎牛血清+60%DMEM-LG培养基。将培养好的第2代细胞吸除培养液,转移至冻存体系;根据考察时间点,每只大鼠的MSCs均先分装为4管,管1不冻存,直接培养至对数生长期,测定增殖活力和多向分化能力;管2、3、4先置于4℃环境保存2 h,再置于-20℃环境保持2 h,再转移至-70℃超低温环境冻存。
1.3.4MSCs的复苏:管2、3、4分别于冻存1周、1个月、6个月复苏细胞。复苏步骤:将冻存管37℃水浴,至溶解90%左右时移入37℃预热的DMEM培养基,1000 r/min离心5 min,弃上清液,培养基重悬细胞,锥虫蓝染色计数活细胞数目,复苏率=(活细胞数目/总细胞数目)×100%。复苏后的细胞调整为1×108/L,在37℃体积分数为5% CO2,饱和湿度条件下培养72 h,达到对数生长期时,测定其增殖活力和多向分化能力。
1.4MTT法测定MSCs增殖活力 分别于冻存前,冻存1周、1个月、6个月复苏细胞,收集生长至对数期的待测骨髓MSCs,以1×104/ml接种于96孔板,置于37℃体积分数为5% CO2温箱中培养,分别于处理1 d、2 d......7 d吸去上清液,PBS洗涤,弃上清液,每孔加入10 μl新鲜RPMI 1640培养液,再加入20 μl MTT溶液(5 g/L,即0.5%)继续培养4 h。弃上清液后,每孔加入150 μl DMSO,置摇床上低速连续振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度值,每组设定3个复孔,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.5诱导实验测定MSCs多向分化能力 收集生长至对数期的待测骨髓MSCs,以1×104/ml接种于96孔板中,以大鼠骨髓MSCs成骨诱导分化培养基培养(培养基由MSCs专用胎牛血清、谷氨酰胺、双抗、抗坏血酸、β-甘油磷酸钠及地塞米松按照一定的配比组成)。37℃,5%CO2培养7 d,隔天换液1次,7 d后吸除剩余培养基,茜素红染色,染色液含5 mg/L茜素红S+0.1M Tris,PH=1,共染色15 min,倒置荧光镜下观察被染红的钙结节数目。按照同样的方法,以大鼠骨髓MSCs成脂分化培养基培养细胞,培养7 d后油红O染色15 min,倒置荧光镜观察被染黄的脂滴形成数目。

2 结果
2.1大鼠骨髓MSCs培养与鉴定 分离自骨髓的细胞在培养1个月后出现细胞克隆,呈纤维细胞样生长。见图1。MSCs细胞表面CD29和CD90的阳性表达率分别为97.9%和97.4%,HSCT细胞表面CD11B和CD45的阳性表达率分别为9.8%和7.7%,同时细胞表面CD11B阴性表达率为90.2%,CD45阴性表达率为92.3%,说明上述纤维细胞样细胞基本为骨髓MSCs,且均一性好。见图2。
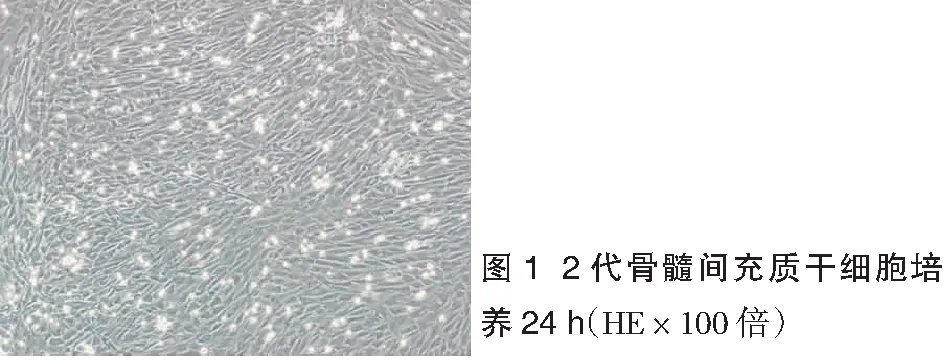
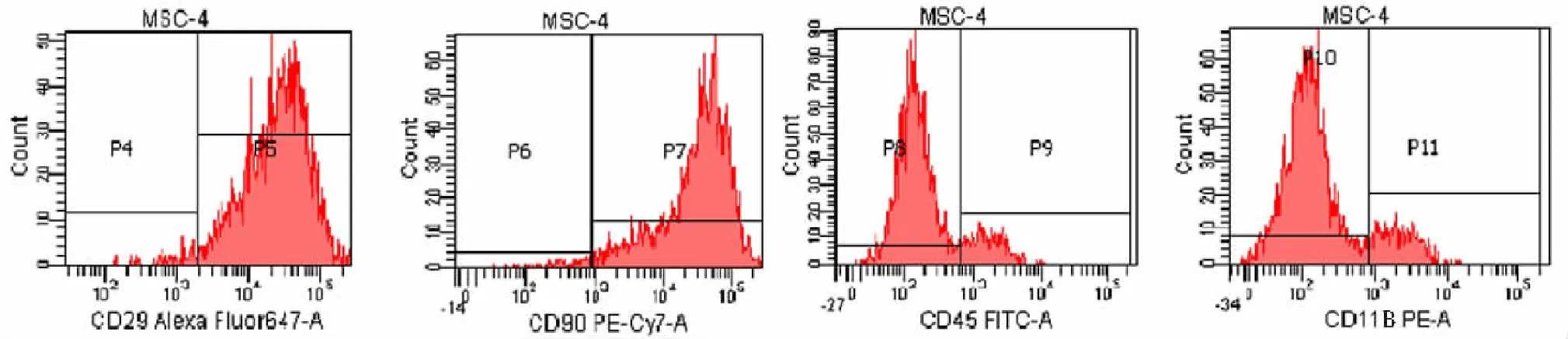
图2 流式细胞仪检测2代骨髓间充质干细胞表面标志物
2.2冻存不同时间对大鼠骨髓MSCs增殖活力的影响 冻存1周、1个月和6个月,大鼠骨髓MSCs复苏率分别为68.4%、66.3%、64.8%。随着冻存时间延长,细胞增殖速率稍有减慢,但差异无统计学意义(P>0.05),冻存6个月的细胞增殖活力也处于较稳定水平内。复苏细胞的增殖曲线见图3。

图3大鼠骨髓间充质干细胞冻存时间对增殖曲线的影响
2.3冻存不同时间对大鼠骨髓MSCs多向分化能力的影响 冻存前、冻存1周、1个月和6个月,大鼠骨髓MSCs成骨诱导后钙结节数目和油滴数目稍有降低,但差异无统计学意义(P>0.05)。见表1。成骨分化诱导培养基培养后采用茜素红染色,钙结节被染成棕色,钙结节数目越多,成骨分化能力越强;成脂分化诱导培养基培养后,油红O染色,液化脂肪被染成橙红色,呈油滴状,油滴越多,成脂分化能力越强。见图4。
3 讨论
目前国内大鼠骨髓MSCs的提取方法多采用密度梯度分离法联合贴壁培养手段[5-6]。骨髓所含的细胞种类极为丰富,密度梯度离心可去除骨髓中的红细胞、免疫细胞及脂肪细胞等,贴壁培养的目的在于进一步去除造血干细胞等非贴壁细胞。本研究用该方案提取大鼠MSCs,其优点在于操作简便,所得细胞活性和纯度相对较高,能够满足一般实验需求;获得的细胞MSCs表面CD29和CD90的阳性表达率分别为97.9%,97.4%;MSCs表面和CD11B和CD45的阳性表达率分别为9.8%和7.7%;说明所获得的MSCs纯度可达90%,且均一性较好。

表1 大鼠骨髓间充质干细胞冻存不同时间对多向分化能力的影响
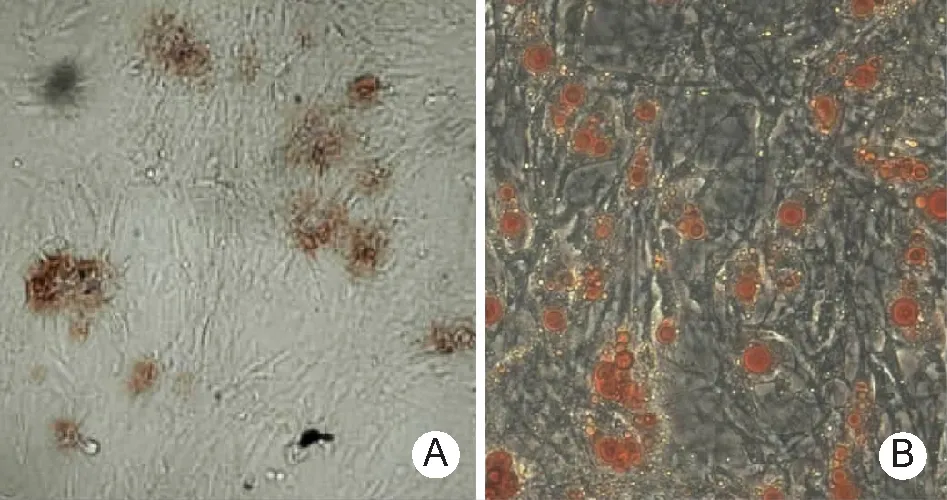
图4骨髓间充质干细胞多向分化诱导实验染色后典型图片(HE×200)
A.成骨分化诱导培养基培养后茜素红染色,着色者为钙结节;B.成脂分化诱导培养基培养后油红O染色,着色者为油滴
冻存和复苏骨髓MSCS非常关键,是保持其应用效果的重要条件之一。既往文献报道[7-8],与MSCs低温冻存质量密切相关的三要素是降温步骤、冻存液、冻存温度及复苏速率。降温速度主要影响细胞内基质结冰过程中的渗透压,如果直接过度到超低温环境容易引发细胞内溶质反应,进一步引发细胞器损坏和细胞膜渗漏[9-10],因此需在4℃环境中缓冲2~4 h,本研究采用梯度降温法,4℃和-20℃各缓冲2 h,再转移至-70℃。何洁等[11]指出液氮冻存效果较-70℃环境更好,但基于-70℃环境冻存条件更加方便,本研究直接以-70℃超低温冰箱进行存储。冻存液的配置参照李秀森的改良方案[12],以10%DMSO+30%胎牛血清+60%DMEM-LG培养基为存储体系。最终考察冻存1周、1个月和6个月的细胞活性,结果显示快速复苏后,大鼠骨髓MSCs 1周,1个月和6个月的复苏率分别为68.4%、66.3%、64.8%,与文献一致[13-14]。
本研究结果显示,MSCs增殖曲线基本符合“S”型规律[15-16],有较明显的平台期、对数生长期和生长后下降趋势。冻存前、冻存1周、冻存1个月和冻存6个月的增殖曲线较为接近,各个时间点的增殖速率差异无统计学意义。多向分化能力是MSCs的典型重要特征,是指在特定的诱导条件下,MSCs可分化为成骨细胞、软骨细胞、肌肉细胞或脂肪细胞,这也是MSCs可通过归巢效应治疗多种疾病的根本原因[17]。本研究结果显示,随着冻存时间延长,大鼠骨髓MSCs成骨和成脂肪能力与治疗前比较差异无统计学意义,证实在6个月的冻存期内,细胞活性得到了良好的保持。
综上所述,采用密度梯度分离法联合贴壁培养可成功提取大鼠骨髓MSCs;配置的冻存体系也可在-70℃超低温环境中较长时间保持MSCs活性,有利于其后续研究。
[]
[1] Ma L, Aijima R, Hoshino Y,etal. Transplantation of mesenchymal stem cells ameliorates secondary osteoporosis through interleukin-17-impaired functions of recipient bone marrow mesenchymal stem cells in MRL/lpr mice[J].Stem Cell Res Ther, 2015,6(1):104.
[2] Labibzadeh N, Emadedin M, Fazeli R,etal. Mesenchymal Stromal Cells Implantation in Combination with Platelet Lysate Product Is Safe for Reconstruction of Human Long Bone Nonunion[J].Cell J, 2016,18(3):302-309.
[3] Emadedin M, Labibzadeh N, Fazeli R,etal. Percutaneous Autologous Bone Marrow-Derived Mesenchymal Stromal Cell Implantation Is Safe for Reconstruction of Human Lower Limb Long Bone Atrophic Nonunion[J].Cell J, 2017,19(1):159-165.
[4] 孔根现,蒋知新,沙杭,等.兔骨髓间充质干细胞分离培养后的活力检测[J].中国组织工程研究,2013,17(1):62-67.
[5] 李霞.骨髓基质干细胞在骨科应用研究的现状[J].临床骨科杂志,2011,14(4):449-453.
[6] 崔洁,范英昌,薛亮.大鼠MSCs的体外分离、培养及鉴定的实验研究[J].天津中医药,2012,29(5):463-464.
[7] 付旭锋,刘平,陈冰冰,等.间充质干细胞冻存方法的研究进展[J].云南大学学报:自然科学版,2016,38(4):652-660.
[8] 袁雅红,王小莉,郭兴荣,等.脐带间充质干细胞支持脐血单个核细胞冻存复苏后的体外生长[J].湖北医药学院学报,2015,34(5):436-439,418.
[9] Chinnadurai R, Copland I B, Garcia M A,etal. Cryopreserved MSCs are susceptible to T-cell mediated apoptosis which is partly rescued by IFNγ licensing[J].Stem cells, 2016,34(9):2429-2442.
[10] 杨雯,惠玲,吕同德,等.人脐带间充质干细胞向血管内皮细胞的定向分化及临床应用进展[J].解放军医药杂志,2013,25(10):26-30.
[11] 何洁,赵晶,王金祥,等.冻存脐带间充质干细胞的临床前制备[J].西南国防医药,2016,26(12):1365-1369.
[12] 李秀森,范海涛,原野,等.人骨髓间充质干细胞原位冷冻保存方法的改进[J].中国实验血液学杂志,2003,11(5):530-533.
[13] 谢南姿,李健,王海峰,等.低温冻存对人胎盘间充质干细胞生物学特性的影响[J].中西医结合心脑血管病杂志,2013,11(6):728-729.
[14] 许晓婷.兔骨髓间充质干细胞培养、冻存及体外分化为胰岛β细胞的研究[D].河南农业大学,2014.
[15] 袁雅红,王小莉,郭兴荣,等.脐带间充质干细胞支持脐血单个核细胞冻存复苏后的体外生长[J].湖北医药学院学报,2015,34(5):436-439,418.
[16] Zhao Q, Gregory C A, Lee R H,etal. MSCs derived from iPSCs with a modified protocol are tumor-tropic but have much less potential to promote tumors than bone marrow MSCs[J].Proc Natl Acad Sci U S A, 2015,112(2):530-535.
[17] Li C Y, Wu X Y, Tong J B,etal. Comparative analysis of human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy[J].Stem Cell Res Ther, 2015,6(1):55.
