杏仁核快速电点燃癫痫大鼠神经元限制性沉默因子表达变化
2018-05-31呼奶英于佳田别会杰王德广徐州医科大学人体解剖学教研室江苏徐州221004
呼奶英,于佳田,别会杰,王德广(徐州医科大学人体解剖学教研室,江苏 徐州 221004)
癫痫(epilepsy)是一种常见的中枢神经系统疾病,以脑内神经元突发性异常放电为著。其持续存在的自发反复发作对患者身体、生活、心理、认知等造成严重影响,并可伴随终身[1]。因此,其病因及发病机制一直是研究的重点,但尚未完全阐明[1-3]。目前,普遍接受的学说是神经元及神经环路兴奋性-抑制性系统的失衡。另与中枢神经系统神经递质及受体改变、血脑屏障破坏、离子通道异常、突触重塑、胶质细胞增生、神经发生、基因突变、免疫、遗传等有关[3]。也有研究表明,癫痫发生发展中存在包括DNA甲基化、组蛋白去乙酰化等异常的表观遗传学修饰,广泛影响癫痫相关基因的表达[4 - 5],这可能是重要的发病因素之一。
神经元限制性沉默因子(repressor element silencing transcription factor,REST)是一种Cys2/His2型锌指蛋白转录因子,在神经元的发育及疾病中具有重要的作用,与DNA中的神经元限制性沉默元件RE-1结合,修饰DNA、组蛋白及染色质等,可在转录水平调控相关基因的表达,影响神经元离子通道的表达、突触形成及传递和神经元的发生,从而影响神经元兴奋性等[5-6]。癫痫动物模型的研究表明,海马区REST表达上调,可调控生长因子、离子通道蛋白、细胞间缝隙连接、神经递质受体等的表达。海人酸诱导癫痫大鼠中,REST表达上调可抑制Calb1、Glra2、Grin2a、Hcn1、Kcnc2、Klf9和Myo5b等基因的表达,影响改变离子通道性质,紊乱神经元或神经环路兴奋性-抑制性平衡系统,参与癫痫的发生[7]。McClelland等人[8]进一步研究已明确,超级化激活环核苷酸阳离子通道(HCN1)的表达于癫痫发生后受到REST的显著抑制,以致对大脑皮质神经元兴奋性的抑制作用降低,加速癫痫的形成。杏仁核快速电点燃癫痫模型是目前难治性癫痫研究中公认的理想模型之一[9],其中REST的表达变化情况及其相关研究却鲜有报道。因此,本研究旨在探究癫痫发生后不同时间内REST表达变化,揭示其变化规律及其可能的作用。
1 材料和方法
1.1 实验动物
清洁级成年雄性SD大鼠24只,体重250~300 g,由徐州医科大学实验动物中心提供[SCXK (苏) 2015-0009]。所有大鼠在徐州医科大学动物中心动物房饲养[SYXK (苏) 2016-0028],屏障环境,室温22~25℃,湿度50%~70%,12 h光照/12 h黑暗循环,每日提供充足标准食物与饮水。
1.2 主要试剂与仪器
兔抗REST多克隆抗体购自艾博抗上海贸易有限公司,鼠抗NeuN单克隆抗体购自美国Sigma公司;生物素化羊抗鼠IgG、生物素化羊抗兔IgG均为北京中杉金桥公司产品。脑立体定位仪(美国Stoelting公司);YLS-9A生理、药理电子刺激仪(北京众实迪创科技发展有限责任公司);研究级系统显微镜BX-41(日本奥林巴斯株式会社)。
1.3 实验方法
1.3.1 动物分组
24只大鼠随机分为假手术组(S组)、癫痫模型2 h组(EP-2 h组)、癫痫模型14 d组(EP-14 d组)和癫痫模型35 d组(EP-35 d组)。
1.3.2 癫痫模型制作
采用杏仁核快速电点燃癫痫模型,参考本实验室前期制作方法[10 - 11]。大鼠用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉后固定于脑立体定位仪上,沿头部正中矢状位切开皮肤1.5~2 cm,充分暴露颅骨及前囟、冠状缝、矢状缝,参照Paxinos和Watson[12]的大鼠脑立体定位图谱确定杏仁基外侧核(basolateral amygdaloid nucleus,BLA)坐标(AP=-2.0 mm,ML=-5.0 mm,DV=-8.3 mm),颅钻钻孔,按照上述坐标头部植入双螺旋电极。术后恢复1周,采用恒流电刺激右侧杏仁基外侧核,隔日刺激,刺激参数为恒流电双相方波、波宽l ms、频率为60 Hz、持续时间2 s,每日刺激均从10 μA电流强度开始,逐渐增加电流至70 μA或诱发出V级癫痫,大鼠行为学变化参考Racine法[13]分级。其中V级发作为继发性全身性癫痫发作,如果动物连续三次出现V级发作,即被完全点燃(kindled)。假手术组大鼠按照上述方法只植入电极,不予刺激。本研究过程中按实验动物使用的3R原则给予人道主义关怀,充分考虑动物福利原则,尊重善待动物,最大程度减少对动物的伤害和动物的痛苦。
1.3.3 灌注、取脑及冰冻切片
末次刺激后2 h、14 d、35 d,大鼠麻醉灌注、取脑后固定,30%蔗糖沉底后行连续冠状切片,片厚30 μm。
1.3.4 NeuN/REST免疫组织化学染色
取各组大鼠脑片入3% H2O2清除内源性过氧化物酶,室温孵育30 min,10%羊血清室温封闭2 h,入鼠抗NeuN单克隆抗体(1∶100)或兔抗鼠REST多克隆抗体(1∶200),4℃孵育48 h,生物素化羊抗鼠/兔IgG(1∶200)室温孵育4 h,链霉卵白素-HRP(1∶200)室温孵育2 h,DAB/H2O2显色观察。贴片、酒精脱水,二甲苯透明和封片。
1.3.5 图像数据分析
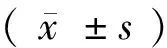
2 结果
2.1 各组大鼠海马区NeuN免疫组织化学染色结果
结果显示杏仁核快速电点燃癫痫完全点燃后2 h时,海马CA1、CA3和DG区域NeuN阳性神经元未发生明显变化;14 d、35 d时,该区域NeuN阳性神经元丢失明显,细胞间距增大、排列松散、染色浅淡。见图1。量化分析显示,与假手术组比较,EP-2 h组差异无显著性(P> 0.05),EP-14 d和EP-35 d组NeuN阳性神经元数丢失明显(P< 0.05)。见图2。

注:A~D:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组CA1部位NeuN表达;A1~D1:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组CA3部位NeuN表达;A2~D2:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组DG部位NeuN表达。图1 杏仁核电刺激大鼠癫痫发生后海马区NeuN表达减少Note.A-D: Expression of NeuN in the hippocampal CA1 region of rats in the sham group, electrical amygdala kindling epilepsy 2 h group, electrical amygdala kindling epilepsy 14 d group, electrical amygdala kindling epilepsy 35 d group. A1-D1: Expression of NeuN in the hippocampal CA3 region of rats in those four groups. A2-D2: Expression of NeuN in the hippocampal DG region of rats in those four groups.Fig.1 NeuN immunohistochemistry was decreased in the hippocampus of rapid amygdala kindling epilepsy rats compared with the sham group
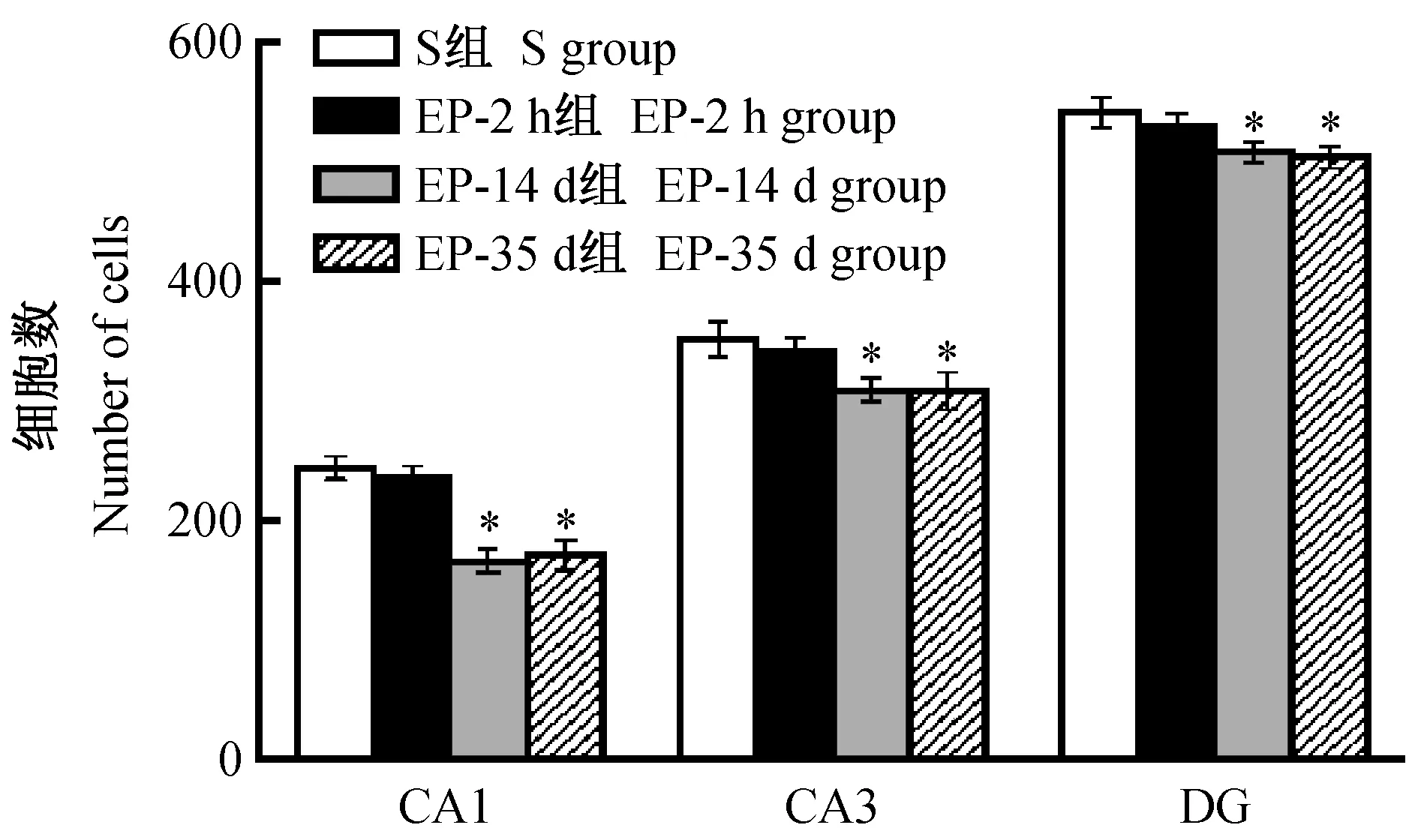
注:EP-2 h组、EP-14 d组和EP-35 d组海马CA1、CA3、DG部位NeuN阳性细胞数与假手术组相同部位比较,*P< 0.05。图2 杏仁核电刺激大鼠癫痫发生后海马NeuN阳性细胞数减少Note.The number of NeuN positive neurons in the hippocampal CA1, CA3 and DG regions of rats in the group EP-2 h, group EP-14 d and group EP-35 d was compared with that in the same regions of rats in the sham group,*P< 0.05.Fig.2 The number of NeuN positive neurons was decreased in the hippocampus of rapid amygdala kindling epilepsy rats compared with the sham group

注:A~D:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组CA1部位REST表达;A1~D1:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组CA3部位REST表达;A2~D2:分别为假手术组、杏仁核电点燃癫痫2 h组、杏仁核电点燃14 d组、杏仁核电点燃癫痫35 d组DG部位REST表达。图3 杏仁核刺激大鼠癫痫发生后海马CA1、CA3和DG部位REST表达上调Note.A-D: Expression of REST in the hippocampal CA1 region of rats in the sham group, electrical amygdala kindling epilepsy 2 h group, electrical amygdala kindling epilepsy 14 d group, electrical amygdala kindling epilepsy 35 d group. A1-D1: Expression of REST in the hippocampal CA3 region of rats in those four groups. A2-D2: Expression of REST in the hippocampal DG region of rats in those four groups.Fig.3 REST immunohistochemistry was increased in the hippocampus of rapid amygdala kindling epilepsy rats compared with the sham group
2.2 各组大鼠海马各区REST免疫组织化学染色结果
结果显示海马CA1、CA3和DG区锥体细胞层REST表达明显,REST阳性表达位于细胞核,棕褐色。杏仁核快速电点燃癫痫完全点燃后2 h时,海马CA1、CA3和DG区锥体细胞层REST阳性表达明显增加;14 d、35 d时,该区域REST阳性表达较假手术组稍有增加。见图3。量化分析显示,与假手术组比较,EP-2 h组、EP-14 d和EP-35 d组REST阳性表达明显上调(P< 0.05)。见图4。

注:EP-2 h组、EP-14 d组和EP-35 d组海马CA1、CA3和DG部位REST积分光密度值与假手术组相同部位比较,*P< 0.05。图4 杏仁核刺激大鼠癫痫发生后海马REST表达上调Note.The intergraloptical density of REST in the hippocampal CA1, CA3 and DG regions of rats in the group EP-2 h, group EP-14 d and group EP-35 d was compared with that in the same regions of rats in the sham group,*P< 0.05.Fig.4 REST expression was higher in the hippocampus of rapid amygdala kindling epilepsy rats compared with the sham group
3 讨论
颞叶癫痫作为癫痫疾病最为常见的类型,以大脑内神经元突发性异常放电为著,神经元兴奋性升高及突触重塑是重要的病理生理改变。但其复杂的发病机制目前尚不清楚[14]。近来相关研究表明,REST可限制性沉默神经元特异性基因,这不仅在神经发生发育中具有重要作用,在成熟神经元、亨廷顿、癫痫等疾病中亦具有重要作用[15]。癫痫发生后,REST通过调控相关基因表达,改变神经元离子通道及受体的数量活性或分布、海马苔藓纤维出芽、突触重塑等,影响神经元膜电位分布、细胞信号传导及神经传导等,造成神经元过度兴奋[5],这在癫痫疾病中可能起着重要作用。
本研究采用杏仁核快速电点燃方式建立成年大鼠癫痫模型,检测到海马区NeuN的表达于癫痫发生后14 d、35 d出现明显的神经元丢失,这与目前研究认为的癫痫发生后海马硬化的特征性改变一致[16]。颞叶癫痫发生可引起海马部位明显的神经元死亡的同时也会引起神经发生[17-19],这可能与REST表达变化相关。本研究中检测到杏仁核快速电点燃癫痫大鼠海马组织锥体细胞及DG颗粒细胞中REST表达持续上调,2 h达峰。REST持续上调,选择性识别结合癫痫相关基因中的RE-1元件,在转录水平对相关靶基因表达进行沉默或抑制,改变神经元离子通道数量或特性、突触结构等,致使神经元兴奋性升高或(和)局部兴奋性突触环路形成,癫痫易感性增加。海马组织是脑内与癫痫发生密切相关的重要结构之一,其中有近600多种编码离子通道、受体及其它影响神经元功能的基因[20]均含有RE-1元件,且成年大鼠海马区是脑内REST含量最高的区域之一,因此,该区域REST相关作用十分重要且复杂。McClelland等人[7 - 8]的研究表明,癫痫发生后海马组织内REST表达上调,其中Ca2+相关基因Calb1、Myo5b和Grin2a,K+相关基因Kcnc2和Klf9,以及Cl-相关基因Glra2等基因中的RE-1元件与REST结合增强,染色质发生持续性改变,相应的基因产物表达持续下调,神经元内Ca2+浓度增加和(或)Cl-内流减少等变化,导致神经元胞内Ca2+超载或Cl-稳态失衡,综合引起神经元兴奋性增高,致使癫痫反复发作或发作的易感性增高。研究也表明,对于维持神经元兴奋性十分重要的离子型谷氨酸受体GLUA2、脑源性神经营养因子BDNF等的表达,也受REST的调控[5]。选择性敲除小鼠前脑REST基因,海马区相关靶基因产物成纤维细胞生长因子FGF14及脑源性生长因子BDNF表达上调,DG颗粒细胞轴突出芽增加,形成异常局部兴奋性突触环路,癫痫易感性增加[21]。因此REST也有可能是抑制癫痫发作内源性因子。
总之,REST作为一种作用广泛的神经元限制性沉默因子,与癫痫的发生密切相关,受其抑制的基因以及潜在可被抑制的基因众多[22 - 23]。杏仁核快速电刺激癫痫大鼠海马REST的持续显著上调,可能引起相关神经递质及受体、离子通道蛋白等相关基因产物的表达变化,进而影响神经元兴奋性或神经环路兴奋性传导,参与癫痫的发生[15,20,24]。对于杏仁核快速电点燃癫痫大鼠中REST的相关作用,将进行进一步深入的研究。
参考文献:
[1] Steiger BK, Jokeit H. Why epilepsy challenges social life [J]. Seizure, 2017, 44: 194-198.
[2] Jozwiak S, Becker A, Cepeda C, et al. WONOEP appraisal: Development of epilepsy biomarkers - What we can learn from our patients? [J] Epilepsia, 2017, 58(6): 951-961.
[3] Tang F, Hartz AMS, Bauer B. Drug-resistant epilepsy: multiple hypotheses, few answers [J]. Front Neurol, 2017, 8: 301.
[4] 孟妍妍, 黄志凌, 肖波. 癫痫的表观遗传学研究进展 [J]. 中华医学杂志, 2015, 95(27): 2224-2226.
[5] Roopra A, Dingledine R, Hsieh J. Epigenetics and epilepsy [J]. Epilepsia, 2012, 53(Suppl 9): 2-10.
[6] Chen T, Giri M, Xia Z, et al. Genetic and epigenetic mechanisms of epilepsy: a review [J]. Neuropsychiatr Dis Treat, 2017, 13: 1841-1859.
[7] McClelland S, Brennan GP, Dubé C, et al. The transcription factor NRSF contributes to epileptogenesis by selective repression of a subset of target genes [J]. eLife, 2014, 3: e01267.
[8] McClelland S, Flynn C, Dubé C, et al. Neuron-restrictive silencer factor-mediated hyperpolarization-activated cyclic nucleotide gated channelopathy in experimental temporal lobe epilepsy [J]. Ann Neurol, 2011, 70(3): 454-464.
[9] 张瑞华, 王玉平. 电刺激点燃癫痫大鼠的皮层脑电及行为学研究 [J]. 中国比较医学杂志, 2015, 25(12): 54-58.
[10] 孙蒙蒙, 呼奶英, 马新财, 等. 慢病毒介导生长抑素过表达对大鼠海马电点燃癫痫的抑制作用 [J]. 中华行为医学与脑科学杂志, 2017, 26(7): 594-599.
[11] 孙蒙蒙, 于佳田, 呼奶英, 等. 海马电点燃癫痫增加大鼠兰斑酪氨酸羟化酶表达 [J]. 解剖学杂志, 2017, 40(4): 433-436.
[12] Paxinos G, Watson C. The rat brain in stereotaxic coordinates [M]. 5th edition. San Diego, California: Elsevier Academic Press, 2005.
[13] Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure [J]. Electroencephalogr Clin Neurophysiol, 1972, 32(3): 281-294.
[14] 吕瑞娟, 王群. 长链非编码RNA与癫痫的关系研究进展 [J]. 中华神经科杂志, 2016, 49(5): 410-413.
[15] Baldelli P, Meldolesi J. The transcription repressor REST in adult neurons: physiology, pathology, and diseases (1, 2, 3) [J]. eNeuro, 2015, 2(4): 1-15.
[16] Cendes F, Sakamoto AC, Spreafico R, et al. Epilepsies associated with hippocampal sclerosis [J]. Acta Neuropathol, 2014, 128(1): 21-37.
[17] Zhong Q, Ren BX, Tang FR. Neurogenesis in the hippocampus of patients with temporal lobe epilepsy [J]. Curr Neurol Neurosci Rep, 2016, 16(2): 20.
[18] 吴隽松, 成秀梅, 罗斌. 二苯乙烯苷对癫痫大鼠神经细胞增殖的影响及其机制探讨 [J]. 中国比较医学杂志, 2014, 24(10): 63-66.
[19] 高晨, 田立桩, 朱文霞, 等. 低氧预处理降低大鼠癫痫易感性及其脑保护作用的机制初探 [J]. 中国比较医学杂志, 2016, 26(12): 32-37.
[20] Zhao Y, Zhu M, Yu Y, et al. Brain REST/NRSF is not only a silent repressor but also an active protector [J]. Mol Neurobiol, 2017, 54(1): 541-550.
[21] Hu XL, Cheng X, Cai L, et al. Conditional deletion of NRSF in forebrain neurons accelerates epileptogenesis in the kindling model [J]. Cereb Cortex, 2011, 21(9): 2158-2165.
[22] Belyaev ND, Wood IC, Bruce AW, et al. Distinct RE-1 silencing transcription factor-containing complexes interact with different target genes [J]. J Biol Chem, 2004, 279(1): 556-561.
[23] Bruce AW, Donaldson IJ, Wood IC, et al. Genome-wide analysis of repressor element 1 silencing transcription factor/neuron-restrictive silencing factor (REST/NRSF) target genes [J]. Proc Natl Acad Sci U S A, 2004, 101(28): 10458-10463.
[24] Goldberg EM, Coulter DA. Mechanisms of epileptogenesis: a convergence on neural circuit dysfunction [J]. Nat Rev Neurosci, 2013, 14(5): 337-349.
