SIV感染猴外周血CD14+单核细胞CD169分子表达的变化
2018-05-31中国医学科学院医学实验动物研究所北京协和医学院比较医学中心卫计委人类疾病比较医学重点实验室国家中医药管理局人类疾病动物模型三级实验室新发再发传染病动物模型研究北京市重点实验室北京100021
李 想,薛 婧,陈 霆,丛 喆,魏 强(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫计委人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
唾液酸黏附素(sialic acid-binding immunoglobulin-type lectins, Siglecs)是宿主最大的唾液酸结合蛋白。Siglec-1,也被称作CD169,是第一个被发现的Siglecs家族的成员,主要表达于单核巨噬细胞和树突状细胞[1 - 2]。CD169可与病毒表面的某些糖蛋白结合,增强病毒与细胞的结合,从而促进病毒感染[3]。艾滋病又称获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS),是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的,HIV主要分为两种类型,即HIV-1和HIV-2,HIV-1是目前全球流行的主要病毒株。HIV-1研究中发现,机体感染HIV-1后,组织巨噬细胞和外周血单核细胞表面高表达CD169[4]。猴免疫缺陷病毒(simian immunodeficiency virus,SIV)是从灵长类动物身上分离得到的类似于HIV的病毒,SIV恒河猴模型被认为是研究艾滋病最有效的模型,而SIVmac239是常用的SIV病毒。因此,本研究观察了SIVmac239感染前后,恒河猴外周血单核细胞的比例及其表面CD169表达量的变化,分析了引起单核细胞CD169表达量变化的主要原因,以期为HIV-1/SIV感染单核巨噬细胞的研究提供新的思路。
1 材料和方法
1.1 实验材料
实验动物:SPF级中国恒河猴40只,3~4岁,3~5 kg,雌雄各半,购自北京协尔鑫生物资源研究所[SCXK (京) 2015-0011]。动物饲养及相关的实验在生物安全三级实验室中进行[SYXK (京) 2015-0036]。实验前,经血清学间接免疫荧光抗体检查法(IFA)检查排除猴B病毒(BV)、猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1)和猴T淋巴细胞性I型病毒(STLV-1)等相关病原体的感染。本实验通过本单位实验动物管理和使用委员会的动物伦理审查,批准号为XJ16007。
病毒及动物接种:SIVmac239,由美国Aaron Diamond艾滋病研究中心Preston Marx博士惠赠。中国恒河猴PBMC扩增制备,CEMx174细胞滴定TCID50为每毫升3 × 105。病毒使用剂量为500 TCID50,静脉接种病毒。
样本的收集:攻毒前和静脉攻毒后第49天,采集恒河猴外周血2 mL,进行全血流式;采集正常恒河猴外周血,分离PBMC,流式分选CD14+单核细胞,用含10%胎牛血清的RPMI-1640完全培养液,37℃、5% CO2孵箱中培养。
1.2 主要试剂与仪器
Recombinant Human IFN-alpha A protein(货号:11100-1)购自R&D公司;流式抗体PE Mouse Anti-Human CD14(货号:557154),FITC Mouse Anti-Human CD14(货号:555397),PE Mouse Anti-Human IFN-α(货号:560097)和PerCP-CyTM5.5 Mouse Anti-Human CD16(货号:560717)购自BD公司;流式抗体APC Anti-Human CD169(货号:346008)购自BioLegend公司;Human M-CSF(货号:300-25-10UG)和Human IL-13(货号:200-13-10UG)购自Peprotech公司;Recombinant Rhesus Macaque IL-4 Protein(货号:1577-IL-010/CF)购自R&D Systems公司;流式细胞洗液(PBS Ⅱ)为含2% FBS和2 mmol/L EDTA的PBS溶液。BD AccuriTMC6流式细胞仪,BD FACSAria Ⅱ流式细胞仪,日本Hitachi CF16RXII高速离心机,Dynamica台式离心机,ESCO生物安全柜,Thermo Forma二氧化碳恒温培养箱。
1.3 实验方法
1.3.1 流式细胞术分选恒河猴外周血CD14+单核细胞[5]
(1)恒河猴外周血PBMC分离:取40 mL正常恒河猴的外周血,2500 r/min离心10 min,弃去血浆,用RPMI-1640培养液等比稀释血细胞,混匀后,每10 mL血细胞稀释液缓慢加至5 mL Ficoll液面的上方(Ficoll与稀释前血液的体积比为1∶1),2800 r/min离心30 min,用吸管将中间单个核细胞层吸出,转移至另一新的离心管中,用不少于PBMC体积三倍的RPMI-1640培养液洗涤细胞两次,2000 r/min离心10 min,适量的RPMI-1640培养液重悬后计数。
(2)流式分选单核细胞:按20 μL抗CD14抗体/1 × 106个细胞的浓度加入抗体,混匀,4℃孵育30 min后,用PBS Ⅱ洗2次,4℃、2000 r/min离心3 min,适量PBS Ⅱ重悬后,使用BD FACSAria Ⅱ流式仪进行分选,得到CD14+单核细胞。
1.3.2 SIVmac239体外感染恒河猴外周血CD14+单核细胞[6]
取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,以100 μL的病毒用量感染细胞,混匀后置于37℃、5% CO2孵箱,培养48 h后,检测细胞表面CD169的表达量。
1.3.3 细胞因子刺激恒河猴外周血CD14+单核细胞[3]
(1)细胞因子IFN-α刺激单核细胞:取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,加入细胞因子IFN-α,使得IFN-α的终浓度为500 U/mL,48 h后检测细胞表面CD169的表达量。
(2)细胞因子M-CSF、IL-4、IL-13刺激单核细胞:取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,加入细胞因子M-CSF、IL-4和IL-13,使得M-CSF、IL-4和IL-13的终浓度均为20 ng/mL,48 h后检测细胞表面CD169的表达量。
1.3.4 流式细胞术检测细胞表面CD169分子表达量[7 - 8]
(1)全血流式:取100 μL全血,依次加入抗体PE Mouse Anti-Human CD14,PerCP-CyTM5.5 Mouse Anti-Human CD16,APC Anti-Human CD169,室温下避光孵育30 min,加入1 mL终浓度为10%的红细胞裂解液,室温作用8 min,加入1 mL PBS,2500 r/min离心5 min,弃去上清,加入2 mL PBS,2000 r/min离心10 min,适量PBS重悬过滤后BD AccuriTMC6流式细胞仪进行样本检测。
(2)胞外染色:将CD14+单核细胞从培养板中取出后,用PBS Ⅱ洗2次,4℃、2000 r/min离心3 min,调整细胞浓度为每毫升1 × 107个细胞,轻轻混匀后加入流式管内,每管100 μL。各流式管中加入相应抗体,4℃避光孵育30 min,PBS Ⅱ洗1次,PBS洗1次,PBS重悬后细胞筛过滤上机检测。
(3)胞内染色:每个流式管内加入100 μL IC Fixation Buffer,4℃孵育20 min,加入2 mL 1 × Permeabilization Buffer洗2次,4℃、2000 r/min离心3 min。100 μL 1 × Permeabilization Buffer重悬细胞后加入相应抗体,混匀后4℃避光孵育30 min,1 × Permeabilization Buffer洗2次,PBS洗1次,PBS重悬后细胞筛过滤上机检测。
1.4 统计学方法

2 结果
2.1 SIVmac239感染猴CD14+单核细胞表面分子CD169表达量分析
正常恒河猴经SIVmac239感染后,采集外周血,流式细胞术检测CD14+单核细胞的比例及其表面CD169分子表达量。结果显示,正常恒河猴外周血单核细胞低表达CD169,感染后,CD14+单核细胞的比例虽出现下降(P< 0.01)(图1A),但CD14+单核细胞表面CD169的表达量却显著增加(P< 0.01)(图1B)。
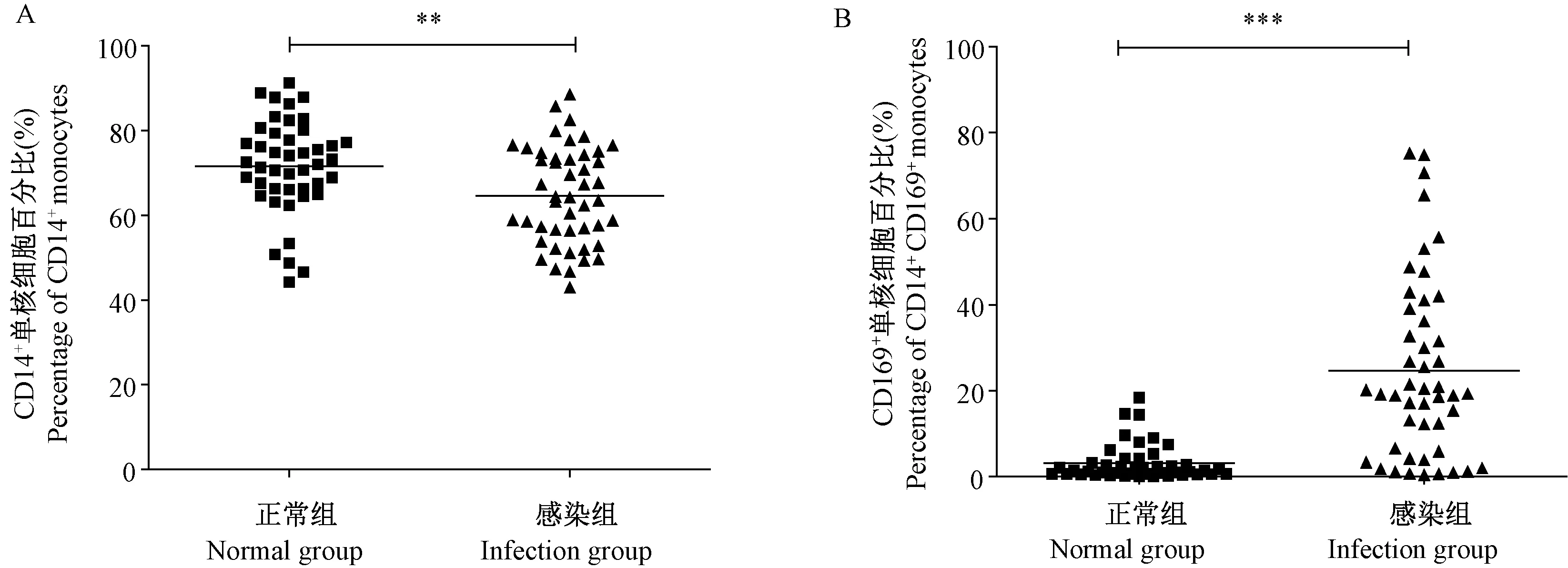
注:A:SIVmac239感染前后外周血单核细胞比例的变化;B:SIVmac239感染前后外周血单核细胞表面分子CD169表达量的变化。与正常组相比,** P< 0.01,*** P< 0.001;n=40。图1 CD14+单核细胞及其表面分子CD169在SIVmac239感染后表达量的变化Note.A: Changes in the percentage of peripheral blood CD14+ monocytes before and after SIVmac239 infection. B: Changes in the expression of CD169 on the surface of peripheral blood CD14+ monocytes before and after SIVmac239 infection. Compared with the normal group,**P< 0.01,***P< 0.001. n =40.Fig.1 Changes in the percentage of CD14+ monocytes in the peripheral blood and the expression of CD169 on their surface before and after SIVmac239 infection
2.2 SIVmac239感染前后恒河猴外周血不同单核细胞亚群CD169分子表达量分析
根据外周血单核细胞CD14和CD16表达量的差异,可将单核细胞分为三种亚型,经典型CD14++CD16-、中间过渡型CD14++CD16+和非经典型CD14+CD16++单核细胞。SIVmac239感染恒河猴前后,流式检测不同亚群单核细胞比例及其表面分子CD169表达量的变化。结果显示,感染后经典型CD14++CD16-和非经典型CD14+CD16++单核细胞的比例未发生明显的变化,中间过渡型CD14++CD16+单核细胞的比例出现下降(P< 0.01)(图2 A)。三种亚型单核细胞表面CD169的表达量均出现不同程度的增高(P< 0.01)(图2B)。其中,经典型CD14++CD16-和非经典型CD14+CD16++单核细胞表面CD169表达量升高较为明显,分别为感染前的10倍和11倍(图2C)。进一步分析可知,SIVmac239感染后,非经典型CD14+CD16++单核细胞表面分子CD169的表达量明显高于经典型CD14++CD16-单核细胞(P< 0.01)(图2D)。
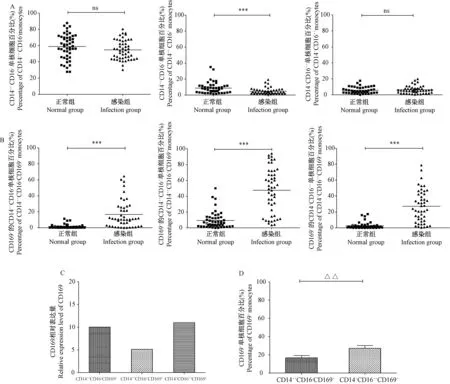
注:A:SIVmac239感染前后外周血不同亚群单核细胞比例的变化;B:SIVmac239感染前后外周血不同亚群单核细胞表面分子CD169表达量的变化;C:SIVmac239感染前后不同亚群单核细胞表面分子CD169表达量的比较;D:SIVmac239感染后经典型和非经典型单核细胞表面分子CD169表达量的比较。与正常组相比,*** P< 0.001,ns:差异无显著性;与CD14++CD16-CD169+相比,△△P< 0.01;n=40。图2 不同单核细胞亚群比例及其表面分子CD169在SIVmac239感染后表达量的变化Note.A: Changes in the percentage of different subsets of peripheral blood monocytes. B: Changes in the expression of CD169 on the surface of different subsets of peripheral blood monocytes. C: Comparison of the relative expression of CD169 on the surface of different subsets of monocytes. D: Comparison of the expression of CD169 on the surface of classical and non-classical monocytes after SIVmac239 infection. Compared with the normal group,***P< 0.001, ns: not significant. Compared with CD14++CD16-CD169+,△△P< 0.01. n=40.Fig.2 Changes in the percentage of different subsets of monocytes and the expression of CD169 on their surface after SIVmac239 infection
2.3 SIVmac239直接感染和不同细胞因子刺激CD14+单核细胞后CD169分子表达量的变化
正常恒河猴外周血流式分选CD14+单核细胞,细胞因子M-CSF、IL-4和IL-13等不能刺激CD14+单核细胞表面表达CD169(图3A),但经细胞因子IFN-α刺激48 h后,细胞表面高表达CD169,阳性率达到(98.9±0.89)%(图3B)。SIVmac239体外直接感染CD14+单核细胞,未能检测到CD169表达的变化(图3C),同时细胞内也未能检测到细胞因子IFN-α的表达(图3D)。

注:A:M-CSF、IL-4和IL-13诱导的CD14+单核细胞表面分子CD169表达量的变化;B:IFN-α诱导的CD14+单核细胞表面分子CD169表达量的变化;C:SIVmac239感染CD14+单核细胞后CD169表达量的变化;D:SIVmac239感染CD14+单核细胞后胞内细胞因子IFN-α表达量的变化。“……”:同型对照;“——”:CD169/IFN-α。图3 SIVmac239直接感染和不同细胞因子刺激的CD14+单核细胞表面分子CD169的变化Note.A: Changes in the expression of CD169 on the surface of CD14+ monocytes induced by M-CSF, IL-4 and IL-13. B: Changes in the expression of CD169 on the surface of CD14+ monocytes induced by IFN-α. C: Changes in the expression of CD169 on the surface of CD14+ monocytes after direct infection with SIVmac239. D: Changes in the expression of intracellular cytokine IFN-α of CD14+ monocytes after direct infection with SIVmac239. “……”: Isotype; “——”: CD169/IFN-α.Fig.3 Changes in the expression of CD169 on the surface of CD14+ monocytes after stimulated by different cytokines or directly infected with SIVmac239
3 讨论
单核巨噬细胞可以被HIV-1感染,成为HIV-1的潜伏感染细胞,其感染机制目前尚不完全明确。表达于单核巨噬细胞表面的CD169由于可以与病毒表面某些糖蛋白结合而促进病毒感染,从而成为HIV-1感染机制研究中的一个新的关注点。
本研究中发现,恒河猴外周血CD14+单核细胞在SIVmac239感染后比例略降低,这可能与外周血单核细胞向不同的组织迁徙分化为巨噬细胞有关[9]。同时,感染猴外周血CD14+单核细胞表面CD169的表达量显著增加,这与HIV-1感染后,组织巨噬细胞和外周血单核细胞高表达CD169的结果一致[4]。由此可见,单核巨噬细胞上表达的CD169分子确实和病毒的感染有关。
Ziegler-Heitbrock[10]根据外周血单核细胞CD14和CD16表达量的差异,将单核细胞分为三种亚型,经典型CD14++CD16-,中间过渡型CD14++CD16+和非经典型CD14+CD16++单核细胞。外周血单核细胞来源于骨髓,刚进入外周血时为经典型CD14++CD16-单核细胞,其中的一小部分分化为中间过渡型CD14++CD16+单核细胞,这类细胞最终可能分化为非经典型CD14+CD16++单核细胞,进入不同的组织,产生不同类型的终末分化巨噬细胞[11]。研究发现,非经典型CD14+CD16++单核细胞相比经典型CD14++CD16-单核细胞具有更强的吞噬能力和抗原提呈能力[9, 12],是发育更为成熟的细胞。恒河猴经SIVmac239感染后,非经典型CD14+CD16++单核细胞中CD169表达量的升高最为明显,其表达量明显高于经典型CD14++CD16-单核细胞,推测CD14+CD16++单核细胞更强的吞噬能力和抗原提呈能力可能与CD169具有吞噬和介导抗原提呈的作用[13 - 14]有关。
本研究还发现,SIVmac239体外直接感染正常恒河猴外周血CD14+单核细胞并不能引起CD169表达的增加,而使用IFN-α刺激可诱导单核细胞高表达CD169分子。但是,SIVmac239直接感染单核细胞并不能引起其本身分泌IFN-α,而使用其它细胞因子也不能引起单核细胞表达CD169。说明恒河猴外周血单核细胞CD169表达的增加不是病毒感染直接引起的,而是体内其它免疫细胞分泌的细胞因子IFN-α引起的。
综上所述,在HIV-1/SIV感染过程中,单核巨噬细胞表面CD169的表达量发生明显变化,其表达与病毒感染机体后其它细胞释放的细胞因子IFN-α相关,因此,对CD169的进一步研究可能为HIV-1感染机制的研究提供新的思路。
参考文献:
[1] Crocker PR, Paulson JC, Varki A. Siglecs and their roles in the immune system [J]. Nat Rev Immunol, 2007, 7(4): 255-266.
[2] Crocker PR, Mucklow S, Bouckson V, et al. Sialoadhesin, a macrophage sialic acid binding receptor for haemopoietic cells with 17 immunoglobulin-like domains [J]. EMBO J, 1994, 13(19): 4490-4503.
[3] Akiyama H, Ramirez NP, Gibson G, et al. Interferon-inducible CD169/Siglec1 attenuates anti-HIV-1 effects of IFN-α [J]. J Virol, 2017, 91(21): JVI.00972-17.
[4] van der Kuyl AC, van den Burg R, Zorgdrager F, et al. Sialoadhesin (CD169) expression in CD14+cells is upregulated early after HIV-1 infection and increases during disease progression [J]. PLoS One, 2007, 2(2): e257.
[5] 赵文秀, 张正奇, 许雅苹, 等. 不同流式抗体分选小鼠原位肝癌模型中髓系来源抑制性细胞的比较 [J]. 中国实验动物学报, 2013, 21(4): 42-46.
[6] Zheng Q, Hou J, Zhou Y, et al. Siglec1 suppresses antiviral innate immune response by inducing TBK1 degradation via the ubiquitin ligase TRIM27 [J]. Cell Res, 2015, 25(10): 1121-1136.
[7] 赵长城, 高锡强, 薛婧, 等. IL-21对恒河猴SHIV特异性CD8+T细胞毒性效应的影响 [J]. 中国实验动物学报, 2012, 20(5): 29-34.
[8] 彭卓颖, 丛喆, 李想, 等. 不同方法诱导THP-1细胞分化效果比较 [J]. 中国比较医学杂志, 2017, 27(9): 1-7.
[9] 王鑫, 康富标, 王桂平, 等. CD14+CD16+亚型单核细胞的研究进展 [J]. 免疫学杂志, 2012, 28(10): 910-913.
[10] Ziegler-Heitbrock L. Monocyte subsets in man and other species [J]. Cell Immunol, 2014, 289(1-2): 135-139.
[11] Moniuszko M, Liyanage NP, Doster MN, et al. Glucocorticoid treatment at moderate doses of SIVmac251-infected rhesus macaques decreases the frequency of circulating CD14+CD16++monocytes but does not alter the tissue virus reservoir [J]. AIDS Res Hum Retroviruses, 2015, 31(1): 115-126.
[12] Boudjeltia KZ, Brohee D, Piro P, et al. Monocyte-platelet complexes on CD14/CD16 monocyte subsets: relationship with ApoA-I levels. A preliminary study [J]. Cardiovasc Pathol, 2008, 17(5): 285-288.
[13] Izquierdo-Useros N, Lorizate M, McLaren PJ, et al. HIV-1 capture and transmission by dendritic cells: the role of viral glycolipids and the cellular receptor Siglec-1 [J]. PLoS Pathog, 2014, 10(7): e1004146.
[14] De Schryver M, Leemans A, Pintelon I, et al. Comparative analysis of the internalization of the macrophage receptor sialoadhesin in human and mouse primary macrophages and cell lines [J]. Immunobiology, 2017, 222(6): 797-806.
