以2-(苯磺酰基)苯乙酮衍生物为辅助配体的铱配合物的合成及性质
2018-05-30郭庆美杨至雨黄国利尹新颖卞健健滕明瑜李晓梅汪正良
郭庆美, 杨至雨, 黄国利, 尹新颖, 卞健健, 滕明瑜*, 李晓梅*, 汪正良*
(1. 云南师范大学 化学与化学工程学院, 云南 昆明 650500; 2. 云南民族大学 化学与环境学院, 云南 昆明 650504)
1 引 言
重金属配合物由于金属中心原子强的自旋耦合作用,使原本禁阻的三重态到单重态的辐射跃迁转为允许,从而可同时收获单重态和三重态激子,使得内量子效率可能达到100%。其中,IrⅢ配合物[1-9]由于具有好的热稳定性、短的激发态寿命、高的发光效率以及发光颜色易调节等优势[10],成为有机磷光材料的研究热点,是一类重要的有机电致和光致发光材料。
常见的IrⅢ配合物从结构上看分为3类:Ir(C^N)3型、Ir(C^N)2(L^X)型及Ir(C^N)2(N^N)离子型配合物。虽然fac-Ir(C^N)3表现出良好的光物理性质,但合成条件苛刻,所以目前常常用带有辅助配体(LX)的结构为Ir(C^N)2(L^X)的铱配合物来代替,这里C^N为芳联氮杂芳环类主配体,如 2-苯基吡啶(ppy),苯联异喹啉(piq),2-苯并噻吩吡啶(Btp)等,L^X是双齿辅助配体,例如:乙酰丙酮(acac),吡啶甲酸(pic)[11-12]等。根据密度泛函理论计算,分子的最高占轨道(HOMO)基本集中在中心金属铱上,而最低空轨道(LUMO)通常位于环金属化的分子轨道上。虽然大多数辅助配体对最低激发态没有直接的贡献,但它们可以通过控制金属Ir 的d(t2g)轨道能级来控制HOMO 的轨道能级,进而影响配合物的激发态。因此,IrⅢ配合物的光物理性质和载流子迁移率可以通过环金属化和辅助配体上的取代基进行调节。

2 实 验
2.1 试剂与仪器
实验所用的试剂及药品均为市售分析纯,其中主要试剂芳基硼酸及溴吡啶购自上海毕得医药科技有限公司,辅助配体苯磺酰基苯乙酮衍生物购自北京百灵威科技有限公司。红外光谱由Bruker TENSOR27红外光谱仪测定;核磁共振数据由Bruker公司 500 MHz核磁共振波谱仪测定(TMS内标,CDCl3及d6-DMSO做溶剂);质谱数据由Bruker公司micrOTOF Ⅱ质谱仪测定;紫外吸收光谱数据由上海美谱达UV-3100紫外-可见分光光度计测得;荧光光谱数据由Hitachi F-4600荧光分光光度计测得。LED发光性能由虹谱HPS2000高精度快速光谱分析系统测得。
配合物的发光量子效率的计算公式为:
Φs=Φstd[IsAsta/(IstdAs)](ηs/ηstd)2,
(1)
其中,Фs和Фstd分别代表待测样品和标准物质的发光量子产率,Is和Istd表示样品和基准物质在最大激发波长下的荧光积分强度,Astd和As分别代表样品和基准物质在激发波长下的吸光度,ηs和ηstd分别代表样品和基准物质的溶剂折光率。计算时用Ir(ppy)3作为基准物质,其磷光量子效率为0.4[14]。
循环伏安图由上海华辰电化学工作站测得。其中Ag/Ag+作为参比电极,铂盘电极为工作电极,铂丝电极为辅助电极。用除氧的二氯甲烷作溶剂,二茂铁作为内标,扫描速度为100 mV·s-1,扫描范围为-1.8~1.8 V,0.1 mol·L-1的四丁基六氟磷酸铵作为支持电解质。
2.2 配合物的合成
配合物的合成路线如图1所示。
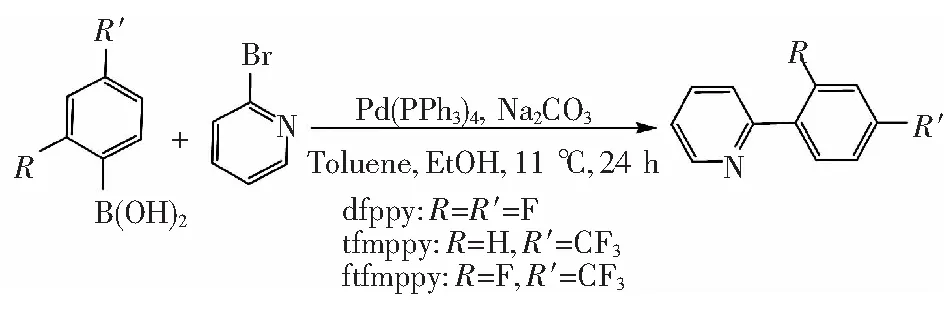
图1 主配体的合成路线
2.2.1 主配体的合成
称量20 mmol溴吡啶与24 mmol苯硼酸(n∶n= 1∶1.2)在250 mL圆底烧瓶中混合,再加入0.6 mmol四(三苯基膦)钯(Pd(PPh3)4)作为催化剂。用90 mL甲苯、30 mL无水乙醇、30 mL碳酸钠(2 mol/L)(v∶v∶v=3∶1∶1)的混合溶液做溶剂[15]。在氮气保护下加热回流24 h。反应结束后冷却至室温,过滤除去固体,用二氯甲烷将有机层萃取出来,重复3次,用饱和NaCl溶液洗剂萃取得到的有机物,将适量无水Na2SO4固体放入装有样品的锥形瓶中,干燥5 h后蒸除溶剂,用硅胶柱(PE∶EA=20∶1)提纯,得到纯的产品。
2-(2,4-二氟苯基)吡啶(2-(2,4-difluorophenyl) pyridine,dfppy):
无色液体3.52 g,产率92.1%。1H NMR (500 MHz, CDCl3)δ: 8.74(dt,J=4.8, 1.3 Hz, 1H), 8.03(td,J=8.8, 6.7 Hz, 1H), 7.81~7.73(m, 2H), 7.32~7.25(m, 1H), 7.09~7.00(m, 1H), 6.94(ddd,J=11.3, 8.8, 2.5 Hz, 1H)。
2-(4-三氟甲基苯基)吡啶((2-(4-trifluoromethylphenyl)pyridine,tfmppy):
白色固体4.31 g,产率:96.5%。1H NMR(500 MHz, CDCl3)δ: 8.76(d,J=4.4 Hz, 1H), 8.14
(d,J=8.1 Hz, 2H), 7.82 (m, 2H), 7.76 (d,J=8.2 Hz, 2H), 7.35~7.31 (m, 1H)。
2-(2-氟-4-三氟甲基苯基)吡啶((2-(2-fluoro-4-trifluoromethylphenyl)pyridine,ftfmppy):
无色液体4.39 g,产率90.6%。1H NMR (500 MHz, CDCl3)δ: 8.75(dt,J=4.6, 1.4 Hz, 1H), 8.07(td,J=8.5, 6.9 Hz, 1H), 7.44~7.35(m, 3H), 7.28(m, 1H), 6.90(m, 1H)。
2.2.2 氯桥配合物的合成
将4 mmol水合氯化铱与19 mmol主配体(n∶n=1∶4.75)混合于25 mL烧瓶中,加12 mL乙二醇乙醚和水(v∶v=3∶1)混合,氮气保护下加热回流24 h。反应结束后冷却,抽滤取固体,并用水和乙醇洗涤,得到黄色氯桥配合物,干燥,待用。
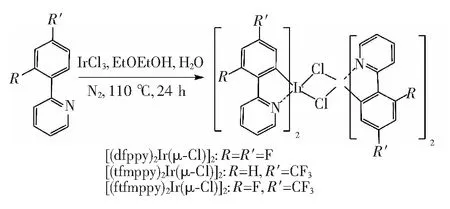
图2 氯桥配合物的合成路线
2.2.3 磷光配合物的合成
称取1 mmol氯桥配合物和2.5 mmol 2-(苯磺酰基)苯乙酮衍生物(n∶n=1∶2.5)混合于50 mL三颈烧瓶,再加入2.5 mmol无水碳酸钠,用N, N-二甲基甲酰胺使氯桥配合物完全溶解,氮气保护下加热回流24 h。反应结束后减压蒸馏蒸除溶剂,用硅胶柱(二氯甲烷∶甲醇)纯化,得到纯的产品。
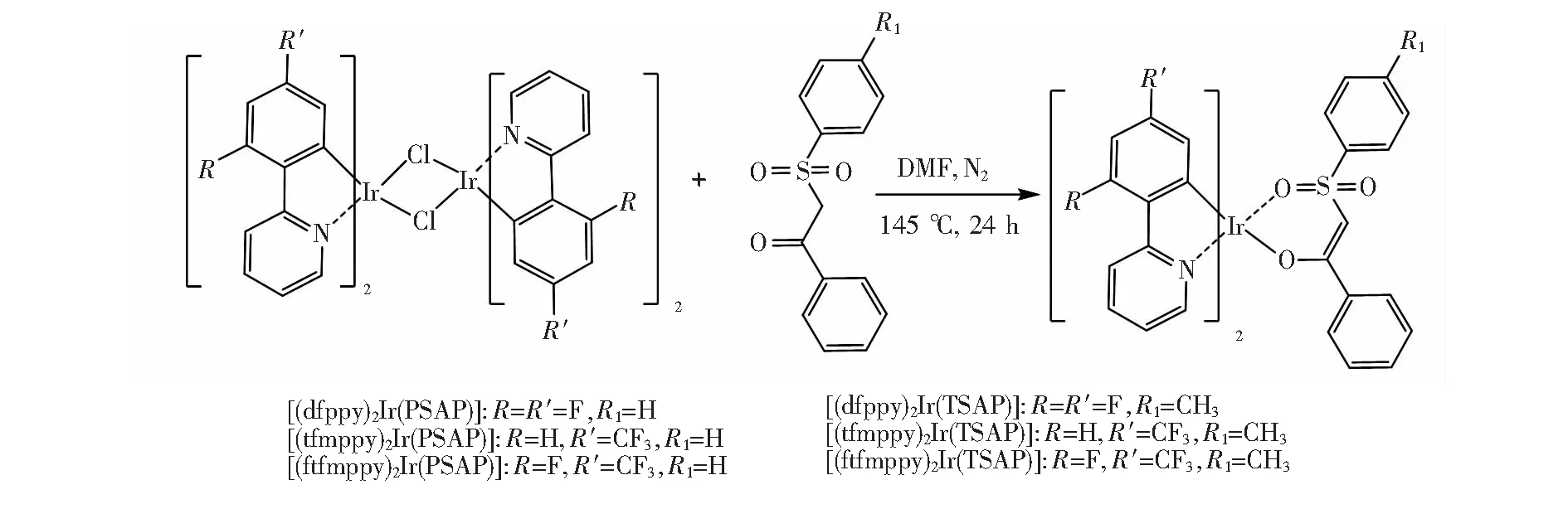
图3 磷光配合物的合成路线
[2-(2,4-二氟苯基)吡啶]铱[2-(苯磺酰基)苯乙酮](([2-(2,4-difluorophenyl)pyridine]2-Ir[2-(phenylsulfonyl)acetophenone],(dfppy)2-Ir(PSAP)):淡黄色固体0.30 g,产率:18.2%。1H NMR (500 MHz, DMSO)δ:10.56 (s, 2H), 8.00 (t,J=7.8 Hz, 2H), 7.75 (d,J=8.7 Hz, 2H), 7.58 (t,J=6.5 Hz, 2H), 7.03 (t,J=7.2 Hz, 2H), 6.78 (t,J=7.7 Hz, 4H), 6.52 (d,J=7.6 Hz, 4H), 6.46~6.33 (m, 2H), 5.76 (s, 1H), 5.17 (dd,J=8.3, 2.0 Hz, 2H)。13C NMR (125 MHz, DMSO)δ: 98.3, 113.1, 113.3, 121.4, 122.9, 125.7, 126.8, 127.5, 128.1, 128.8, 139.2, 149.2, 154.2, 158.9, 160.9, 162.7, 163.9, 165.9。IR(KBr)ν: 3 108, 3 066, 2 920, 2 857, 1 605, 1 585, 1 487, 1 432, 1 404, 1 383, 1 300, 1 215, 1 223, 1 160, 1 126, 1 112, 1 070, 1 028, 987, 854, 785, 756, 695, 583, 527 cm-1。 MS (ESI-TOF) Calcd: 832.10 [M+];Found:m/z573.055 0 [M+-PSAP]。
[2-(4-三氟甲基苯基)吡啶]铱[2-(苯磺酰基)苯乙酮](([2-(4-trifluoromethyl-phenyl)-pyridine]2Ir[2-(phenylsulfonyl)acetophenone], (tfmppy)2Ir(PSAP)):黄绿色固体0.39 g,产率:21.9%。1H NMR (500 MHz, DMSO)δ: 10.54 (d,J=4.3 Hz, 2H), 8.02 (t,J=7.6 Hz, 2H), 7.85 (d,J=8.0 Hz, 2H), 7.64 (t,J=6.5 Hz, 2H), 7.32 (d,J=8.1 Hz, 2H), 6.95 (t,J=7.3 Hz, 2H), 6.86 (d,J=7.9 Hz, 2H), 6.69 (t,J=7.6 Hz,4H), 6.49 (d,J=7.6 Hz, 4H), 5.91(s, 2H), 5.76 (s, 1H)。13C NMR(125 MHz, DMSO)δ: 97.0, 118.7, 120.6, 123.4, 123.9, 125.6, 125.9, 126.8, 127.0, 128.1, 128.4, 138.7, 147.8, 153.9, 166.1. IR(KBr)ν: 3 122, 3 080, 2 920, 2 857,1 620, 1 612,1 571, 1 494, 1 439, 1 383, 1 320, 1 279, 1 251, 1 167, 1 126, 1 070, 1 028, 1 014, 994, 889, 826, 785, 750, 695, 604, 520 cm-1。MS(ESI-TOF) Calcd: 896.11[M+]; Found:m/z637.066 7 [M+-PSAP]。
[2-(2-氟-4-三氟甲基苯基)吡啶]铱[2-(苯磺酰基)苯乙酮] ([2-(2-fluoro-4-trifluoromethylphenyl)pyridine]2Ir[2-(phenylsulfonyl)acetophenone], (ftfmppy)2Ir(PSAP)):黄绿色固体0.38 g,产率:20.5%。1H NMR(500 MHz, DMSO)δ:10.77(s, 1H), 8.15~8.07(m, 1H), 7.91(d,J= 8.6 Hz, 1H), 7.74 (t,J=6.7 Hz, 1H), 6.98 (t,J=7.2 Hz, 1H), 6.71 (t,J=7.7 Hz, 3H), 6.43 (d,J=7.5 Hz, 2H), 5.76 (s, 1H), 5.71 (s, 2H)。13C NMR(125 MHz, DMSO)δ:107.0, 122.3, 122.8, 124.1, 124.3, 125.6, 125.9, 126.8, 128.1, 128.7, 134.6, 139.5, 149.1, 154.6, 158.0, 160.1, 163.3。IR(KBr)ν: 3 101, 3 059, 2 927, 2 857, 1 647, 1 612, 1 571, 1 487, 1 404, 1 327, 1 288, 1 209, 1 153, 1 084, 1 028, 924, 875, 854, 785, 757, 709, 688, 583, 513 cm-1。MS(ESI-TOF) Calcd: 928.09 [M+]; Found:m/z673.049 7 [M+-PSAP]。
[2-(2,4-二氟苯基)吡啶]铱[2-(对甲苯磺酰基)苯乙酮](([2-(2,4-difluorophenyl)pyridine]2Ir[2-(p-toluenesulfonyl)acetophenone], (dfppy)2Ir(TSAP)):黄绿色固体0.31 g,产率:18.5%。1H NMR(500 MHz, DMSO)δ: 10.51(s,2H), 8.00(t,J=7.7 Hz, 2H), 7.75(d,J=8.5 Hz, 2H), 7.55(d,J=6.3 Hz, 2H), 6.56(d,J=7.9 Hz, 4H), 6.39(d,J=7.8 Hz, 7H),5.76(s, 1H), 5.15(dd,J=8.3, 2.0 Hz, 2H), 2.10(s, 3H)。13C NMR(DMSO, 125 MHz)δ: 24.8, 100.0, 102.0, 117.3, 117.4, 126.4, 129.1, 129.6, 130.8, 131.4, 133.8, 141.9;13C NMR(DMSO, 500 MHz)δ:143.5, 148.0, 157.4, 163.1, 165.0, 168.3。 IR (KBr)ν:3 108, 3 065, 2 924, 2 852, 1 612, 1 603, 1 571, 1 486, 1 434, 1 398, 1 251, 1 221, 1 163, 1 136, 1 119, 1 038, 972, 862, 811, 752, 708, 642, 590 cm-1。MS(ESI-TOF)Calcd: 846.12 [M+]; Found:m/z573.053 3 [M+-TSAP]。
[2-(4-三氟甲基苯基)吡啶]铱[2-(对甲苯磺酰基)苯乙酮](([2-(4-trifluoromethylphenyl) pyridine]2Ir[2-(p-toluenesulfonyl)acetophenone], (tfmppy)2Ir(TSAP)):黄绿色固体0.41 g,理论产量为1.79 g,产率:22.8%。C39H27N2F6IrO3S1H NMR(500 MHz, DMSO)δ:10.46 (d,J=4.5 Hz, 2H), 8.00 (t,J=8.0 Hz, 2H),7.87(d,J=7.7 Hz, 2H), 7.58(t,J=6.5 Hz, 2H), 7.37(d,J=6.8 Hz, 2 H), 6.87(s, 2H), 6.62~6.29(m, 7H), 5.87(s, 2H), 5.76(s, 1H), 5.33(t,J=4.8 Hz, 2H), 2.5(s, 3H)。13C NMR(125 MHz, DMSO)δ: 24.7, 119.0, 119.6, 122.8, 123.1, 123.8, 124.9, 125.4, 127.5, 127.7, 129.7, 129.9, 138.0, 139.4, 146.6,153.8, 169.9。IR(KBr)ν: 3 122, 3 081, 2 920, 2 864, 1 647, 1 612, 1 571, 1 487, 1 439, 1 332, 1 258, 1 160 cm-1。MS(ESI-TOF) Calcd: 910.13 [M+];Found:m/z637.066 6 [M+-TSAP]。
[2-(2-氟-4-三氟甲基苯基)吡啶]铱[2-(对甲苯磺酰基)苯乙酮](([2-(2-fluoro-4-tr-ifluoromethylphenyl)pyridine]2Ir[2-(p-toluenesulfonyl)acetophenone], (ftfmppy)2Ir(TSAP)):黄绿色固体0.37 g,产率:19.8%。1H NMR(500 MHz, DMSO)δ: 10.68(d,J=5.3 Hz, 1H), 8.12(t,J=7.7 Hz, 1H),7.92(d,J=8.6 Hz, 1H), 7.73(t,J=6.6 Hz, 1H), 6.77(d,J=12.5 Hz, 1H), 6.50(d,J=8.0 Hz, 2H), 6.30(d,J=8.0 Hz, 2H), 5.66(s, 1H), 4.14(q,J=5.2 Hz, 2H), 2.12(s, 3H)。13C NMR (125 MHz, DMSO)δ: 24.3, 110.8, 111.1, 125.7, 126.7, 127.8, 127.9, 128.0, 129.1, 131.6, 137.8, 142.6, 143.9, 148.1, 157.9, 160.3, 162.1, 164.2 167.5, 167.6。IR(KBr)ν: 3 108, 3 066, 2 920, 2 843, 1 612, 1 571, 1 494, 1 460, 1 411, 1 376, 1 293, 1 216, 1 181, 1 160, 1 035, 1 014, 931, 882, 861, 806, 792, 764, 709, 639, 583, 513 cm-1。MS(ESI-TOF) Calcd: 946.11[M+]; Found:m/z673.049 4 [M+-TSAP]。
2.3 发光二极管的制备
用固晶胶把InGaN芯片粘在支架上,在烘箱中150 ℃烘烤1 h,将胶水烤干,使芯片与支架粘连接在一起;将芯片的正负极分别与支架碗杯的正负极用金线相连接,使芯片与支架焊接在一起,形成导电回路;将道康宁AB胶与铱配合物固体粉末按1∶1比例混合均匀后加入已焊接好金线的支架碗杯中,再次放入烘箱中在150 ℃恒温固化1 h;用胶水(环氧树脂)将已固晶、焊线和涂粉的半成品封装起来;将环氧树脂固化充分,同时将LED热老化;将整片的支架切割成单颗材料;对经过封装和老化试验的LED进行光电参数测试。其中裸管在5 V电压、20 mA电流下的效率为1.0 lm·W-1。
3 结果与讨论
3.1 光物理性质
6个磷光配合物在二氯甲烷溶液中的紫外-可见光谱如图4所示,由紫外-可见光谱图可以看出,6个配合物的吸收光谱形状相似,只有吸收峰的位置有微小的变化,这样的变化是由配体中的取代基的不同引起的。在二氯甲烷溶液中配合物都出现3个明显的吸收峰,其中波长小于360 nm的吸收峰由主配体间单线态的跃迁引起,波长大于360 nm的吸收峰由金属和配体间的电荷转移态跃迁(1MLCT,3MLCT)所致[16],这也表明了中心金属铱具有强的自旋轨道耦合,实现了单重态与多重态的混合,这对提高配合物的发光效率有着重要意义。
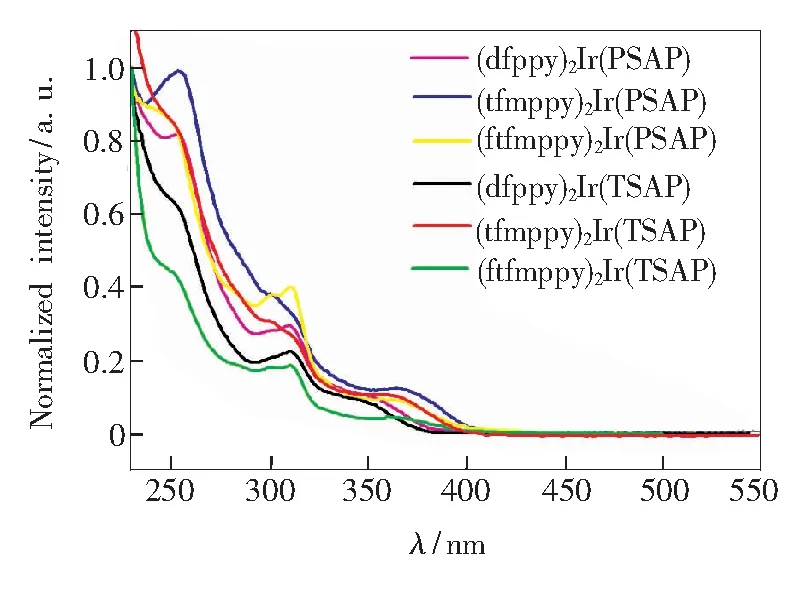
图4 以PSAP和TSAP为辅助配体的配合物的紫外-可见吸收光谱
在二氯甲烷溶液中的发射光谱如图5所示。配合物在二氯甲烷溶液中的发射波长显示,PSAP和TSAP为辅助配体的铱配合物的最大发射波长位于479~495 nm。当主配体相同时,由—CH3取代的TSAP为辅助配体与PSAP为辅助配体的配合物相比,(dfppy)2Ir(PSAP)与(dfppy)2-Ir(TSAP)、(tfmppy)2Ir(PSAP)与(tfmppy)2-Ir(TSAP)、(tfmppy)2Ir(PSAP)与(tfmppy)2-Ir(TSAP)最大发射波长红移1~9 nm。与Ir(dfppy)3[17]相比,配合物(dfppy)2Ir(PSAP)和(dfppy)2Ir(TSAP)的发射波长分别蓝移23 nm和22 nm;与Ir(tfmppy)3[18]相比,(tfmppy)2-Ir(PSAP)和(tfmppy)2Ir(TSAP)的发射波长分别蓝移32 nm和23 nm;与我们合成的Ir(ftfmppy)3相比,(ftfmppy)2Ir(PSAP)和(ftfmppy)2Ir(TSAP)的发射波长蓝移22 nm和21 nm。这样的移动表明辅助配体PSAP和TSAP对配合物的发射波长具有调节作用。值得一提的是,(dfppy)2Ir(PSAP)与(dfppy)2Ir(TSAP)均有两个发射峰,其中一个在450 nm,另一个在480 nm。而同样以dfppy为主配体的FIrpic[3,10-11]与FIr6[3],前者的最大发射峰在470 nm和494 nm,后者的最大发射峰在460 nm处。相较于这两种著名的蓝色磷光材料,我们合成得到的这两个材料的发射光谱更接近纯蓝光。我们推测这是由于磺酰基团更强的吸电子能力所致。
固体的发射光谱如图6所示,从固体发射光谱中可以看出,该类配合物的固体最大发射波长位于479~503 nm,与相同主配体的其他配合物相比[19-20],以2-(苯磺酰基)苯乙酮衍生物为辅助配体的配合物的固体和溶液的最大发射波长的差别很小,相差最大的不到10 nm,这表明新合成的配合物在固态下的p-p堆积相互较小[19,21],辅助配体对配合物发光波长具有调节作用。
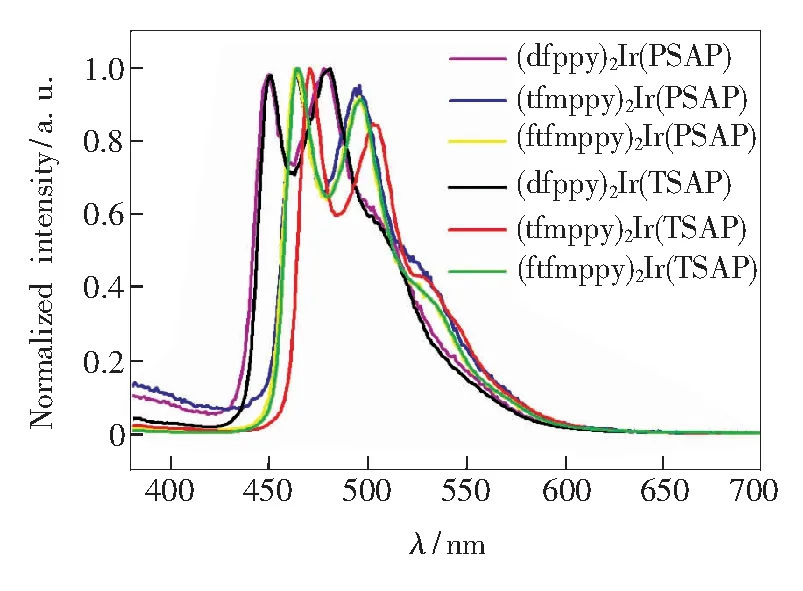
图5 以PSAP和TSAP为辅助配体的配合物在二氯甲烷溶液中的发射光谱
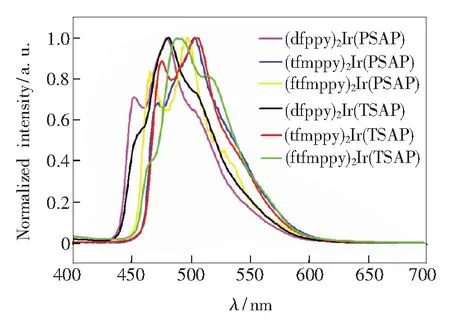
图6 以PSAP和TSAP为辅助配体的配合物的固体发射光谱
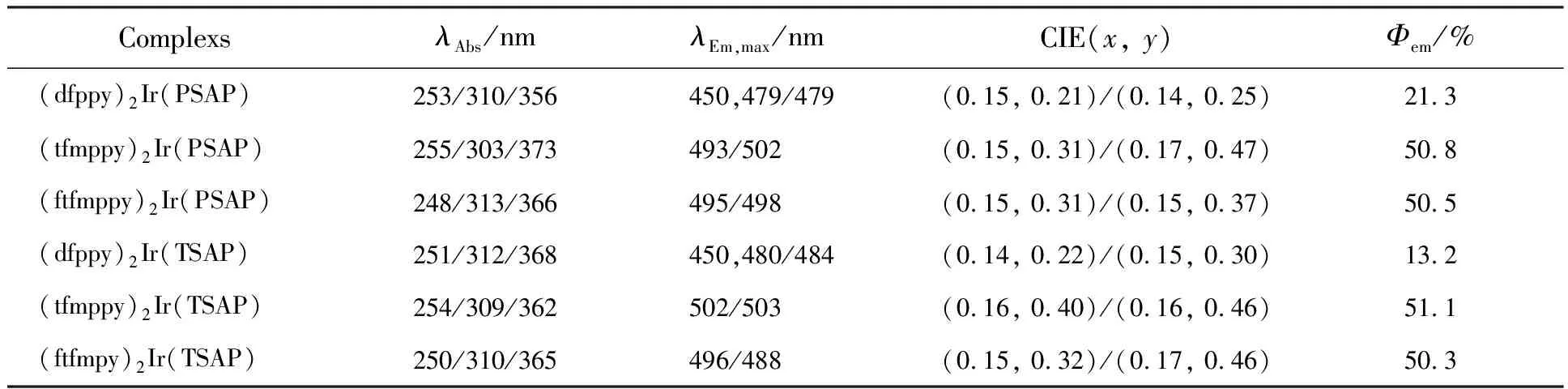
表1 以PSAP和TSAP为辅助配体的配合物的光物理性质
配合物的光物理性质测定结果如表1所示,由测试结果可以发现,6个配合物中除(dfppy)2-Ir(PSAP)和(dfppy)2Ir(TSAP)在蓝光区域,其余化合物在蓝绿光区域。经过计算得到配合物的发光量子产率在13.2%~51.1%,当辅助配体相同时,主配体中有—CF3取代的配合物表现出较高的磷光量子产率,这表明强吸电子基团的引入有利于提高配合物的发光效率。与Ir(dfppy)3[17]相比,配合物(dfppy)2Ir(DSAP)和(dfppy)2Ir-(TSAP)的量子效率相对较小;与Ir(tfmppy)3[18]相比,(tfmppy)2Ir(DSAP)和(tfmppy)2Ir(TSAP)的量子效率分别提高46.2%和47.5%;与我们合成的Ir(ftfmppy)3相比,(ftfmppy)2Ir(DSAP)和(ftfmppy)2Ir(TSAP)的量子效率分别提高44.2%和44%。由此可得,辅助配体DSAP和TSAP的引入在很大程度上提高了配合物的发光效率。
3.2 电化学性质
取二茂铁的真空HOMO能级为-4.5 eV,通过比较测得的配合物与二茂铁的C-V曲线氧化电位相对值得到各个配合物的HOMO能级,再结合其紫外-可见吸收光谱,计算得到分子的HOMO/LUMO能级,配合物的电化学性质测试结果如表2所示。由测试结果可以看出,与其他配合物相比,以dfppy为主配体的(dfppy)2Ir(PSAP)和(dfppy)2Ir(TSAP)的LUMO能级较高,这是由于—F的吸电子能力比—CF3的相对较弱,而配合物的LUMO能级由主配体提供[22],对配合物的LUMO能级降低得较少,致使分子能隙变宽,发射波长蓝移。当主配体相同时,不同的辅助配体的配合物的分子能级也存在差异。与(dfppy)2-Ir(PSAP)相比,(dfppy)2Ir(TSAP)的能隙减小0.02 eV;与(tfmppy)2Ir(PSAP)相比,(tfmppy)2-Ir(TSAP)的能隙减小0.09 eV;与(ftfmppy)2-Ir(PSAP)相比,(ftfmppy)2Ir(TSAP)的能隙减小0.15 eV。 这样的微小变化可以解释为由辅助配体TSAP中苯环对位上的—CH3引起的。这表明辅助配体上有不同的取代基会影响配合物的电化学性质。
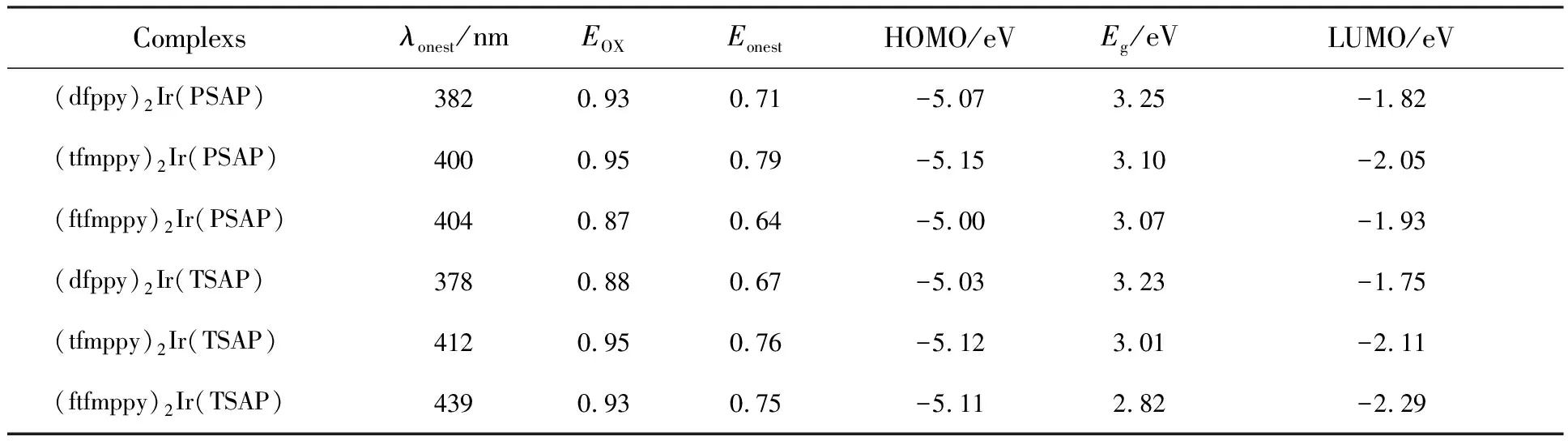
表2 以PSAP和TSAP为辅助配体的配合物的电化学性质
3.3 光致发光性能
以PSAP和TSAP为辅助配体的配合物制备得到二极管的发射光谱如图7所示,发光性能测试结果如表3所示,发光图片如图8所示。
由谱图可得,以PSAP和TSAP为辅助配体的配合物最大光致发光波长位于507~543 nm之间,配合物的最大发射波长主要受主配体影响,而辅助配体对配合物的最大发射波长影响较小。其中以dfppy为主配体的配合物最大发射波长较短,属于蓝绿光发射,其他配合物主要在绿光区。同时,这些配合物的光致发光谱与其固体发射光谱相似,这是由于制备发光二极管使用了纯的配合物固体粉末,没有对粉末进行掺杂的缘故。
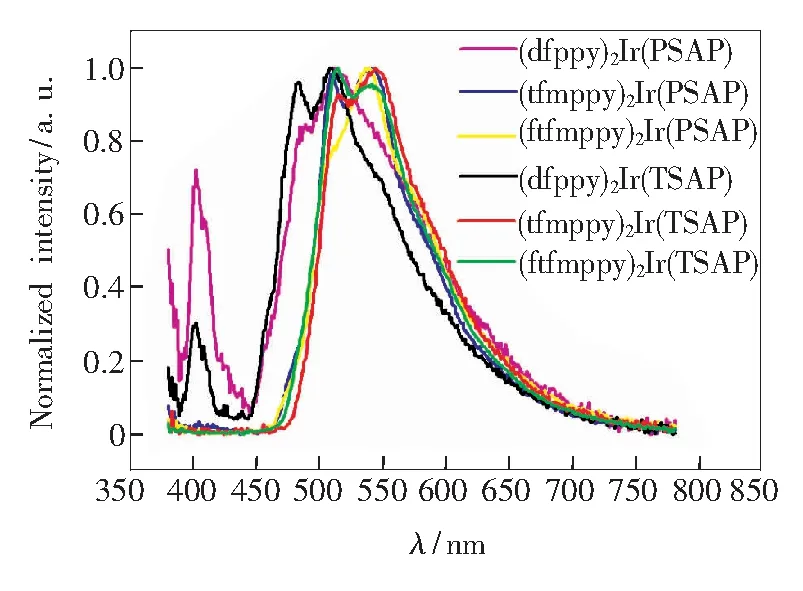
图7 以PSAP和TSAP为辅助配体的配合物二极管的发射光谱
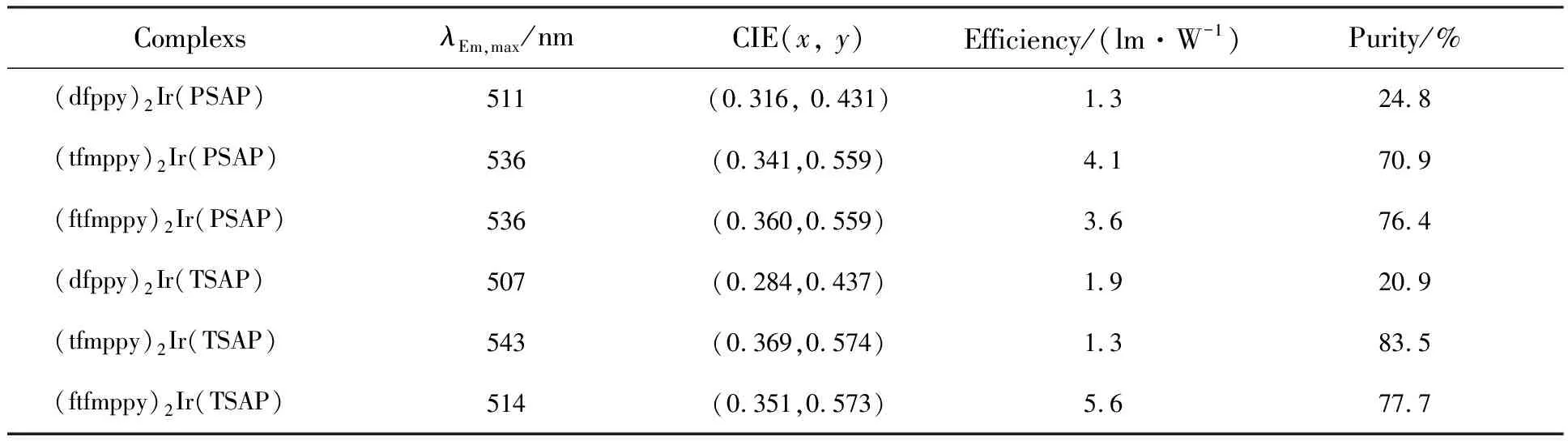
表3 以PSAP和TSAP为辅助配体的配合物二极管的发光性能
从效率来看,基于这些配合物的光致发光二极管的发光效率在1.3~5.6 lm·W-1之间,色纯度在20.9%~83.5%之间,材料性能处于中等偏上水平。该结果与配合物的内量子产率相符合,发光颜色偏绿光的配合物制备的光致发光二极管发光效率较高,而发光颜色为蓝绿光的配合物制备得到的光致发光二极管发光效率和色纯度偏低,这与文献报道的结果相符合[23]。

图8 以PSAP和TSAP为辅助配体的配合物二极管的发光图片
从发光颜色上看,在395 nm的激发波长下,配合物(dfppy)2Ir(PSAP)、(ftfmppy)2Ir(PSAP)、(tfmppy)2Ir(TSAP)、(ftfmppy)2Ir(TSAP)制备的二极管发射波长在蓝绿光到黄绿光区域,配合物(dfppy)2Ir(PSAP)、(dfppy)2Ir(TSAP)制备的二极管的发射波长在蓝绿光区域。其中配合物(dfppy)2Ir(PSAP)的LED色坐标与白光接近,通过将该类磷光体与适当的蓝色和红色磷光体组合来获得发白光的LED是有利的,因为最常用的方法是将红色、绿色、蓝色磷光体与GaN/InGaN芯片组合[24]。从应用的角度来看,每种合适的单色LED磷光体必须满足以下必要的条件:(1)磷光体必须有效地吸收InGaN芯片发射的400 nm激发能量,但是任何单色磷光体不能吸收所有这种能量,否则其他磷光粉可能无法有效激发;(2)在400 nm激发下,发光体显示较高的发光强度;(3)发光体的色度坐标接近NTSC(国家电视标准委员会)标准值[24]。本文合成的配合物中除(dfppy)2Ir(PSAP)和(dfppy)2Ir(TSAP)的色纯度较低外,其余4种配合物均满足以上条件,因此可以作为三波段白色LED的绿色组分的良好候选材料。
4 结 论
本文首次利用2-(苯磺酰基)苯乙酮衍生物PSAP和TSAP作为辅助配体,合成得到了6种新型IrⅢ磷光配合物,并用核磁和红外数据对它们的结构进行了鉴定。通过对磷光配合物的发光性质和电化学性质进行测试分析,表明这些配合物的发射波长范围为450~502 nm,发光区域为蓝绿光至绿光区,波长覆盖范围为23 nm,通过调节主配体及辅助配体的结构,能够小范围内对配合物最大发射波长进行调控。在6种配合物中,主配体中含有三氟甲基取代的配合物的发光量子效率较高,均在50%左右;而含有氟取代的配合物的发光量子效率仅为20%左右。主要由于三氟甲基的吸电子能力很强,使配合物的LUMO能级降低,能隙变窄,从而提高了配合物的量子效率。将配合物的固体粉末用于制作发光二极管,并测试了二极管的发光性能。二极管的最大发射波长在511~543 nm,发光效率在1.3~5.6 lm·W-1,其中(tfmppy)2Ir(PSAP)、(ftfmppy)2Ir(PSAP)、(tfmppy)2Ir(TSAP)、(ftfmppy)2Ir(TSAP)4种配合物都具有较高的色纯度,因此可以作为绿光组分用于白光LED的制作。
参 考 文 献:
[1] KANG D M, KANG J W, PARK J W,etal.. Iridium complexes with cyclometalated 2-cycloalkenyl-pyridine ligands as highly efficient emitters for organic light-emitting diodes [J].Adv.Mater., 2010, 20(10):2003-2007.
[2] CHEN Z Q, BIAN Z Q, HUANG C H. Functional IrⅢcomplexes and their applications [J].Adv.Mater., 2010, 22(13):1534-1539.
[3] XIAO L X, CHEN Z J, QU B,etal.. Recent progresses on materials for electrophosphorescent organic light-emitting devices [J].Adv.Mater., 2011, 23(8):926-952.
[4] RAI V K, NISHIURA M, TAKIMOTO M,etal.. Bis-cyclometalated Iridium(Ⅲ) complexes bearing ancillary guanidinate ligands. Synthesis, structure, and highly efficient electroluminescence [J].Inorg.Chem., 2012, 51(2):822-835.
[5] MONTI F, KESSLER F, DELGADO M,etal.. Charged bis-cyclometalated iridium(Ⅲ) complexes with carbene-based ancillary ligands [J].Inorg.Chem., 2013, 52(18):10292-10305.
[6] LEE S, KIM S O, SHIN H,etal.. Deep-blue phosphorescence from perfluoro carbonyl-substituted iridium complexes [J].J.Am.Chem.Soc., 2013, 135(38):14321-14328.
[7] KIM J B, HAN S H, YANG K,etal.. Highly efficient deep-blue phosphorescence from heptafluoropropyl-substituted iridium complexes [J].Chem.Comm., 2015, 51(1):58-61.
[8] SAHIN C, GOREN A, VARLIKLI C. Synthesis, characterization and photophysical properties of iridium complexes with amidinate ligands [J].J.Organomet.Chem., 2014, 772-773:68-78.
[9] LIU X, ZHANG S, JIN Y M,etal.. Syntheses, crystal structure and photophysical property of iridium complexes with 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives as ancillary ligands [J].J.Organomet.Chem., 2015, 785:11-18.
[10] LAMANSKY S, DJUROVICH P, MURPHY D,etal.. Highly phosphorescent bis-cyclometalated iridium complexes: synthesis, photophysical characterization, and use in organic light emitting diodes [J].J.Am.Chem.Soc., 2001, 123(18):4304-4312.
[11] YOU Y, PARK S Y. Inter-ligand energy transfer and related emission change in the cyclometalated heteroleptic iridium complex: facile and efficient color tuning over the whole visible range by the ancillary ligand structure [J].J.Am.Chem.Soc., 2005, 127(36):12438-12439.
[12] TAO Y T, YANG C L, QIN J G. Organic host materials for phosphorescent organic light-emitting diodes [J].Chem.Soc.Rev., 2011, 40(5):2943-2970.
[13] ZHU M R, ZOU J H, HU S J,etal.. Highly efficient single-layer white polymer light-emitting devices employing triphenylamine-based iridium dendritic complexes as orange emissive component [J].J.Mater.Chem., 2012, 22(2):361-366.
[14] KING K A, SPELLANE P J, WATTS R J. Excited-state properties of a triply ortho-metalated iridium(Ⅲ) complex [J].J.Am.Chem.Soc., 1985, 107(5):1431-1432.
[15] DE GROOT D, DE WAAL B F M, REEK J N H,etal.. Noncovalently functionalized dendrimers as recyclable catalysts [J].J.Am.Chem.Soc., 2001, 123(35):8453-8458.
[16] GRISHTEIN J, FRYDMAN L. Solid state separated-local-field NMR spectroscopy on half-integer quadrupolar nuclei:principles and applications to borane analysis [J].J.Am.Chem.Soc., 2003, 125(24):7451-7460.
[17] LAMANSKY S, KWONG R C, NUGENT M,etal.. Molecularly doped polymer light emitting diodes utilizing phosphorescent Pt(Ⅱ) and Ir(Ⅲ) dopants [J].Org.Electron., 2001, 2(1):53-62.
[18] TENG M Y, WANG C C, JING Y M,etal.. Efficient green organic light-emitting diodes withfac-tris(2-(4-trifluoromethylphenyl)pyridine)iridium complex as emitter [J].Chin.J.Inorg.Chem., 2013, 29(7):1490-1496.
[19] TENG M Y, ZHANG S, JIN Y M,etal.. Efficient organic light-emitting diodes with low efficiency roll-off at high brightness using iridium emitters based on 2-(4-trifluoromethyl-6-fluoro phenyl)pyridine and tetraphenylimidodiphosphinate derivatives [J].DyesPigm., 2014, 105:105-113.
[20] XU Q L, WANG C C, LI T Y,etal.. Syntheses, photoluminescence, and electroluminescence of a series of iridium complexes with trifluoromethyl-substituted 2-phenylpyridine as the main ligands and tetraphenylimidodiphosphinate as the ancillary ligand [J].Inorg.Chem., 2013, 52(9):4916-4925.
[21] KWON T H, CHO H S, KIM M K,etal.. Color tuning of cyclometalated iridium complexes through modification of phenylpyrazole derivatives and ancillary ligand based onabinitiocalculations [J].Organometallics, 2005, 24(7):1578-1585.
[22] SHEU J K, CHANG S J, KUO C H,etal.. White-light emission from near UV InGaN-GaN LED chip precoated with blue/green/red phosphors [J].IEEEPhoton.Technol.Lett., 2003, 15(1):18-20.
[23] ZHU Y C, ZHOU L, LI H Y,etal.. Highly efficient green and blue-green phosphorescent OLEDs based on iridium complexes with the tetraphenylimidodiphosphinate ligand [J].Adv.Mater., 2011, 23(35):4041-4046.
[24] WANG Z J, LIANG H B, ZHOU L Y,etal.. Luminescence of (Li0.333Na0.334K0.333)Eu(MoO4)2and its application in near UV InGaN-based light-emitting diode [J].Chem.Phys.Lett., 2005, 412(4-6):313-316.
