多糖对免疫系统调控的研究进展
2018-05-30汤小芳胡美华张贤益李文娟
汤小芳,刘 想,胡美华,张贤益,李文娟,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学医学院,江西南昌 330006;3.婺源县人民医院,江西上饶 333200)
多糖又称多聚糖,是一类广泛存在于动植物与微生物体内的生物信息大分子。对多糖的相关研究已有近70年的历史,尤其是近10年来,糖生物学成为了继基因组学、蛋白质组学之后的又一大研究热点与难点[1]。已有研究表明,多糖具有免疫调节、抗炎、抗肿瘤、降血糖、降血脂等多种生物活性,其中免疫调节作用是众多多糖类物质的最基本的作用[2]。免疫是机体的一种重要病理生理过程,
通过识别“自己”和“非己”并排除“非己”而实现对机体的保护作用。免疫防御、免疫稳定和免疫监视是机体免疫系统的三大主要功能。另外,过强或过弱的免疫应答均会对机体造成不同程度的损伤。免疫防御过强可引起机体的超敏反应如临床常见的支气管哮喘;免疫反应过弱或缺陷则可导致自身免疫缺陷相关疾病的产生如感染、恶性肿瘤及其临床预后不良[3]。因此,对免疫系统正常有效的免疫调控,是维护机体正常生命活动的关键。随着人们生活水平的不断提高和健康意识的不断增强,免疫调控剂在医疗与保健方面的重要作用受到越来越广泛的关注。大量研究证实多糖所具有的免疫调控作用大部分为食源性,对机体的毒副作用小,容易被大众接受,是较为理想的药物和保健食品基料[4]。为此,笔者将就多糖对免疫系统的免疫调控作用及机制综述如下。
1 多糖对免疫系统调控作用概述
机体免疫系统在受到抗原刺激后可产生免疫应答。同时,免疫系统又可感知体内免疫应答信息,通过调控免疫应答的类型、强度以及持续时间来维持有效的免疫防御[5]。免疫调控是指机体免疫系统在免疫应答过程中所做出的生理性反馈,通过调控免疫细胞与受体分子之间的协同或拮抗作用使免疫细胞处于活化或抑制状态,也可调控免疫系统与其他系统之间的相互作用,共同使免疫应答维持在适宜的强度和时限,以保证机体免疫功能的稳定[6]。
免疫系统是机体行使免疫功能的组织系统,可广泛参与机体的免疫应答过程。免疫系统包括免疫器官或组织、免疫细胞和免疫分子三大部分[7](表1)。多糖作为一种免疫调控剂,具有疗效好、毒性低等优点,并可通过多个途径作用于免疫系统,如刺激机体各种免疫活性细胞的分化和增殖;促进各种受体分子的表达;诱导白细胞介素(Interleukin,IL)、肿瘤坏死因子(Tumor necrosis factor,TNF)和干扰素(Interferon,IFN)等细胞因子的产生;促进抗体形成;激活补体系统活化途径等[8]。现代分子免疫学研究发现,通过摄入天然活性物质调控机体的免疫应答是最有希望替代和辅助抗生素治疗的免疫佐剂[9]。
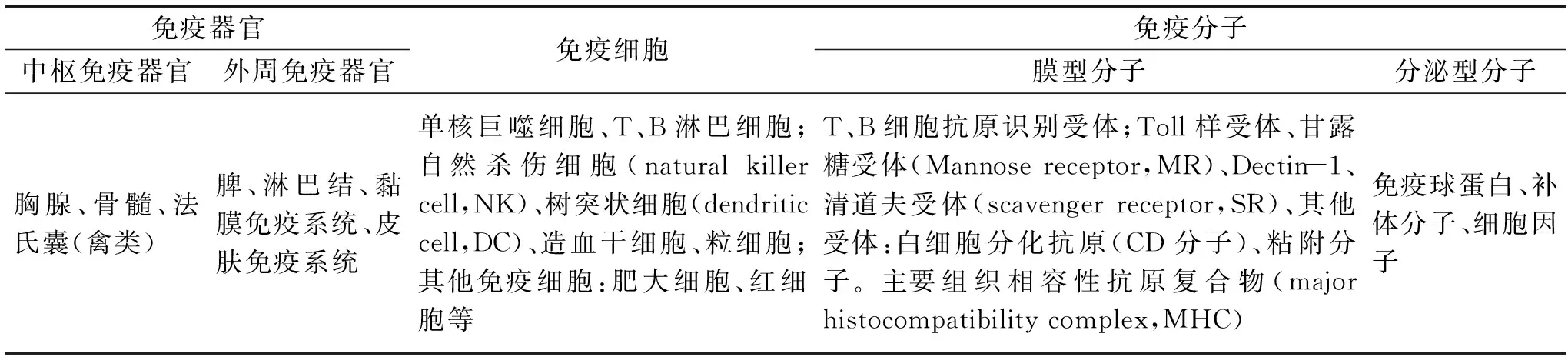
表1 免疫系统的组成Table 1 Components of the immune system
2 多糖对免疫器官的作用
免疫器官是免疫细胞发生、分化和增殖的场所,同时也是免疫应答发生的场所。机体免疫器官包括中枢和外周免疫器官。中枢免疫器官为胸腺和骨髓(禽类为法氏囊),其可调控外周免疫器官的发育。外周免疫器官包括指脾脏、淋巴结、咽扁桃体和肠集合淋巴结等,是免疫细胞定居以及免疫应答发生的部位。李文娟等[10]在探讨黑灵芝多糖对免疫抑制小鼠的免疫调控作用这一实验中发现,对环磷酰胺免疫抑制小鼠灌胃给予不同剂量黑灵芝多糖后,各剂量组小鼠脾脏指数呈剂量依赖性增加。实验结果表明黑灵芝多糖可改善环磷酰胺引起的小鼠脾脏指数下降,进而实现对小鼠免疫功能的调控。有研究表明黄芪多糖可通过增加免疫器官重量,提高脏器指数而增强免疫器官功能,并且黄芪多糖还可促进部分免疫器官的发育。安松兰等[11]通过给予免疫抑制模型小鼠不同剂量的黄芪多糖,来证实黄芪多糖可增加免疫抑制小鼠脾脏和胸腺的重量及其脏器指数,同时还发现黄芪多糖可促进鸡法氏囊和脾脏的发育。Chen等[12]发现蒲公英多糖可显著增加小鼠胸腺和脾脏的重量并促进胸腺和脾脏的生长。帅学宏等[13]发现山豆根多糖能极显著提高免疫抑制小鼠的脾脏指数,同时也可显著降低小鼠脾脏中髓过氧化物酶和胸腺中黄嘌呤氧化酶活性,增强胸腺谷胱甘肽过氧化物酶活性。
3 多糖对免疫细胞的作用
免疫细胞是指机体所有参与免疫应答或与免疫应答相关的细胞及其前体,主要组成有淋巴细胞、造血干细胞和抗原提呈细胞等,它们相互协调作用,共同参与机体的固有免疫和适应性免疫[14](图1)。同时,多糖对免疫细胞的调控具有重要作用。

图1 多糖对机体免疫细胞的作用机制Fig.1 Mechanisms of polysaccharides on immune cells
3.1 多糖对巨噬细胞的调控作用
巨噬细胞是一种重要的非特异性免疫效应细胞,主要具有免疫监视、免疫防御、免疫调控以及抗原呈递等免疫功能。另外,巨噬细胞还可参与到介导炎症反应、修复组织损伤和清除凋亡细胞等过程中[15]。被激活的巨噬细胞吞噬能力显著增强,既可直接吞噬杀死病原体也可以通过分泌炎性细胞因子和抗病原介质等间接杀伤病原体。因此,巨噬细胞能够有效防御由内源性或外源性病原体侵害而引起的组织炎症反应和损伤,成为机体防御病原微生物感染的第一道防线。动植物来源的多糖,对巨噬细胞的免疫调控作用主要表现为增强巨噬细胞的吞噬活性、诱导巨噬细胞的分化增殖和调控各种细胞因子及活性氧的产生等[16]。张晨晓等[17]发现泥鳅多糖可增强巨噬细胞分泌IL-6和TNF-α的能力,并促进一氧化氮合酶(iNOS)的mRNA表达水平,iNOS的提高进而诱导细胞产生NO。陈一晴等[18]研究发现茶叶多糖复合物与车前子多糖复合物均可促进小鼠巨噬细胞表面CD80、CD86和CD40类分子的表达,增强巨噬细胞的免疫吞噬功能,还可提高巨噬细胞对NO以及IL-lβ和TNF-α的分泌能力。张松连等[19]发现仙人掌多糖可有效改善免疫抑制小鼠的免疫功能,且各剂量仙人掌多糖均能显著增强免疫抑制小鼠巨噬细胞的吞噬功能。
3.2 多糖对淋巴细胞的作用
淋巴细胞是构成机体免疫系统的重要细胞类别,主要分布于外周免疫器官及血液中。根据淋巴细胞表型和功能特征可将其分为三类:T淋巴细胞、B淋巴细胞和NK细胞。T淋巴细胞和B淋巴细胞在接受抗原刺激后可发生特异性免疫应答,被称为抗原特异性淋巴细胞[20]。
3.2.1 多糖对T淋巴细胞的作用 T淋巴细胞虽来源于骨髓中的淋巴样干细胞,但主要在胸腺中发育成熟。在胸腺中,T淋巴细胞先后经过阳性选择和阴性选择而成为具有MHC限制性识别能力的成熟的T淋巴细胞,主要参与机体的体液免疫[21]。杨姗姗等[22]在观察半枝莲多糖对荷瘤小鼠T淋巴细胞影响的实验中,发现半枝莲多糖能呈剂量依耐性显著增加外周血T淋巴细胞数量,提高CD4+T细胞与CD8+T细胞比值,促进血清中IL-2和IFN的含量,从而维持机体免疫功能的稳态。冯燕玲等[23]发现茶多糖(TPS)可与刀豆蛋白A共同发挥协同作用,显著促进免疫抑制小鼠T淋巴细胞的体外增殖,此外TPS还可调控T淋巴细胞分化,显著提高CD3+和CD4+T淋巴细胞的百分率,提高CD4+与CD8+T淋巴细胞的比值,从而拮抗环磷酰胺引起的免疫抑制。
3.2.2 多糖对B淋巴细胞的作用 B淋巴细胞也由动物骨髓(禽类为法氏囊)的淋巴样干细胞分化发育而来。B淋巴细胞在骨髓中经过阳性和阴性选择过程后,可经血液循环途径分布到外周免疫器官中。在接受抗原刺激后可增殖分化为浆细胞并产生多种抗体,与抗原结合从而发挥其体液免疫功能[24]。王剑等[25]在川牛膝多糖的体外免疫活性研究中发现10~300 μg/mL的牛膝多糖可显著促进B淋巴细胞增殖,同时也可增强小鼠NK细胞和腹腔巨噬细胞的吞噬活性。Wu等[26]提取出冬虫夏草菌丝体中的多糖成分,观察其对免疫抑制小鼠抗卵清蛋白(OVA)抗体的免疫调控作用。实验结果表明,与OVA模型组相比,冬虫夏草多糖可显著提高血清抗OVA特异性抗体水平。
3.2.3 多糖对NK细胞的作用 NK细胞是一类来源于骨髓淋巴样干细胞的非特异性免疫细胞,具有直接杀伤靶细胞的作用。因其不表达T细胞抗原受体(TCP)、B细胞抗原受体(BCR)及其他特有标志,而被归为“第三类淋巴细胞”。NK细胞的杀伤作用无MHC限制性也不需要抗原预致敏,因此也是机体免疫防御系统的第一道防线[27]。刘彦平等[28]发现枸杞多糖可明显对抗环磷酰胺造成的小鼠NK细胞活性下降。邵树军等[29]连续10 d给予免疫低下小鼠腹腔注射牛膝多糖60 mg/(kg·d),发现其能显著增强小鼠NK细胞活性以及促进外周血中TNF-α的分泌。庹菁菁等[30]利用氢化可的松(HC)建立免疫抑制模型小鼠来观察总状蕨藻盾叶变种粗多糖对小鼠脾脏NK细胞的免疫调控作用。实验结果发现HC组小鼠脾脏NK细胞数量较正常组明显降低。而总状蕨藻盾叶变种多糖溶液经灌胃给予HC模型小鼠后可有效抑制HC造成的NK细胞数目下降,甚至可使NK细胞数目增加至明显超过正常水平。
3.3 多糖对树突状细胞的作用
树突状细胞(DC)起源于多能造血干细胞,是目前所知的抗原提呈能力最强的免疫细胞。DC虽不具备吞噬能力,但能够有效刺激T细胞活化,诱导适应性免疫。此外,树突状细胞表面还高度表达甘露糖受体、Toll样受体和补体受体等分子,可快速识别抗原,参与机体的固有免疫[31]。因此,树突状细胞是固有免疫和适应性免疫之间的重要桥梁和纽带,在免疫应答过程中发挥中心作用。组织中未成熟的树突状细胞在接受抗原刺激后可分化成熟,且有多个信号通路参与了其分化成熟过程,包括细胞内Ca2+通道、磷脂肌醇信号途径、NF-κB核转位和丝裂原活化蛋白激酶/细胞外信号调控激酶(MAPK/ERK)激活通路等[32]。成熟后的树突状细胞抗原提呈能力显著增强,并可高表达特征性标志CDllc、MHC-Ⅱ、CD80和CD86等共刺激分子及黏附分子,同时还可促进IL-12和TNF-α等细胞因子的分泌,参与调控免疫细胞的分化发育等[33]。彭颖[34]等研究发现菌物多糖能够刺激树突状细胞的成熟。其可能的机制是菌物多糖与树突状细胞表面的Toll样受体作用,引起树突状细胞胞内MAPKs的磷酸化,促进转录因子活化因子蛋白(AP-1)的磷酸化和核转位,使转录因子NF-κB向核内转移,调控核基因的转录和表达,从而发挥对树突状细胞的免疫调控作用。张元元[35]发现板蓝根多糖在0.4 μg/mL时能够显著刺激DC的增殖,促进DC形态和功能的成熟。通过体外诱导树突状细胞亚群还发现板蓝根多糖可促进DC1亚群Th1型细胞因子的分泌。
4 多糖对免疫分子的作用
作为重要的病原体相关分子模式(Pathogen associated molecular patterns,PAMP),多糖分子能够与位于细胞表面的各种模式识别受体(PRR)如Toll样受体(TLR)、甘露糖受体(MR)、Dectin-1和清道夫受体(SR)等相结合(图2)。PRRs是多糖发挥免疫调控作用的枢纽,其既可通过识别多糖并与之结合而引发一系列信号级联反应,也通过诱导免疫基因表达,激活免疫应答而发挥免疫调控作用[36]。因此,对PRRs的深入研究极大地促进了多糖对免疫系统调控作用机制方面的研究。此外,多糖还能够被MHCⅡ类分子呈递并被TCR直接或者间接识别,激活适应性细胞免疫应答。多糖类物质亦能够识别BCR,有效地激活B淋巴细胞,诱导特异性抗体的产生[37]。

图2 多糖对免疫细胞表面模式识别受体作用机制Fig.2 Mechanism of polysaccharide on immune cell pattern recognition receptor
4.1 多糖对Toll样受体的作用
Toll样受体(TLR)是一类普遍表达于天然免疫系统中的模式识别受体,属于I型跨膜糖蛋白受体,包括胞外区、跨膜区和胞质区三部分。TLR家族可通过胞外富亮氨酸重复序列识别不同病原体表面共有且进化高度保守的特定分子结构,然后经相应的接头蛋白途径进行信号传导,活化免疫细胞内相关的免疫基因,诱导免疫应答的产生[38]。TLR家族根据其表达位置的不同可分为位于细胞表面的TLR(TLR1、TLR2、TLR4、TLR5和TLR6等)和位于细胞内的TLR(TLR3、TLR7和TLR8等)[39]。TLR家族介导的信号转导通路也可根据接头蛋白的不同而分为髓样分化因子(MyD88)依赖性和非MyD88依赖性途径。多糖主要被免疫细胞表面的TLR2和TLR4识别并在CD14的辅助下共同将胞外信号转导至胞内,使NF-κB迅速从胞浆移位到核内,调控相应免疫基因的表达和mRNA的转录,介导相关细胞因子的分泌,发挥免疫调控作用[40]。张群[41]发现灵芝多糖对荷瘤小鼠脾淋巴细胞增殖的促进作用和对TNF-α和IFN-γ分泌的增强作用与其能激活TLR4有关;其机制可能是灵芝多糖通过与巨噬细胞表面的TLR4结合,再经P38/MAPK信号转导途径激活下游NF-κB,从而促进TNF-α的产生。许文等[42]研究了TLR4在猪苓多糖(PPS)对小鼠腹腔巨噬细胞活化过程中的作用,发现PPS可通过TLR4增强腹腔巨噬细胞分泌NO、IL-1β和TNF-α的能力并促进小鼠脾淋巴细胞增殖,因此推测TLR4可能是PPS作用于小鼠腹腔巨噬细胞的靶分子。
4.2 多糖对甘露糖受体的作用
甘露糖受体(MR)是一类C型凝集素样受体,属于钙依赖性I型跨膜糖蛋白受体。可识别和结合以D-甘露糖、L-岩藻糖和N-乙酰葡萄糖胺等糖残基为末端的糖类物质,是先天性免疫系统中重要的非Toll样模式识别受体和内吞受体[43]。MR主要存在于巨噬细胞和树突状细胞的细胞膜表面,在维持内环境稳态、有效识别病原体、诱导细胞因子产生和抗原呈递等过程中发挥重要作用。帅小雪[44]研究了黑灵芝多糖(PSG-1)的免疫调控作用与MR的关系以及在LPS刺激的巨噬细胞中MR对PSG-1激活的TLRs信号转导通路的影响。结果表明,PSG-1可上调正常小鼠腹腔巨噬细胞表面MR的表达;与PSG-1单独刺激组相比,甘露聚糖预处理则能明显抑制PSG-1增强的小鼠腹腔巨噬细胞的吞噬功能及诱导的IL-1β的分泌效应。在LPS刺激的小鼠腹腔巨噬细胞中,PSG-1对细胞的免疫调控作用除了有赖于MR的参与,尚会与巨噬细胞表面的其他模式识别受体发生作用。而PSG-1对LPS刺激的小鼠腹腔巨噬细胞的细胞核内NF-κB p65蛋白的表达可能受到TLR4和MR的共同调控。
4.3 多糖对Dectin-1的作用
Dectin-1也是一类C型凝集素样受体,属于Ⅱ型跨膜糖蛋白的非Toll样模式识别受体。Dectin-1结构与C型凝集素家族中的其他受体类似,主要由位于胞外段的C型凝集素样区域(CTLD)、跨膜结构域以及位于胞内段的免疫受体酪氨酸活化(ITAM)基序组成[45]。Dectin-1在β-葡聚糖介导的免疫调控以及抗真菌感染免疫中有着至关重要的作用,同时Dectin-1也可介导自身免疫疾病的产生。Dectin-1可通过识别多种不同的真菌,如酵母菌、念珠菌和肺囊虫等直接发挥其抗感染免疫。同时机体也可利用Dectin-1受体识别β-葡聚糖,通过胞内ITAM基序酪氨酸的磷酸化招募脾酪氨酸激酶(Syk)家族,通过胱天蛋白酶募集域蛋白(CARD9)通路激活下游NF-κB,从而诱导各种细胞免疫应答的产生,实现其免疫调控作用[46]。朱玮等[47]发现LPS处理过的孕鼠灌胃β-葡聚糖后可激活乳腺组织Dectin-1的表达,通过减少炎症因子的过度释放和降低炎性相关酶的活性,减轻炎症介质对乳腺组织的损伤。此外,β-葡聚糖单独处理可激活Dectin-1/Syk通路,LPS单独处理则激活TLR4/MyD88通路,而β-葡聚糖和LPS共同处理则表现为Dectin-1/Syk通路的激活和TLR4/MyD88通路的抑制。
4.4 多糖对补体系统的作用
补体系统是一类广泛存在于机体血清、组织液或细胞表面的经活化后具有酶活性的蛋白质。补体系统包括30余种可溶性蛋白和膜结合蛋白,根据其生物学功能不同又可将其分为三类:补体固有成分、补体调控蛋白和补体受体(Complement receptor,CR)。补体系统经活化具有精密的调控机制,且活化后的补体产物具有多种生物学功能如溶解细胞、调理吞噬、清除免疫复合物和介导炎症反应等[48]。补体蛋白上的识别点可有效识别多糖结构,因此多糖可经补体蛋白识别点有效调控补体活性。CR3是一种高度表达于免疫细胞表面的糖基化异源二聚体,可作为多种补体和β-葡聚糖等的受体。最新研究表明阻断CR3能显著降低中性粒细胞对β-葡聚糖的内吞作用并抑制β-葡聚糖诱导的活性氧的产生[49]。Ferreira[50]等发现β-葡聚糖与巨噬细胞表面CR3结合后,可激活PI3K和MAPK信号通路,促进炎症因子的生成,发挥其免疫调控作用。Yamada等[51]发现去除乙酰基的车前草种子多糖可显著激活补体系统。黄芪多糖、党参多糖和人参多糖虽然对正常豚鼠的补体活性无影响,但对于蛇毒因子处理的豚鼠可表现出显著改善蛇毒因子诱导的补体水平下降功能。
4.5 多糖对清道夫受体的作用
清道夫受体(SR)为一大类结构多样的跨膜糖蛋白,其主要分布在巨噬细胞、树突状细胞和血管上皮细胞等免疫细胞表面,可通过结合各种模式配体而促进非己成分和自身修饰后成分的清除[52]。清道夫受体在免疫应答过程中有两种角色:一是作为免疫系统中的模式识别受体,通过识别特异性的病原相关分子模式清除异物;二则通过识别损伤相关分子模式来清扫体内调亡细胞核碎片[53]。Nakamura等[54]首先发现了岩藻多糖能够剂量依赖性地促进小鼠腹腔巨噬细胞NO的分泌。其作用机制可能是岩藻多糖通过与巨噬细胞表面SR结合,激活p38MAPK通路和下游NF-κB,诱导iNOS启动子活化而促进NO的产生。此外,岩藻糖还可以通过与SR结合而活化人巨噬细胞,促进TNF-α和IL-12的释放。
5 神经-内分泌-免疫系统的相互调控
机体是一个有机的整体,免疫系统在发挥其功能时还可与其他系统相互作用,其中以神经和内分泌系统的作用最为主要。神经-内分泌-免疫(NEI)系统调控网络由神经递质、内分泌激素以及各种免疫细胞和免疫分子之间的相互作用而形成。研究证实,神经内分泌系统与免疫系统之间的相互作用存在着双向的信息传递过程[55]。一方面神经-内分泌系统所产生的神经递质和激素可与免疫细胞表面的相应受体结合,对免疫应答进行正向或负向调控。另一方面在神经-内分泌系统组织细胞表面可表达不同的细胞因子受体,免疫细胞产生的细胞因子可与相应受体结合而调控神经-内分泌系统[56]。如免疫细胞分泌的TNF-α可刺激下丘脑-垂体-肾上腺轴,促进皮质激素的合成,合成的皮质激素可负反馈抑制Th1细胞和巨噬细胞的活性,减少TNF-α的分泌量,下降的TNF-α可阻止肾上腺皮质激素合成,停止对免疫细胞的抑制,使TNF-α的分泌量增加[57]。
神经内分泌系统和免疫系统通过共有的化学信号分子和相关受体的复杂作用,使两个系统间或各个系统内的信号得以相互交通和调控,维持机体的稳态。当机体处于应激状态或内环境出现紊乱时,NEI中的某些环节可作出相应的反应和改变。孙耀贵等[58]发现中药制剂柴术抗激散作用于LPS刺激小鼠后,可通过下调海马去甲肾上腺素(NE)和5-羟色胺含量以及降低下丘脑β-内啡肽含量而抑制免疫系统对IL-6和NO的分泌。张永祥等[59]通过观察枸杞多糖在下丘脑神经核团分泌NE对脾脏功能的影响的作用,证实枸杞多糖可通过影响下丘脑神经核团的激素分泌水平而实现对脾脏功能的影响。由此说明,多糖的免疫调控作用除了可直接影响免疫系统内部的各环节之外,调控NEI网络也是一条重要的途径,因此,多糖的免疫调控作用具有多途径、多环节和多靶点的特性。
6 基于免疫调控的多糖的生物学活性
免疫调控可在一定程度上使机体的免疫应答处于平衡状态,为机体各种生命活动的正常进行提供保障。当机体免疫调控失去平衡,机体免疫应答受到影响引起免疫紊乱时则可导致免疫相关疾病的发生[60](图3)。例如Ⅰ型糖尿病患者体内可检测到谷氨酸脱羧酶抗体的异常上升,Ⅱ型糖尿病患者则表现为神经内分泌-免疫系统的调控紊乱[61]。系统性红斑狼疮(SLE)患者可表现出以CD8+T淋巴细胞异常增加为主的T淋巴细胞亚群活化紊乱,且患者随着病情加重,淋巴细胞亚群平衡紊乱更加明显[62]。外源性致病微生物的入侵可过度活化机体非特异性免疫系统,使其释放大量TNF-α和IL-1等促炎因子,诱导全身炎症反应综合征的产生,表明免疫紊乱可能是众多疾病发病环节中的一个重要因素[63]。

图3 免疫相关性疾病Fig.3 Immunity related disease
多糖如香菇多糖、灵芝多糖等均可作为生物应答调控剂,对免疫相关性疾病进行免疫治疗。免疫治疗是目前治疗免疫性疾病的一条重要途径,当机体免疫应答程度过高或低下时,生物活性多糖可启动免疫监视或机体内部自稳机制,将免疫系统调整至正常状态,特别是对免疫功能低下者具有免疫促进的生物学活性[64]。灵芝多糖对小鼠特异性免疫(细胞免疫和体液免疫)和非特异性免疫有明显的促进作用,并对由环磷酰胺所致体液免疫功能降低和胸腺重量减少具有显著的改善作用[65]。香菇多糖注射液在临床上可作为辅助药物在肿瘤病人经过放疗或化疗后机体免疫力受损的情况下,与放化疗配合共同增强肿瘤患者免疫力,提高患者的生存质量[66]。从酵母中提取的β-葡聚糖可通过诱导树突细胞对细胞因子IL-10、TGF-β1和IL-2的分泌而调控Ⅰ型糖尿病模型小鼠的自身免疫状况[67]。冬虫夏草的多糖提取物可通过调控NF-κB的活性,抑制膜性肾小球肾炎对大鼠的氧化损伤并降低相关炎症细胞因子的释放水平[68]。黄芪多糖可增加淋巴组织中的Th细胞百分比,降低Treg细胞的百分比,并抑制血清中CD4+T细胞向Th2型反应的极化,从而改善脓毒症小鼠的状况[69]。
7 结论
综上所述,多糖对机体免疫系统的调控作用具有多靶点和普遍存在于特异性及非特异性免疫激活过程的各个环节的特点,大量基础研究和临床实验证实,多糖不仅可以激活 T 淋巴细胞、B 淋巴细胞、巨噬细胞、自然杀伤(NK)细胞等多种免疫细胞,而且可以活化补体系统,有效促进IL-1、IL-2、IL-6,TNF等细胞因子的分泌和表达。多糖的免疫调控机制主要是通过靶向作用于免疫细胞表面 Toll 样受体、甘露糖受体、Dectin-1、补体受体 以及清道夫受体等受体分子,激活 MAPK、NF-κB 等下游信号通路,促进 NO、TNF-α、IL-1β、IL-6、IL-10 及 IFN-γ等细胞因子的分泌表达,进而调控免疫系统发挥免疫调控活性。
[1]江萍. 食品多糖与机体免疫[J]. 食品工业科技,1997(2):85-86.
[2]Wang J,Ge B,Li Z,et al. Structural analysis and immunoregulation activity comparison of five polysaccharides from Angelica sinensis[J]. Carbohydrate polymers,2016,140:6-12.
[3]Botelho D J,Leo B F,Massa C B,et al. Low-dose AgNPs reduce lung mechanical function and innate immune defense in the absence of cellular toxicity[J]. Nanotoxicology,2016,10(1):118-127.
[4]Razali F N,Sinniah S K,Hussin H,et al. Tumor suppression effect of Solanum nigrum polysaccharide fraction on Breast cancer via immunomodulation[J]. International Journal of Biological Macromolecules,2016,92:185-193.
[5]Brodin P,Davis M M. Human immune system variation[J]. Nature Reviews Immunology,2017,17(1):21-29.
[6]汪鹤,洪胜,潘利华,等. 超声波对密花石斛多糖理化性质及免疫调节活性的影响[J]. 食品工业科技,2014,9:121-124.
[7]Iwasaki A,Medzhitov R. Control of adaptive immunity by the innate immune system[J]. Nature Immunology,2015,16(4):343-353.
[8]Liu J,Feng C,Li X,et al. Immunomodulatory and antioxidative activity of Cordyceps militaris polysaccharides in mice[J]. InternationalJournal of Biological Macromolecules,2016,86:594-598.
[9]Kao C,Jesuthasan A C,Bishop K S,et al. Anti-cancer activities of Ganoderma lucidum:active ingredients and pathways[J]. Functional Foods in Health and Disease,2013,3(2):48-65.
[10]李文娟,聂少平,余强,等. 黑灵芝多糖对免疫抑制小鼠的免疫调节作用[J]. 食品科学,2009(19):297-299.
[11]安松兰,张善玉,朴惠顺. 1 年生黄芪中黄芪多糖对小鼠免疫器官指数的影响[J]. 延边大学医学学报,2007,30(1):20-22.
[12]Chen F,Chen W,Hao Y. Effect of Taraxacum Polysaccharides on Immune Organs in Mice[J]. Progress in Veterinary Medicine,2008,4:4.
[13]帅学宏,胡庭俊,曾芸,等. 山豆根多糖对免疫抑制模型小鼠免疫器官指数和自由基相关酶活性的影响[J]. 南京农业大学学报,2009,32(2):170-172.
[14]Macauley M S,Crocker P R,Paulson J C. Siglec-mediated regulation of immune cell function in disease[J]. Nature Reviews Immunology,2014,14(10):653-666.
[15]Ginhoux F,Guilliams M,Naik S H. Dendritic cell and macrophage nomenclature and classification[J]. Frontiers in Immunology,2016,7.
[16]Lam J,Takeshita S,Barker J E,et al. TNF-αinduces osteoclastogenesis by direct stimulation of macrophages exposed to permissive levels of RANK ligand[J]. Journal of Clinical Investigation,2000,106(12):1481.
[17]张晨晓. 泥鳅多糖的免疫调控和抗肿瘤作用机理[D]. 武汉:华中科技大学,2005.
[18]陈一晴. 茶叶与车前子多糖复合物活化巨噬细胞功能的研究[D]. 南昌:南昌大学,2010.
[19]张松莲. 仙人掌多糖免疫调控作用的研究[D]. 长沙:湖南农业大学,2007.
[20]Bhat T,Teli S,Rijal J,et al. Neutrophil to lymphocyte ratio and cardiovascular diseases:a review[J]. Expert Review of Cardiovascular Therapy,2013,11(1):55-59.
[21]计慧琴,王丙云,陈志胜,等. T 细胞的发育分化及胸腺激素的作用[J]. 动物医学进展,2005,26(4):47-50.
[22]杨姗姗,张秀娟. 半枝莲多糖对荷瘤小鼠T细胞免疫功能的影响[J]. 河南农业科学,2014,43(6):145-148.
[23]冯燕玲. 茶多糖对免疫抑制小鼠腹腔巨噬细胞与脾淋巴细胞免疫功能的影响[D]. 南昌:南昌大学,2015.
[24]Cassady J P,D’Alessio A C,Sarkar S,et al. Direct lineage conversion of adult mouse liver cells and B lymphocytes to neural stem cells[J]. Stem Cell Reports,2014,3(6):948-956.
[25]王剑,蒲蔷,何开泽,等. 川牛膝多糖的体外免疫活性研究[J]. 应用与环境生物学报,2008,14(4):481-483.
[26]Wu Y,Sun H,Qin F,et al. Effect of various extracts and a polysaccharide from the edible mycelia of Cordyceps sinensis on cellular and humoral immune response against ovalbumin in mice[J]. Phytotherapy Research,2006,20(8):646-652.
[27]Dolovcak S,Hartog N L,Ballas Z K. Natural Killer(NK)Cell Deficiency:Clinical Phenotypes in Presence or Absence of Antibody Deficiency[J]. Journal of Allergy and Clinical Immunology,2016,137(2):AB223.
[28]刘彦平,李积东. 枸杞多糖对小鼠 NK 细胞和白细胞活性的免疫调节作用[J]. 青海医学院学报,2001,22(1):1-2.
[29]邵树军,买玲,陈瑛. 牛膝多糖对小鼠红细胞免疫功能的影响[J]. 中国药物与临床,2002,2(5):281-282.
[30]庹菁菁. 总状蕨藻盾叶变种多糖及其硒化物对小鼠T细胞和NK细胞的调控[D]. 广州:暨南大学,2007.
[31]Pearce E J,Everts B. Dendritic cell metabolism[J]. Nature Reviews Immunology,2015,15(1):18-29.
[32]Rescigno M,Martino M,Sutherland C L,et al. Dendritic cell survival and maturation are regulated by different signaling pathways[J]. Journal of Experimental Medicine,1998,188(11):2175-2180.
[33]Katakam A K,Brightbill H,Franci C,et al. Dendritic cells require NIK for CD40-dependent cross-priming of CD8+T cells[J]. Proceedings of the National Academy of Sciences,2015,112(47):14664-14669.
[34]彭颖,李宗军. 菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路[J]. 食品科学,2012,33(15):318-323.
[35]张元元. 板蓝根多糖对体外小鼠骨髓衍生的树突状细胞亚群形态及功能的影响[D]. 郑州:河南农业大学,2013.
[36]帅小雪,李文娟,刘丹凤,等. 黑灵芝多糖对小鼠腹腔巨噬细胞甘露糖受体的影响[J]. 食品科学,2014(23):262-267.
[37]戴慧,高晓明. 多糖特异性免疫识别的分子机制及其免疫生物学意义[J]. 中国免疫学杂志,2009,25(1):35-39.
[38]洪丽莉,孔倩颖,韦曦. Toll样受体介导的细胞内信号通路及其免疫调控功能[J]. 国际口腔医学杂志,2013,40(1):76-79.
[39]Agrawal S,Kandimalla E R. Synthetic agonists of Toll-like receptors 7,8 and 9[J]. 2007,35(6):1461-1467.
[40]Yue L,Wang W,Wang Y,et al. Bletilla striata polysaccharide inhibits angiotensin II-induced ROS and inflammation via NOX4 and TLR2 pathways[J]. International Journal of Biological Macromolecules,2016,89:376-388.
[41]张群. 灵芝多糖抗肿瘤作用的免疫分子机制研究[D]. 广州:第一军医大学,2006.
[42]许文,李心群. 猪苓多糖通过Toll样受体4对小鼠腹腔巨噬细胞的活化作用[J]. 中国药理学与毒理学杂志,2010,24(4):266-273.
[43]Azad A K,Rajaram M V S,Schlesinger L S. Exploitation of the macrophage mannose receptor(CD206)in infectious disease diagnostics and therapeutics[J]. Journal of Cytology & Molecular Biology,2014,1(1).
[44]帅小雪. 基于甘露糖受体的黑灵芝多糖免疫调控作用及机制研究[D]. 南昌:南昌大学,2015.
[45]Masuda Y,Inoue H,Ohta H,et al. Oral administration of solubleβ-glucans extracted from Grifola frondosa induces systemic antitumor immune response and decreases immunosuppression in tumor-bearing mice[J]. International Journal of Cancer,2013,133(1):108-119.
[46]祝贺,吕雪莲,杨蓉娅. Dectin-1 与真菌β-葡聚糖介导的天然免疫[J]. 实用皮肤病学杂志,2015,8(4):277-279.
[47]朱玮.β-葡聚糖增强大鼠乳腺上皮细胞的自主防御及其机制研究[D]. 南京:南京农业大学,2011.
[48]宁昌,陈文伟,黎燕,等. 补体系统与肿瘤的关系研究进展[J]. 国际药学研究杂志,2014,41(5):516-521.
[49]Baert K,Sonck E,Goddeeris B M,et al. Cell type-specific differences inβ-glucan recognition and signalling in porcine innate immune cells[J]. Developmental & Comparative Immunology,2015,48(1):192-203.
[50]Ferreira S S,Passos C P,Madureira P,et al. Structure-function relationships of immunostimulatory polysaccharides:A review[J]. Carbohydrate polymers,2015,132:378-396.
[51]Yamada H,Ohtani K,Kiyohara H,et al. Purification and chemical properties of anti-complementary polysaccharide from the leaves of Artemisia princeps[J]. Planta Medica,1985,51(2):121-125.
[52]Yuba E,Yamaguchi A,Yoshizaki Y,et al. Bioactive polysaccharide-based pH-sensitive polymers for cytoplasmic delivery of antigen and activation of antigen-specific immunity[J]. Biomaterials,2017,120:32-45.
[53]Means T K. Fungal pathogen recognition by scavenger receptors in nematodes and mammals[J]. Virulence,2010,1(1):37-41.
[54]Nakamura T,Suzuki H,Wada Y,et al. Fucoidan induces nitric oxide production via p38 mitogen-activated protein kinase and NF-κB-dependent signaling pathways through macrophage scavenger receptors[J]. Biochemical and Biophysical Research Communications,2006,343(1):286-294.
[55]Zhao Q,Pan L,Ren Q,et al. Effect of salinity on regulation mechanism of neuroendocrine-immunoregulatory network in Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2016,49:396-406.
[56]牛文民,牛晓梅,雷政权,等. 针灸足三里穴对神经内分泌免疫网络系统的影响[J]. 陕西中医学院学报,2014,37(2):101-103.
[57]Sun W,Meng K,Qi C,et al. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohydrate Polymers,2015,126:91-96.
[58]孙耀贵,程佳,李宏全,等. 柴术抗激颗粒对 LPS 诱导大鼠神经-内分泌-免疫相关因子调节机制研究[J]. 中国农业科学,2014,47(23):4718-4725.
[59]张永祥. 枸杞多糖对神经内分泌免疫调控网络的调控作用[M]. 北京:军事医学科学出版社,1996.
[60]Liu J Z,Hov J R,Folseraas T,et al. Dense genotyping of immune-related disease regions identifies nine new risk loci for primary sclerosing cholangitis[J]. Nature Genetics,2013,45(6):670-675.
[61]金萍,周智广,莫朝晖,等. 谷氨酸脱羧酶抗体阳性的1型糖尿病患者易合并甲状腺自身免疫紊乱[J]. 中国糖尿病杂志,2007,15(9):519-521.
[62]蔡蓓. 自身免疫病患者T细胞表面共刺激信号分子表达异常与免疫功能紊乱的研究[D]. 成都:四川大学,2005.
[63]McKenzie A N J,Spits H,Eberl G. Innate lymphoid cells in inflammation and immunity[J]. Immunity,2014,41(3):366-374.
[64]Kikuchi H,Hoshikawa T,Kurata S,et al. Design and Synthesis of Structure-Simplified Derivatives of Gonytolide for the Promotion of Innate Immune Responses[J]. Journal of Natural Products,2016,79(5):1259-1266.
[65]黄生权,潘华新,周联. 两种灵芝多糖对小鼠免疫功能增强作用研[J]. 食品工业科技,2012,33(3):355-357.
[66]王彦硕,黄叶梅,刘红梅,等. 香菇多糖抗肿瘤作用机理分析及临床应用探讨[J]. 医药卫生(文摘版),2016(5):221.
[67]Karumuthil-Melethil S,Gudi R,Johnson B M,et al. Fungalβ-glucan,a Dectin-1 ligand,promotes protection from type 1 diabetes by inducing regulatory innate immune response[J]. The Journal of Immunology,2014,193(7):3308-3321.
[68]Song J,Wang Y,Liu C,et al. Cordyceps militaris fruit body extract ameliorates membranous glomerulonephritis by attenuating oxidative stress and renal inflammation via the NF-κB pathway[J]. Food & Function,2016,7(4):2006-2015.
[69]Hou Y C,Wu J M,Wang M Y,et al. Modulatory effects of Astragalus polysaccharides on T-cell polarization in mice with polymicrobial sepsis[J]. Mediators of Inflammation,2015(6):1-10.
