芋头淀粉纳米颗粒的 制备及其表征
2018-05-30余振宇姜绍通
彭 晔,余振宇,郑 志,姜绍通
(合肥工业大学食品科学与工程学院,合肥工业大学农产品加工研究院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
近年来,纳米材料因其粒径小、比表面积大、强度高等优点成为人们研究的热点。淀粉纳米颗粒是由天然淀粉经过物理、化学或生物的方法处理后得到的粒度在纳米量级的微粒,其广泛的来源、良好的生物降解性和相容性、可再生性和纳米效应等优点,在新型材料研发、制药、食品加工、污水处理等方面有着重要的应用价值。
制备淀粉纳米颗粒的方法有很多,主要有酸水解法、沉淀法、机械法、微乳液法和细乳液法[1]。酸水解法[2]是通过无机酸水解淀粉的无定形区来制备淀粉纳米颗粒的,反应时间长,且反应在酸的体系中进行,污染环境。沉淀法[3]制备淀粉纳米颗粒是向完全溶解的淀粉溶液中滴加沉淀剂,析出纳米级的淀粉微粒,得到的淀粉纳米颗粒的形态、结构和大小难以控制。球磨法[4]、超声法[5]、高压均质法[6]等机械方法是在机械力的作用下将淀粉颗粒破碎到纳米量级,对设备要求高,能耗较大。微乳液法[7]制备淀粉纳米颗粒的关键在油水相体积比、淀粉乳浓度、搅拌速度,大量乳化剂的使用使其成本偏高。细乳液法[8]是向分散体系输入很高的能量,克服乳液的内聚能和表面能,使分散相成亚微米级的微粒。综上所述,这些方法制备的淀粉纳米颗粒虽然粒度都达到了纳米级别,但存在制备时间长、污染环境、产率过低、能耗较大等缺陷。酶解回生法[9]制备淀粉纳米颗粒是一种简单、绿色、产量高的新方法:将淀粉经普鲁兰酶水解淀粉分支点中的α-1,6糖苷键,脱去支链得到直链淀粉,在低温条件下回生重结晶得到淀粉纳米颗粒。巩敏[10]对黄米淀粉进行改性,研究了不同回生时间对黄米淀粉纳米颗粒的影响。代蕾[11]研究了淀粉乳浓度对芋头淀粉纳米颗粒的影响,但不同酶解时间对芋头淀粉纳米颗粒的影响却未曾报道。
本文以芋头淀粉为原料经普鲁兰酶脱支不同时间(4、6、8和10 h),并在4 ℃回生24 h制备芋头淀粉纳米颗粒。利用Zeta电位仪、FTIR、DSC、XRD、SEM等现代分析技术对淀粉的结构特征和形貌特征进行了研究,分析了不同的酶解时间的淀粉纳米颗粒和原淀粉的性质差异,为芋头淀粉纳米颗粒的制备和应用提供了参考依据。
1 材料与方法
1.1 材料与仪器
芋头 合肥新都会家乐福超市;碱性蛋白酶(200000 U/g) 北京索莱宝科技有限公司;普鲁兰酶(400 PUN/毫升) 诺维信(中国)生物技术有限公司;氢氧化钠、盐酸、柠檬酸、磷酸氢二钠等 均为分析纯。
FK-A组织捣碎机 金坛市城西峥嵘实验仪器厂;JMS-50C胶体磨 廊坊市廊通机械有限公司;CR22GⅡ超速冷冻离心机 日本Hitachi公司;FD-1A-50型冷冻干燥机 北京博医康实验仪器有限公司;SU8020场发射扫描电子显微镜 日立(Hitachi)公司;Nano-ZS90 Zeta电位仪 英国Malvern公司;Nicolet 67傅里叶红外光谱仪 美国Thermo Nicolet公司;Q200差示扫描量热仪 美国TA公司;D/MAX2500V型X射线衍射仪 日本理学制造。
1.2 实验方法
1.2.1 芋头淀粉的提取 取新鲜芋头500 g去皮洗净切丝,加入4倍体积的蒸馏水,打浆过3次胶体磨,将芋头浆置于41 ℃恒温水浴锅中,用氢氧化钠调节pH为10.0,加入0.9%的碱性蛋白酶,反应137 min后,过滤2次,收集滤液。反应过程中用0.1 mol/L盐酸和0.1 mol/L氢氧化钠维持pH在10左右。将收集的滤液3000 r/min离心15 min,将离心得到的沉淀用蒸馏水洗涤,然后用0.1 mol/L盐酸中和至pH为7,再次3000 r/min离心15 min洗涤2次。将淀粉匀浆置于-60 ℃冷冻干燥机中干燥24 h,即得芋头淀粉[12]。
1.2.2 淀粉纳米颗粒的制备 称取10 g芋头淀粉,以 pH=5.0的柠檬酸-磷酸氢二钠缓冲液为溶剂,配制10%的芋头淀粉浆(m/v),沸水浴加热30 min且不断搅拌,充分糊化淀粉。淀粉溶液冷却至室温后,加入普鲁兰酶溶液,添加量为4 PUN/g淀粉,然后58 ℃条件下分别酶解脱支4、6、8和10 h,反应结束后100 ℃灭酶30 min,再以3000 r/min离心15 min除去沉淀。将上清液置于4 ℃冰箱中放置24 h,通过脱支的淀粉短直链的回生来制备芋头淀粉纳米颗粒。酶解回生得到的淀粉纳米颗粒用蒸馏水洗涤至中性,然后-60 ℃冷冻干燥24 h,即可得到不同的酶解时间下制备的淀粉纳米颗粒[13]。
1.2.3 粒径测定 芋头原淀粉和淀粉纳米颗粒的平均粒径和粒径分布通过Zeta电位仪测定,散射光的强度在入射光束的90°处被检测到,测量样品用去离子水稀释,样品的浓度为0.01%(m/V),在25 ℃进行分析,分散剂和样品的折光度分别为1.33和1.6。利用Zeta电位仪配备的软件得到了粒径分布图,粒径大小比例为与探测器观察到的光强度的函数[14]。
1.2.4 傅里叶红外吸收光谱分析 采用 KBr 压片法。具体过程为:在红外灯的照射下,取1~2 mg干燥样品,与干燥的KBr粉末混合,置于玛瑙研钵中充分研磨,将研磨好的混合物粉末放入压模中,在15~20 kPa的压力下压制成透明薄片,然后将压片放入红外光谱仪进行测试,在4000~400 cm-1波长范围内,扫描32次取平均值[15]。
1.2.5 差示扫描量热仪分析 用电子天平称取3 mg淀粉到坩埚中,加入9 μL蒸馏水混合均匀,将坩埚密封,在室温下平衡2 h,以空坩埚作为对照,通氮气(50 mL/min),扫描温度范围25~120 ℃,扫描速度为5 ℃/min。利用TA通用分析软件计算起始温度(TO),峰值温度(TP)、终止温度(TC),糊化焓变(ΔH)[16]。
1.2.6 X射线衍射分析 采用X射线衍射分析仪测定。测定条件为:Cu Kα辐射,管压40 kV,管流30 mA,扫描速度4 °/min,扫描范围2Y:4~40°,步长0.028,接受狭缝0.2 mm,通过软件MDI Jade 5.0计算结晶度[17]。
1.2.7 扫描电镜观察 将双面胶粘在载物板上,用牙签取适量样品于双面胶上,并吹去未粘住的粉末,然后在真空镀金30 min,将镀好金膜的淀粉样品用扫描电子显微镜观察,加速电压为5 kV,拍摄具有代表性的不同放大倍数下的淀粉颗粒形貌,用来反映原淀粉以及淀粉纳米颗粒的形貌学变化情况[18]。
1.2.8 数据分析 每组实验进行三组平行实验,采用Excel 2013 进行数据整理分析,采用t检验进行显著性分析,显著性水平p<0.05有统计学意义,采用Origin 9.0软件作图。
2 结果与分析
2.1 粒径分布
图1是芋头原淀粉和不同酶解时间制备的淀粉纳米颗粒的平均粒径图和粒径分布图。由平均粒径图(A)可以看出,淀粉纳米颗粒的平均粒径会随着酶解时间的增大先减小后增大,且均远小于芋头原淀粉的粒径,酶解4、6、8和10 h制备的淀粉纳米颗粒的平均粒径分别为354.7、235.4、274.6和400.9 nm。粒径分布图(B)中不同酶解时间的淀粉纳米颗粒都只有一个峰,而且可以看出酶解6 h的粒径分布图主要在低粒径区域,主要分布在190~250 nm;酶解4 h和8 h的粒径分布图较酶解6 h向高粒径方向移动,主要分布在295~395 nm和255~295 nm;酶解10 h的分布图集中在较高粒径区,主要分布在295~450 nm。而芋头原淀粉的粒径分布在1000~2500 nm,芋头淀粉纳米颗粒显著减小。根据Fredrikssona[19]的研究,酶解脱支时间的不同使淀粉分子中的直链和支链的比例也不一样,进而影响双螺旋结构的形成与结晶,也就造成了不同酶解时间制备的淀粉纳米颗粒粒径的差异。
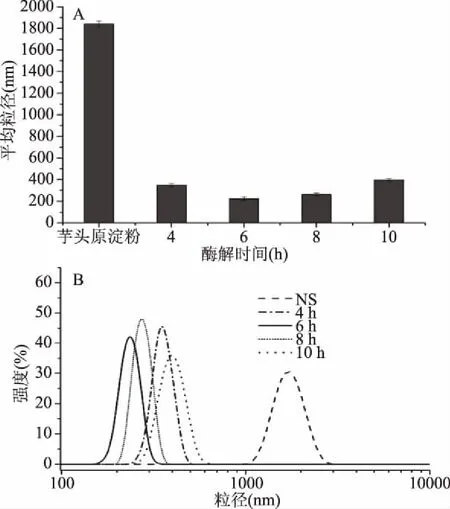
图1 芋头原淀粉和淀粉纳米颗粒的平均粒径图(A)和粒径分布图(B)Fig.1 Mean size(A)and particle size distribution(B)of taro starch and starch nanoparticles
2.2 傅里叶红外吸收光谱分析
图2是芋头原淀粉和淀粉纳米颗粒的红外吸收光谱图。在波长3000~3800 cm-1的范围内有很强的伸缩振动峰,这是O-H的特征峰,酶解回生得到的淀粉纳米颗粒在此处的吸收峰都向低波数方向移动,分别从原淀粉的3410 cm-1移动到3394,3375,3340和3363 cm-1,说明酶解回生增强了分子间的相互作用力[20]。在2838 cm-1处是C-H的不对称伸缩振动峰,峰的减弱表明α-1,6-糖苷键被普鲁兰酶水解了,增加了亚甲基的数量[21]。820 cm-1到1280 cm-1是红外吸收光谱的指纹区[22],这个区域的吸收峰主要是由高度耦合的C-O和C-C伸缩振动峰引起的。在960 cm-1处的峰是α-1,4-糖苷键中C-O-C的振动吸收峰,酶解回生得到的淀粉纳米颗粒中C-O-C基团的吸收峰分别从原淀粉的960 cm-1移动到951,945,943和937 cm-1,这说明分子链间的氢键作用力有所增强。

图2 芋头原淀粉和淀粉纳米颗粒的傅里叶红外光谱图Fig.2 Fourier infrared spectrogram of taro starch and starch nanoparticles
2.3 热特性分析
图3和表1展示的是芋头原淀粉和淀粉纳米颗粒的热特性。从图3可以看出芋头原淀粉有一个明显的峰,而芋头淀粉纳米颗粒则都是一个平缓的峰,并且芋头淀粉纳米颗粒的糊化温度明显低于芋头原淀粉。表1列出了芋头原淀粉和芋头淀粉纳米颗粒的起始糊化温度(To)、峰值糊化温度(Tp)、终止糊化温度(Tc)、糊化温度范围(Tc-To)和吸热焓(ΔH)。芋头淀粉纳米颗粒的To,Tp,Tc值与原淀粉相比明显降低,这说明酶解回生破坏了淀粉的结晶区和无定型区的双螺旋结构[23]。而糊化温度范围(Tc-To)相对于原淀粉增大,较宽的糊化温度范围表明酶解回生可能影响到了结晶区的糊化和无定形区的改变[24]。芋头原淀粉的ΔH为13.19 J/g,酶解4、6、8和10 h的淀粉纳米颗粒ΔH分别为5.31、6.79、5.99和6.46 J/g,ΔH可以反映出双螺旋的含量和结晶的有序性[25],与原淀粉相比淀粉纳米颗粒的ΔH都降低了,表明淀粉纳米颗粒的双螺旋含量和结晶有序性降低;随着酶解时间的增大,ΔH越来越大,说明双螺旋含量增加并且结晶有序性提高。

表1 芋头原淀粉和淀粉纳米颗粒的热特性分析Table 1 Thermal properties of taro starch and starch nanoparticles

图3 芋头原淀粉和淀粉纳米颗粒的热特性曲线图Fig.3 Thermal characteristics of taro starch and starch nanoparticles
2.4 X衍射分析
图4是芋头原淀粉和淀粉纳米颗粒的X射线衍射图。根据X射线衍射峰的强度可以判断固体颗粒的晶体结构,芋头原淀粉在衍射角2θ为15.04°、17.2°、18°、22.9°附近时有强衍射峰,表明芋头淀粉的晶型为A型[26]。酶解不同时间的芋头淀粉纳米颗粒在衍射角2θ为17.23°和22.67°有强衍射峰,属于V型淀粉晶体结构[27],这表明芋头原淀粉在制备淀粉纳米颗粒的过程中晶型被破坏,产生了新的晶体结构。酶解4、6、8和10 h在4 ℃回生制备的淀粉纳米颗粒的结晶度分别为29.58%、21.02%、20.44%和16.14%,相对于芋头原淀粉(35.7%)都有所降低,淀粉的重结晶是一个复杂的过程,结晶尺寸、支链淀粉的长度和含量、双螺旋相互作用以及双螺旋结构在结晶域中的取向等因素都会影响结晶度的差异[28]。酶解脱支时间不同,支链淀粉含量不同,淀粉的组成和性质就不同,进而造成了结晶度的不同。

图4 芋头原淀粉和淀粉纳米颗粒的X射线衍射图Fig.4 X ray diffractogram of taro starch and starch nanoparticles
2.5 淀粉纳米颗粒的形貌特征
图5是芋头原淀粉和淀粉纳米颗粒的扫描电镜图。从图中可以看出芋头原淀粉颗粒为多面体或近球形,表面结构光滑,完整,无裂痕,粒径大约在1~2 μm左右。用酶解回生法制备的芋头淀粉纳米颗粒为多边形或球形,粒径在200~400 nm左右,颗粒粒径明显比原淀粉小,比表面积显著增大,对于与其他物料混合使用配比方面有了很大提升。由于在4 ℃这种低温条件下回生,酶解得到的短直链淀粉分子热运动慢,短直链淀粉分子在纳米颗粒晶核表面堆叠速度慢,且堆叠不定向,形成的颗粒容易黏连,造成了一定的聚集现象[29]。

图5 芋头原淀粉(A)和淀粉纳米颗粒(B)的扫描电镜图Fig.5 Scanning electron micrograph of taro starch(A)and starch nanoparticles(B)
3 结论
本文用普鲁兰酶将芋头淀粉酶解脱支不同时间,在4 ℃低温条件下回生制备淀粉纳米颗粒。酶解4、6、8和10 h后回生得到的淀粉纳米颗粒的平均粒径分别为354.7、235.4、274.6和400.9 nm,粒径较芋头原淀粉明显减小。傅里叶红外光谱显示芋头淀粉纳米颗粒没有出现新的特征峰,但分子间作用力和氢键作用都有所增强。与芋头原淀粉比较,淀粉纳米颗粒的To,Tp,Tc,ΔH值降低,糊化温度范围(Tc-To)增大,表明淀粉纳米颗粒的无定形区、双螺旋含量和结晶有序性都发生了变化。所有淀粉纳米颗粒的晶型由A型变为V型,相对结晶度明显降低。芋头淀粉纳米颗粒的颗粒形貌为多边形或球形,比表面积增大,对于与其他物料混合使用配比方面有了很大提升。
[1]李秉正,潘丽霞,黎演明. 淀粉纳米粒的制备方法及应用研究概述[J]. 广西科学院学报,2013,29(2):103-107.
[2]Angellier H,Choisnard L,Molinaboisseau S,et al. Optimization of the preparation of aqueous suspensions of waxy maize starch nanocrystals using a response surface methodology[J]. Biomacromolecules,2004,5(4):1545-1551.
[3]Chin S F,Pang S C,Tay S H. Size controlled synthesis of starch nanoparticles by a simple nanoprecipitation method[J]. Carbohydrate Polymers,2011,86(4):1817-1819.
[4]史俊丽.超微细化大米淀粉的制备和性质研究[D].武汉:华中农业大学,2005.
[5]Bel H S,Magnin A,Pétrier C,et al.Starch nanoparticles formation via high power ultrasonication[J]. Carbohydrate Polymers,2013,92(2):1625-1632.
[6]涂宗财,任维,刘成梅,等.纳米级大米淀粉的制备及性质[J]. 农业工程学报,2008,24(1):250-253.
[7]张洪斌,姚日生,何葆芳,等. W/O型微乳法制备淀粉基纳米粒[J]. 应用化学,2004,21(10):1034-1037.
[8]Dziechciarek Y,Soest J J G V,Philipse A P. Preparation and Properties of Starch-Based Colloidal Microgels[J]. Journal of Colloid & Interface Science,2002,246(1):48-59.
[9]Sun Q,Li G,Dai L,et al. Green preparation and characterisation of waxy maize starch nanoparticles through enzymolysis and recrystallisation[J]. Food Chemistry,2014,162(11):223-228.
[10]巩敏. 黄米的干热改性及淀粉纳米颗粒制备研究[D]. 青岛:青岛农业大学,2014.
[11]代蕾. 芋头淀粉纳米颗粒的性质、改性及其在淀粉膜中的应用[D].青岛:青岛农业大学,2014.
[12]姜绍通,殷嘉忆,王华林,等.响应面法优化酶法提取芋头淀粉工艺参数[J].食品科学,2014,35(6):24-29.
[13]姜岁岁,杨洁,常然然,等. 短直链淀粉纳米颗粒的制备及其表征[J]. 现代食品科技,2016(9):254-259.
[14]Qin Y,Liu C,Jiang S,et al. Characterization of starch nanoparticles prepared by nanoprecipitation:Influence of amylose content and starch type[J]. Industrial Crops & Products,2016,87:182-190.
[15]吴修利,玉米淀粉修饰及其纳米颗粒制备与表征[D].长春:吉林大学,2015.
[16]Bao Z,Mei J Q,Bo C,et al. Digestibility,physicochemical and structural properties of octenyl succinic anhydride-modified cassava starches with different degree of substitution[J]. Food Chemistry,2017,229:136.
[17]李贵萧,牛凯,侯汉学,等.均质压力对玉米淀粉机械力化学效应的影响[J].农业工程学报,2017,33(1):271-277.
[18]秦一兵. 颗粒状冷水可溶玉米淀粉的制备及其性质[D].哈尔滨:哈尔滨工业大学,2012.
[19]Fredriksson H,Silverio J,Andersson R,et al. The influence of amylose and amylopectin characteristics on gelatinization and retrogradation properties of different starches[J]. Carbohydrate Polymers,1998,35(3-4):119-134.
[20]Lian X J,Liu L Z,Guo J J,et al.Screening of seeds prepared from retrograded potato starch increase retrogradation rate of maize starch[J].International Journal of Biological Macromolecules,2013.60:18l-185.
[21]Qiu C,Yang J,Ge S,et al. Preparation and characterization of size-controlled starch nanoparticles based on short linear chains from debranched waxy corn starch[J]. LWT-Food Science and Technology,2016,74:303-310.
[22]Fan D,Ma W,Wang L,et al. Determination of structural changes in microwaved rice starch using Fourier transform infrared and Raman spectroscopy[J]. Starch-Stärke,2012,64(8):598-606.
[23]谢耀宇. 蜡质马铃薯慢消化淀粉的制备及结构性质研究[D].合肥:合肥工业大学,2014.
[24]Zhang H,Jin Z. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers,2011,86(4):1610-1614.
[25]Liu C,Yang Q,Li X,et al. Preparation and characterization of starch nanoparticles via self-assembly at moderate temperature[J]. International Journal of Biological Macromolecules,2016,84:354.
[26]魏本喜. 淀粉纳米晶的制备、分散、改性及乳化性研究[D].无锡:江南大学,2015.
[27]康怀彬,尤晓颜,肖天天,等.嗜冷普鲁兰酶制备玉米抗性淀粉工艺优化及其表征[J].食品科学,2016,37(16):8-13.
[28]Sun Q,Gong M,Li Y,et al. Effect of retrogradation time on preparation and characterization of proso millet starch nanoparticles.[J]. Carbohydrate Polymers,2014,111(20):133-138.
[29]邱超. 纳米沉淀法制备淀粉纳米颗粒及其对活性成分装载特性的研究[D].青岛:青岛农业大学,2016.
